雌二醇调控VEGFα表达诱导肺腺癌A549细胞血管形成
任祥春,季 爽,张文英,费广鹤
(安徽医科大学第一附属医院呼吸与危重症医学科,安徽 合肥 230022)
肺癌是发病率和死亡率最高的恶性肿瘤,中国女性的肺癌发病率仅次于乳腺癌,位于第2位,但死亡率远高于乳腺癌,位于第1位[1]。男性和女性肺癌患者的发病特点不同,女性以非吸烟者居多,腺癌居多[2-3]。这种由性别差异造成的肺癌发病率不同,归因于内源性激素的差异[2]。雌激素是一种类固醇性激素,通过和受体结合发挥作用。雌激素受体主要包括雌激素受体α(estrogen receptor α,ERα)和雌激素受体β(estrogen receptor β,ERβ),其中ERβ是雌激素在肺部发挥生理效应的主要介导受体[4]。本课题组前期研究结果也表明,ERβ在绝经前女性肺腺癌患者癌组织中高表达[5],但具体的发病机制仍不清楚。血管内皮生长因子α(vascular endothelial growth factor α,VEGFα)是一种特异性较高,诱导肿瘤血管生成较强的调节因子,通过增加血管内皮的有丝分裂,促进血管内皮细胞迁移,重塑细胞外基质,增加血管通透性,与肺癌的发生、发展和转移密切相关[6-7]。本文旨在探讨雌激素调控肺腺癌A549细胞中VEGFα,诱导肺血管生成的发病机制,为深入研究靶向抑制药物和肺腺癌的治疗提供依据。
1 材料与方法
1.1 细胞株人肺腺癌A549细胞、人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),购自上海复旦大学细胞库。
1.2 试剂与仪器RPMI 1640、DMEM细胞培养基,购自Hyclone公司;胎牛血清(FBS),购自Gibco公司;基质胶,购自Corning公司;兔源性VEGFα和β-actin抗体,购自CST公司;MTT、胰酶消化液,购自上海碧云天生物技术有限公司;ELISA试剂盒,购自北京博凌科为生物科技有限公司;雌二醇(17β-estradiol,E2),购自Sigma公司;雌激素受体拮抗剂ICI),购自MCE公司。酶标仪、细胞培养箱(美国赛默飞公司);超净工作台(苏州金燕净化设备有限公司);低速离心机(德国Eppendorf公司);倒置显微镜与照像系统(日本Nikon公司);电泳仪、转印仪(美国伯乐公司)。
1.3 方法
1.3.1细胞培养与传代 将冻存的A549细胞和HUVEC细胞立即放入37 ℃温水中快速摇晃,直至融化,分别接种于含10% FBS的RPMI 1640培养液和含10% FBS的DMEM培养液中,37 ℃、5% CO2细胞培养箱中培养,隔日观察,弃去培养液,PBS洗3次,换取新的培养液。待细胞贴壁生长至培养皿的85%~90%时,弃去培养液,PBS清洗后,取1 mL的胰蛋白酶放入培养皿中,置于5% CO2细胞培养箱中消化2~3 min,显微镜下观察细胞消化情况,待细胞回缩变圆时,再分别用含10% FBS的RPMI 1640和含10% FBS的DMEM培养液轻轻吹打后重悬、离心,弃去上层液,用含10% FBS的培养液重悬,按1 ∶3比例传代,取对数生长期的细胞进行实验。
1.3.2Western blot 收集PBS组、10 nmol·L-1E2组、10 nmol·L-1E2+5 μmol·L-1雌激素受体抑制剂ICI组的A549细胞,提取蛋白,定量后,进行SDS-PAGE电泳;然后将蛋白从凝胶转移到PVDF膜;用5%的脱脂牛奶室温封闭2 h后,分别加VEGFα和β-actin的一抗 (1 ∶1 000稀释) 4 ℃过夜;次日,PBST洗膜,添加对应的二抗,室温孵育2 h,TBST洗膜,ECL显影,记录分析实验结果。
1.3.3酶联免疫吸附实验(ELISA) ELISA法检测A549细胞培养基中VEGFα水平,严格按照试剂盒说明书操作。
1.3.4MTT实验 本实验分为PBS组、10 nmol·L-1E2组、10 nmol·L-1E2+5 μmol·L-1ICI三组,分别评估HUVEC细胞增殖活力。收集HUVEC对数期细胞,调整细胞密度为3×104个每孔(边缘孔用无菌PBS填充)。5% CO2、37 ℃孵育至细胞贴壁,次日分别加入PBS、E2、E2+ICI预处理后的A549细胞培养基,设4个复孔,5% CO2、37 ℃孵育24 h,倒置显微镜下观察。每孔加入20 μL MTT溶液(5 g·L-1),继续培养4 h,弃去孔中的MTT溶液,然后加入150 μL DMSO,置摇床上低速摇晃10 min,使结晶物充分溶解。在酶标仪490 nm处测定吸光度OD值,计算样品浓度。
1.3.5划痕实验 将A549细胞分为3组,分别给予PBS、10 nmol·L-1E2、10 nmol·L-1E2+5 μmol·L-1ICI预处理,取5×105的HUVEC细胞接种于6孔板中培养,待其处于对数生长期时,使用20 μL的枪头在单层细胞表面划痕,PBS漂洗2次,再加入3组培养基继续培养24 h,分别在划痕后0、24 h拍照,观察细胞的相对迁移距离。使用ImageJ软件计算细胞迁移距离,迁移距离=(迁移前两侧细胞间距-迁移后两侧细胞间距)。
1.3.6小管生成实验 A549细胞分组同“1.3.5”。在96孔板上预先铺基质胶每孔50 μL,置于37 ℃孵箱中放置1 h凝固后,按50 000个/孔接种HUVEC细胞,分别加入3组A549细胞培养上清,37 ℃培养24 h后拍照记录,使用ImageJ软件计算小管形成长度。
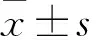
2 结果
2.1 E2和雌激素受体拮抗剂ICI影响A549细胞中VEGFα的表达如Fig 1A所示,与PBS组相比,E2组A549细胞中VEGFα蛋白表达水平明显增加(P<0.01);与E2组相比,E2+ICI组细胞中VEGFα蛋白表达明显降低(P<0.01)。采用ELISA法检测各组细胞培养上清中VEGFα的表达,趋势和Western blot检测VEGFα的蛋白表达一致(Fig 1B)。
Fig 1 Expression of VEGFα in A549 cells affected by E2 and ICI n=3)
A: Western blot analysis for VEGFα in A549 cells; B: ELISA analysis for VEGFα in A549 culture media.**P<0.01vsPBS group;##P<0.01vsE2 group.
2.2 E2和ICI作用的A549细胞上清对HUVEC细胞增殖能力的影响如Fig 2所示,与PBS组相比,E2组中HUVEC细胞的增殖能力明显升高(P<0.01);与E2组相比,E2+ICI组HUVEC细胞的增殖能力明显降低(P<0.05)。
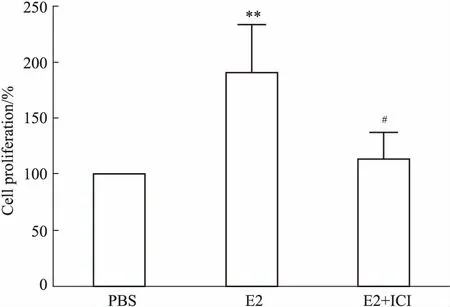
Fig 2 Cell proliferation of HUVECs cultured with A549 conditioned media by MTT n=3)
**P<0.01vsPBS group;#P<0.05vsE2 group
2.3 E2和ICI作用的A549细胞上清对HUVEC细胞迁移能力的影响Fig 3结果显示,是否添加VEGFα抗体,对HUVEC细胞的迁移距离有影响。未添加VEGFα抗体组中,与PBS组相比,E2组的细胞迁移距离明显增加(P<0.01);与E2组比较,E2+ICI组的细胞迁移距离明显减小(P<0.01)。加入VEGFα抗体组中,PBS组、E2组、E2+ICI组的3组间迁移距离差异无统计学意义。
A: HUVEC was cultured with A549 conditioned media without VEGFα antibody; B: HUVEC was cultured with A549 conditioned media with VEGFα antibody; C: The migration distance was analyzed.**P<0.01vsPBS group;##P<0.01vsE2 group.
2.4 E2和ICI作用的A549细胞上清对HUVEC细胞小管形成能力的影响Fig 4结果显示,是否加入VEGFα抗体,对HUVEC细胞的小管形成长度有影响。在未添加VEGFα抗体的组中,与PBS组比较,E2组的小管生成长度增加(P<0.01);与E2组相比,E2+ICI组的小管生成长度减小(P<0.01)。在添加VEGF抗体的组中,PBS组、E2组和E2+ICI组,3组间的小管生成长度差异无统计学意义。
A: HUVEC was cultured with A549 conditioned media without VEGFα antibody. The tube formation length was calculated 24 h later. B: HUVEC was cultured with A549 conditioned media with VEGFα antibody.The tube formation length was calculated 24 h later.C: The tube formation length was analyzed by ImageJ.**P<0.01vsPBS group;##P<0.01vsE2 group.
3 讨论
近年来,肺腺癌在无吸烟史的女性患者中发病率不断升高,但具体的发病机制仍不清楚,可能与女性内源性的性激素有关。本课题组的前期研究表明,与绝经后女性相比,绝经前女性肺腺癌患者癌组织中ERβ表达水平明显升高[5]。本实验在前期研究的基础上,进一步深入探讨雌激素和肺腺癌的关系。结果表明,E2和肺腺癌A549细胞中雌激素受体ERβ结合后,VEGFα的表达增加,促进了HUVEC细胞的增殖、迁移和小管形成;加入VEGFα抗体后,明显抑制了HUVEC细胞的迁移和小管形成。既往研究指出,在直径超过2 mm的实体肿瘤中,肺部肿瘤微环境中的血管形成,在肺癌细胞的生长、黏附、转移和侵袭中起主导作用[7-8]。由此可见,VEGFα在肺腺癌A549细胞的血管微环境形成中发挥重要作用。国内文献指出,乳腺癌中有70%~80%为雌激素受体阳性乳腺癌[9],所以在乳腺癌中关于此方面的研究较多,大量研究也支持我们的实验结果:E2通过和G蛋白偶联受体GPR30(GPER)结合,激活HIF-1α/VEGF信号通路,促进了乳腺癌肿瘤血管的形成[10-12]。在甲状腺癌中,E2通过激活PI3K/Akt信号通路,使VEGFα的表达量增加[13]。同时本实验结果还表明,雌激素受体拮抗剂ICI发挥抑制E2的促肿瘤微血管形成的作用。在肺癌的靶向治疗中,既往对经典的表皮生长因子受体(epidermal growth factor receptor,EGFR)靶点研究较多,但其突变率较低,服药后期的耐药率较高。因而,近年来在非小细胞肺癌靶向治疗中,采用酪氨酸激酶抑制剂联合雌激素受体抑制剂ICI,可有效增强抗肿瘤作用[14],但是在女性肺腺癌中缺少此方面的深入研究。本研究结果为女性肺腺癌的靶向精准治疗提供了理论依据。
综上所述,在肺腺癌A549细胞中,雌激素可能是通过和高亲和性的雌激素受体ERβ结合,增加了VEGFα的表达,促进肺腺癌血管内皮的增殖、迁移和小管形成能力;雌激素受体拮抗剂ICI和VEGFα抗体的作用相反。本实验的研究结果进一步证实了雌激素通过调控VEGFα的表达,在肺腺癌微血管形成中的重要作用,为临床治疗提供新思路。
(本实验是在安徽医科大学安徽省人兽共患病重点实验室完成,感谢沈继龙老师及其团队所给予的支持和帮助)

