泽泻汤加味方对盐敏感性HBZY21细胞中 AngII-NADPH-ROS信号通路的影响
崔海鹏 刘玉玲 刘凯 孙晓旭 王途 赵娟 张树峰



〔摘要〕 目的 探討泽泻汤加味方对盐敏感性肾小球系膜细胞中AngII-NADPH-ROS信号通路的作用机制。方法 采用高盐和AngII诱导大鼠肾小球系膜细胞的方法建立盐敏感性高血压体外细胞模型,设正常组、模型组、阳性药缬沙坦组、泽泻汤加味方(高、中、低剂量)组。CKK-8法测定细胞活性;RT-qPCR方法检测细胞中Agtr1a、Cyba、NOX4的mRNA表达水平;Western blot方法检测细胞中AT1R、P22、P47、NOX4的蛋白质表达水平;活性氧检测试剂盒检测细胞中ROS水平。结果 与正常组比较,模型组细胞中Agtr1a、Cyba、NOX4的mRNA表达水平、AT1R、P22、P47、NOX4蛋白表达水平以及ROS表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及泽泻汤加味方中剂量组Agtr1a、Cyba、NOX4的mRNA表达水平、AT1R、P22、P47、NOX4蛋白表达水平以及ROS表达水平显著降低(P<0.05)。不同浓度泽泻汤加味方组间,中剂量组对AngII-NADPH-ROS信号通路的下调作用最为明显。结论 泽泻汤加味方对盐敏感性高血压肾损害的保护作用可能与抑制AngII-NADPH-ROS信号通路有关。
〔关键词〕 盐敏感性高血压;肾损伤;泽泻汤;血管紧张素II;AngII-NADPH-ROS信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.03.010
Impact of Modified Zexie Decoction on the AngII-NADPH-ROS Signaling
Pathway in Salt-Sensitive HBZY21 cells
CUI Haipeng, LIU Yuling, LIU Kai, SUN Xiaoxu, WANG Tu, ZHAO Juan, ZHANG Shufeng*
(Chengde Medical College, Chengde, Hebei 067000, China)
〔Abstract〕 Objective To investigate the effect of modified Zexie Decoction on the angiotensin II (AngII)-NADPH-reactive oxygen species (ROS) signaling pathway in salt-sensitive glomerular mesangial cells. Methods An in vitro cell model of salt-sensitive hypertension was established by inducing rat glomerular mesangial cells with high salt and AngII. Cells were divided into normal group, model group, positive valsartan group, and high-, medium-, and low-dose modified Zexie Decoction groups. CKK-8 assay was used to determine the cell viability. RT-PCR was used to determine the mRNA expression levels of Agtr1a, Cyba, and NOX4. Western blot was used to determine the protein expression levels of AT1R, P22, P47, and NOX4 in cells. The ROS levels in cells were measured by a ROS assay kit. Results Compared with the normal group, the model group had significantly higher mRNA levels of Agtr1a, Cyba, NOX4, protein levels of AT1R, P22, P47, and NOX4, and ROS levels (P<0.05). Compared with the model group, the valsartan group and the medium-dose modified Zexie Decoction group had significantly lower mRNA levels of Agtr1a, Cyba, and NOX4, protein levels of AT1R, P22, P47, and NOX4, and ROS levels (P<0.05). Among the three modified Zexie Decoction groups, the medium-dose group had the greatest downregulation of the AngII-NADPH-ROS signaling pathway. Conclusion The protective effect of modified Zexie Decoction against renal injury induced by salt-sensitive hypertension might relate to the inhibition of the AngII-NADPH-ROS signaling pathway.
〔Keywords〕 salt-sensitive hypertension; renal injury; Zexie Decoction; angiotension II; AngII-NADPH-ROS signaling pathway
盐敏感性高血压作为最常见的继发性高血压,严重威胁人类健康[1]。肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system, RAAS)相关的信号通路转导分子(AngII-NADPH-ROS信号通路)异常被认为是盐敏感性高血压发生的重要机制之一[2-4]。越来越多的研究表明,中医药治疗盐敏感性高血压,具有独特优势[5-6],前期研究证实,泽泻汤加味方在临床治疗盐敏感性高血压效果明显[7],动物实验表明,泽泻汤加味方对高盐高血压大鼠肾脏有明显的保护作用[8-9]。然而缺少运用科学实验方法对泽泻汤加味方治疗盐敏感性高血压作用及机制的实验研究。本文以盐敏感性高血压细胞模型作为研究对象,初步研究了泽泻汤加味方对RAAS相关信号通路AngII-NADPH-ROS信号通路的影响,为进一步将泽泻汤加味方研发成高效、安全的治疗盐敏感性高血压的新型降压药物提供可靠的实验依据。
1 材料
1.1 药物
泽泻汤加味方:泽泻(批号0171422112)、白术(批号160180101)、泽兰(批号512150401)、石菖蒲(批号170630),由承德医药集团责任有限公司提供;缬沙坦胶囊(批号X0796)购于北京诺华制药有限公司。
1.2 细胞株
大鼠肾小球系膜细胞株:HBZY21(武汉大学中国典型培养物保藏中心)。
1.3 主要试剂
DMEM-H(美国Hyclone公司);胎牛血清(美国Sigma公司);Trizol裂解液、RIPA裂解液、Bradford蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒、活性氧检测试剂盒(碧云天生物技术有限公司);TIANScript cDNA第一链合成试剂盒、SuperReal PreMix SYBR Green荧光定量检测试剂盒(天根生化科技有限公司);兔抗大鼠AT1R、P22、NOX4(Abcam公司);P47(Santa公司);兔抗大鼠β-actin抗体、HRP标记山羊抗兔二抗(Bioworlde公司)。PCR引物(大连宝生物工程有限公司合成),引物序列见表1。
1.4 主要仪器
T100 RT-qPCR仪、Mini-PROTEAN Tetra小型垂直电泳仪、半干转膜仪、多功能荧光酶标仪均购于美国Bio-Rad公司。
2 方法
2.1 药物制备
泽泻汤加味方:泽泻21 g,白术9 g,泽兰15 g,石菖蒲15 g按比例配备,加8倍体积超纯水浸泡4 h,煎煮1 h,过滤取滤液,药渣中再加6倍体积超纯水,煎煮1 h,过滤取滤液,将2次滤液合并,浓缩制成60 g/L水煎剂,保存于-20 ℃冰箱中备用。
2.2 盐敏感性高血压细胞模型建立
复苏HBZY21细胞,用加有10%胎牛血清、1%青链霉素的DMEM-H培养基,置于37 ℃、5%CO2培养箱培养。待细胞长至培养皿80%开始传代,取第5~9代细胞对数生长期的细胞接种于6孔板内培养,采用NaCl 137 mmol/L和AngII10-6 mmol/L刺激HBZY21细胞24 h,设模型组、缬沙坦(1 μmol/L)组、泽泻汤加味方高(2 mg/L)、中(1 mg/L)、低(0.5 mg/L)剂量组,分别干预处理24 h,另设正常肾小球细胞作为对照。收集细胞,分别提取总RNA及蛋白质,以备后续实验。
2.3 细胞活力检测
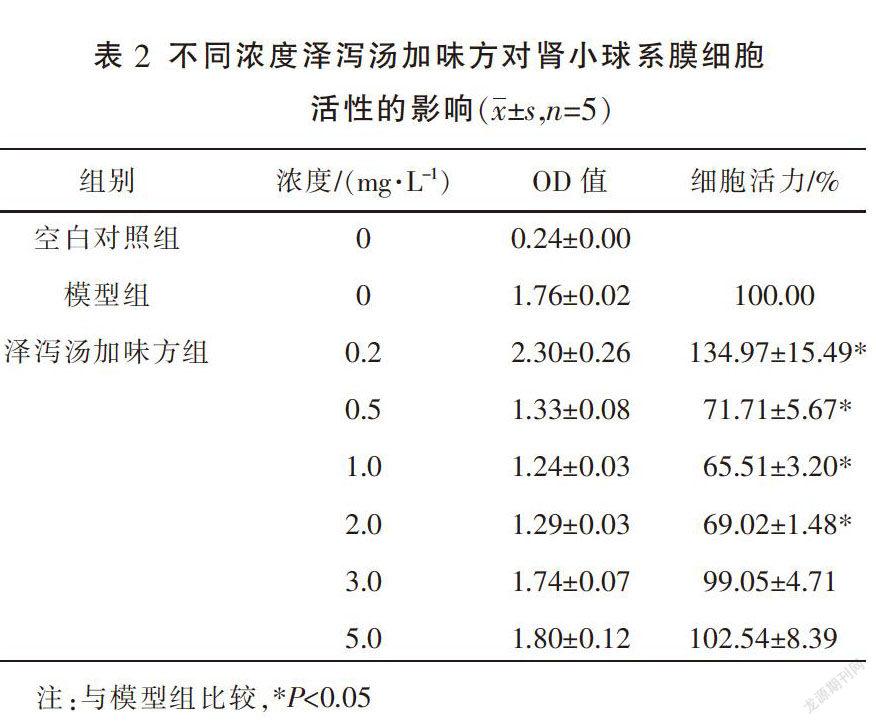
采用CCK-8法,取对数增长期的细胞,按1×105个/mL密度接种于96孔板内,每组设5个复孔,加入含NaCl 137 mmol/L和AngII 10-6 mmol/L培养基内培养24 h,分为空白(无细胞)对照组,模型组,不同浓度的泽泻汤加味方组:0.2、0.5、1、2、3、5 mg/L,置于37 ℃、5%CO2培养箱中培养24 h,每孔加入10 μL的5 g/L的CKK-8液,置于培养箱内孵育1~2 h,于酶标仪460 nm波长处测定各孔OD值。
细胞活力=(泽泻汤加味方组OD值-空白对照组OD值)/(模型组OD值-空白对照组OD值)×100%。
2.4 RT-qPCR法检测mRNA的表达
根据细胞活力实验设定泽泻汤加味方高(2 mg/L)、中(1 mg/L)、低(0.5 mg/L)剂量组,另设模型组、缬沙坦(1 μmol/L)组,各组均采用NaCl 137 mmol/L和AngII 10-6 mol/L刺激HBZY21细胞24 h,再分别给药处理24 h。收集正常组和各处理组细胞,分别提取总RNA及蛋白质,以备后续实验。Trizol法提取各组细胞总RNA,紫外分光光度计进行定量,TIANScript cDNA第一链合成试剂盒合成cDNA,SuperReal PreMix SYBR Green荧光定量检测试剂盒分别检测Agtr1a、Cyba、NOX4、β-actin mRNA的ct值,扩增条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 34 s,40个循环;做溶解曲线。以各目的基因ct值与β-actin mRNA的ct值的差值为△ct,采用2-△△ct法计算各基因mRNA的相对表达水平。
2.5 Western blot法检测蛋白质的表达
RIPA裂解液处理提取各组细胞的总蛋白,Bradford蛋白浓度测定试剂盒进行蛋白定量。45 μg蛋白于SDS-PAGE 12%分离胶分离并转膜,常温封闭1 h, AT1R(1∶800)、P47(1∶100)、P22(1∶500)、P47(1∶100)、NOX4(1∶2 000)、β-actin(1∶10 000)一抗4 ℃孵育過夜,洗膜后,加入HRP标记山羊抗兔二抗、兔抗小鼠二抗(1∶5 000),常温孵育l h,洗膜后用超敏ECL化学发光试剂盒显影。各蛋白目的条带灰度值与β-actin条带灰度值的比值作为各蛋白质的相对表达水平。
2.6 活性氧检测试剂盒检测ROS的表达水平
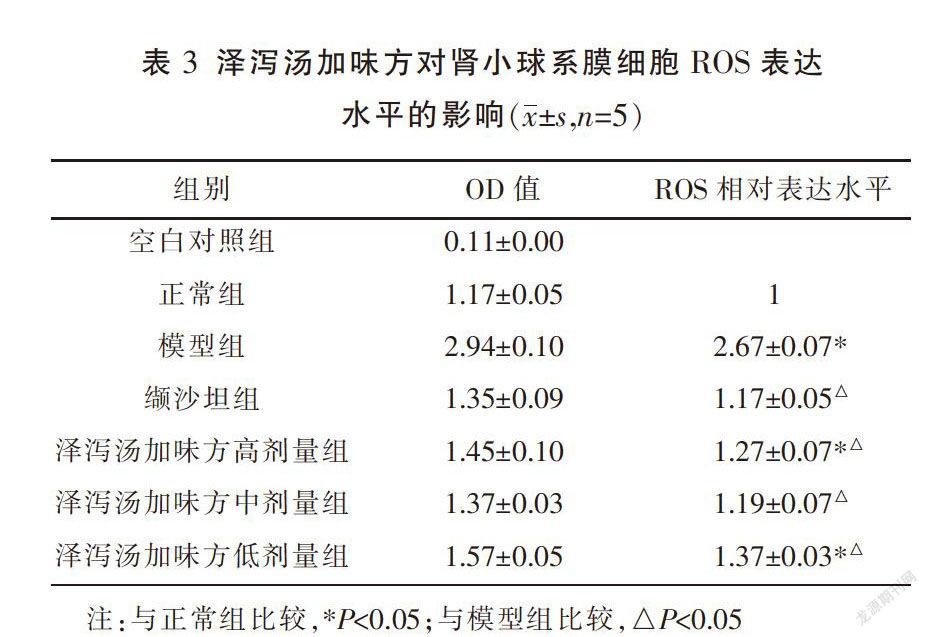
取对数增长期的细胞,按1×105个/mL密度接种于96孔板内,每组设5个复孔,加入含NaCl 137 mmol/L和AngII 10-6 mmol/L培养基内培养24 h,设模型组、缬沙坦(1 μmol/L)组、泽泻汤加味方中药高(2 mg/L)、中(1 mg/L)、低(0.5 mg/L)剂量组,分别干预处理24 h,另设分为空白(无细胞)对照组,正常肾小球细胞作为对照。去除培养液,每孔加入荧光探针DCFH-DA10 μmol/L,37 ℃孵育20 min,用无血清的无酚红培养基洗涤细胞3次,加入无酚红培养基后于荧光酶标仪下检测各孔OD值,激发波长488 nm,发射波长525 nm。以正常组OD值与空白对照组OD值之间的差值的平均值并归一后作为正常组ROS表达水平,其他各组
ROS相对表达水平=(实验组OD值-空白对照组OD值)/(正常组OD值-空白对照组OD值)。
2.7 统计学分析
采用SPSS 21.0统计软件进行分析,数据以“x±s”表示,各组间数据两两比较采用单因素方差分析检验。
3 结果
3.1 泽泻汤加味方对盐敏感性高血压细胞活力的影响
与模型组相比,0.2 mg/L泽泻汤加味方显著提高了细胞活力(P<0.05);而0.5、1、2 mg/L泽泻汤加味方不同程度地降低了细胞存活率(P<0.05),1 mg/L泽泻汤加味方抑制细胞增殖作用最明显;此外,3、5 mg/L泽泻汤加味方对细胞存活率无显著影响。见表2。
3.2 泽泻汤加味方对各组细胞Agtr1a、Cyba、NOX4
mRNA表达的影响
RT-qPCR结果显示,与正常组比较,模型组、泽泻汤加味方高剂量组细胞中Agtr1a的mRNA表达水平显著升高(P<0.05),模型组细胞中Cyba的mRNA表达水平显著升高(P<0.05),模型组、泽泻汤加味方低剂量组细胞中NOX4的mRNA表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及泽泻汤加味方高、中、低剂量组Agtr1a、Cyba、NOX4的mRNA表达水平显著降低(P<0.05)。各剂量泽泻汤加味方组中,泽泻汤加味方中剂量组Agtr1a、Cyba、NOX4的mRNA表达水平最接近正常组水平,组间差异无统计学意义(P>0.05)。见图1。
3.3 泽泻汤加味方对各组细胞AT1R、P22、P47、NOX4蛋白表达的影响
Western blot结果显示,与正常组比较,模型组细胞中AT1R、P22、P47、NOX4蛋白表达水平显著升高(P<0.05),泽泻汤加味方高、低剂量组细胞中AT1R、P47、NOX4蛋白表达水平显著升高(P<0.05),泽泻汤加味方低剂量组细胞中P22蛋白表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及泽泻汤加味方中剂量组AT1R、P22、P47、NOX4蛋白表达水平显著降低(P<0.05),泽泻汤加味方高剂量组细胞中AT1R、P22、NOX4蛋白表达水平显著降低(P<0.05),泽泻汤加味方低剂量组细胞中AT1R蛋白表达水平显著降低(P<0.05)。各剂量泽泻汤加味方组间,泽泻汤加味方中剂量组对AngII-NADPH-ROS信号通路相关蛋白的下调作用最为明显。见图2。
3.4 泽泻汤加味方对各组细胞中ROS表达的影响
ROS检测结果显示,与正常组比较,模型组、泽泻汤加味方高剂量组、低剂量组细胞中ROS的相对表达水平显著升高(P<0.05)。与模型组比较,缬沙坦组及各泽泻汤加味方给药组细胞中ROS的相对表达水平显著降低(P<0.05),其中泽泻汤加味方中剂量组ROS的相对表达水平接近正常组水平,组间差异无统计学意义(P>0.05)。见表3。
4 讨论
中国60%的高血压患者属于“盐敏感性高血压”,即机体摄入高盐大大超过肾脏的排盐能力范围继而血压随之升高,是造成我国盐敏感性高血压发病率明显增高的重要原因[1],韩运峰等[10]发现在感觉神经损伤性盐敏感性高血压大鼠中,RAAS不完全受抑制,提示该模型的形成与RAAS中AngII-NADPH-ROS信号通路异常激活有关。
血管紧张素II(angiotensionII,AngII)是RAAS中最重要的效应因子。正常情况下,AngII通过与其受体AT1R结合,使交感神经末梢释放递质增多来维持体液稳态,起到正常调节血压作用。然而在各种致病因素的损害下,使这种体液稳态被破坏,则可导致盐敏感性高血压的发生[11-12]。故本研究采用高盐和AngII作为致病因素来破坏HBZY21大鼠肾小球系膜细胞的体外生存稳态,在体外水平模拟盐敏感性高血压模型。实验结果发现,模型组细胞中Agtr1a的mRNA以及其翻译的AT1R蛋白表达水平较正常组显著升高,表明高盐和AngII的共同刺激可促进AT1R的表达,AngII进入细胞与其受体AT1R的结合在细胞中发挥关键作用。烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate oxidase, NADPH)氧化酶是一个由NADPH氧化酶NOX4、催化亚基p22和调节亚基p47等组成的多亚基复合体,在细胞内,AngII可与AT1R结合促进NADPH释放电子到细胞膜外与氧分子结合生成活性氧物质(reactive oxygen species, ROS)[13]。在病理状态下,ROS的过表达可引起盐敏感性高血压患者氧化应激反应增强,促进肾小球系膜细胞的增殖,肾小管血管内皮功能障碍或损伤,血管壁中膜肥厚,纤維化及炎症反应,加剧肾损害[14-15]。本实验结果发现,盐敏感性高血压细胞内NOX4的mRNA表达水平以及P47、NOX4蛋白表达水平显著升高,说明AngII-NADPH-ROS信号通路的活化在盐敏感性高血压细胞中发挥关键作用。
缬沙坦可阻断AngII与其受体AT1R结合,抑制AngII-NADPH-ROS信号通路的活化[16],最终达到治疗盐敏感性高血压的目的。本实验结果也证明缬沙坦可显著抑制盐敏感性高血压细胞中AngII-NADPH-ROS信号通路的活性。但长期服用缬沙坦等药物,患者会出现头痛、头晕、病毒感染、上呼吸道感染、咳嗽、腹泻、疲劳、鼻炎、背痛、恶心、咽炎及关节痛等副作用,对患者机体造成新的损害[17]。中药则具有药性温和、不良反应少等特点。本研究采用的中药泽泻汤加味方在临床治疗盐敏感性高血压效果明显[7],然而其具体治疗作用的分子机制研究较少。
泽泻汤加味方是在汉·张仲景《金匮要略》泽泻汤(泽泻、白术)的基础上,结合高血压病程中普遍存在的水浊内结、痰湿阻滞、瘀血阻络的研究成果,加用活血、祛痰、开窍的泽兰、石菖蒲组成。有研究表明,泽泻汤加味方可下調高盐高血压肾损害大鼠肾皮质中AT1R、AT2R的mRNA表达水平[18]。本研究中发现,采用0.5、1、2 mg/L的泽泻汤加味方可显著抑制盐敏感性高血压细胞的活性力。同时,进一步的分子机制研究发现,泽泻汤加味方中剂量组(1 mg/L)较模型组细胞中Agtr1a、Cyba、NOX4的mRNA及AT1R、P21、P47、NOX4的蛋白表达水平显著降低,其细胞内的ROS的活性显著降低。由此表明泽泻汤加味方中剂量组对AngII-NADPH-ROS信号通路的下调作用最为明显。
综上所述,泽泻汤加味方可下调盐敏感性高血压细胞中AngII-NADPH-ROS信号通路的活化水平。我们推断其作用机制,可能是通过占据缬沙坦AT1R结合部位,阻断AngII与其受体结合,抑制AngII-NADPH-ROS信号通路有关的信号转导分子表达,进而起到治疗高血压的作用。而其具体作用机制有待于进一步证实。
参考文献
[1] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华高血压杂志,2011,19(8):707-743.
[2] 王 丽,卢成志,张 欣,等.经皮肾脏交感神经射频消融术对顽固性高血压患者肾素血管紧张系统的影响[J].中华心血管病杂志, 2013,41(1):3-7.
[3] VON LUEDER T G, KRUM H. RAAS inhibitors and cardiovascular protection in large scale trials[J]. Cardiovasc Drugs Ther, 2013, 27(2):171-179.
[4] PRAJAPATI H, MCCALLUM A, FINLAY E. Hypertension, secondary to a renal artery aneurysm, treated by ex vivo aneurysm repair and autotrans plantation[J]. BMJ Case Reports, 2012,19(6):1725-1726.
[5] 曾 勇,张 稳,叶舒婷,等.中西药物对高血压病炎症反应干预作用的研究进展[J].中西医结合心脑血管病杂志,2014;12(1):85-87.
[6] 王 超,孙 磊,王振滔,等.联合中药对高血压治疗的研究进展[J]. 吉林医药学院学报,2018,39(4):290-292.
[7] 范洪亮,张树峰,张连和,等.泽泻汤加味方治疗高血压80例降压效果临床观察[J].中国心脏与心律电子杂志,2016,4(1):3-6.
[8] 张婷婷,蒋希成,吴鑫宇,等.泽泻汤加味方对高盐条件下Dahl大鼠高血压调节及肾功能的保护作用[J].中医药信息,2017,34(3):44-46.
[9] 何红梅,梅爱敏,田河林,等.泽泻汤加味方对高盐诱导大鼠高血压肾功能损害的保护作用[J].山东医药,2017,57(17):31-33.
[10] 韩运峰,苏诚坚,区碧如.非洛地平缓释片及缬沙坦对感觉神经损伤性盐敏感性高血压大鼠的降压作用及其机制探讨[J].中华心血管病杂志,2005,33(3):255-259.
[11] WOLAK T, ALIEV E, ROGACHEV B, et al. Renal safety and angiogenesis II blockade medications in patients undergoing non-emergent coronary angiography: a randomized controlled study[J]. Israel Medical Association Journal, 2013,5(11): 682-687.
[12] TUCKER S, CHEN Y, ABELL R. In patients with chronic
diabetic nephropathy, do angiotensin converting enzyme inhibitors (ACEI) have greater renal protective effect as compared to angiotensin receptor blockers (ARB)[J]. J Okla State Med Assoc, 2013,106(7): 294-295.
[13] KUSHIRO T, FUJITA H, HISAKI R, et al. Oxidative stress in the Dahl salt-sensitive hypertensive rat[J]. Clinical and Experimental Hypertension, 2005,27(1):9-15.
[14] LIU L, WU X, XU H, et al. Myocardin-related transcription factor A (MRTF-A) contributes to acute kidney injury by regulating
macrophage ROS production[J]. Biochim et Biophysica Acta (BBA)-Molecular Basis of Disease, 2018, 1864(10):3109-3121.
[15] 简怡娟,程锦国,董飞侠.NOX通过ROS介导促肾纤维化作用[J]. 中国医师杂志,2015,17(7):1108-1110.
[16] ARDIANA F, SUCIATI, INDRAYANTO G. Valsartan[J]. Profiles of Drug Substances, Excipients and Related Methodology, 2015,40:431-493.
[17] 冯 柏,王 屏,宁 彰.缬沙坦致不良反应74例文献分析[J].中国新药杂志,2010,19(12):1094-1096.
[18] 陈景彦,陈炳宏,范洪亮,等.泽泻汤加味方对高盐高血压肾损害大鼠AT1R、AT2R mRNA表达的影响[J].中医杂志,2016,57(5):428-430.

