玉米芯水热预处理酶解糖化
孙军涛 张智超 肖付刚 兰天璐 詹静 宋启伟 胡锦辉 郅文莉

摘要:优化玉米芯超微粉碎后水热预处理工艺,用扫描电镜和高效液相色谱仪分别对水热预处理后的玉米芯组织结构和酶解糖化组分进行分析。结果表明:水热预处理温度为190℃、时间60 min时,提取液中总糖含量最高(314 mg/g);玉米芯水热预处理后结构呈卷曲状,随着温度升高卷曲越明显,结构越疏松,表面呈现微孔结构;水热预处理温度190℃、时间60 min时,提取液中葡萄糖、木二糖、木三糖和木四糖的得率分别为0.001 mg/g、16. 740mg/g、4.306 mg/g和3.164 mg/g,提取液酶解后组分中葡萄糖、木二糖、木三糖和木四糖的得率分别为4.774 mg/g、64. 437 mg/g、6.853 mg/g和1.835 mg/g。
关键词:水热预处理;玉米芯;木聚糖酶;酶解糖化
中图分类号:TS209
文献标识码:A
文章编号:1000-4440( 2019) 03-0696-05
将木质纤维素原料高效地转化为单糖或低聚糖,进一步发酵成酒精,对开发新能源,保护环境具有非常重要的现实意义,是实现社会可持续发展的重要途径[1-3]。中国是一个农业大国,玉米是中国三大粮食作物之一。据统计,2017年中国玉米总产量约为2.16x108 t,按照3 kg玉米产1 kg玉米芯计算,2017年可产生0.72x108 t左右的玉米芯。玉米芯木质纤维素是潜在的生物质资源,可作为生产乙醇和功能性低聚糖的原料。
水热预处理方法( Hydrothermal pretreatment)是在高温条件下(160 - 240℃)水自电离产生氧离子形成水合离子,使得对酸不稳定的糖苷键断裂,从而使半纤维素解聚并且从生物质基质中溶解出来,并使部分纤维素水解,以消除对纤维素酶的空间阻碍,从而提高酶解效率[4]。在众多的预处理方法中,由于水热预处理方法不需要添加任何化学试剂,水解产物中抑制乙醇发酵的因素极少等优点[5-8],此作为一种新兴的绿色环保处理技术已成为近年来研究的热点。
本研究选择玉米芯为原料,通过对水热预处理工艺条件的优化,以及结构分析和酶解糖化后组分分析,为玉米芯木质纤维素资源的全组分高值化利用奠定理论基础。
1 材料与方法
1.1 主要材料与仪器
玉米芯取自河南省许昌县。木聚糖酶购自上海源叶生物科技有限公司,3,5-二硝基水杨酸购自国药集团化学试剂有限公司,葡萄糖(纯度>98%)、木糖(纯度>98%)和木二糖(纯度>98%)购自上海化成发展有限公司,木三糖和木四糖购自上海甄准生物科技有限公司,其余试剂均为国产分析纯。
扫描电子显微镜( EVO LS15),英国蔡司公司产品;傅里叶变换红外光谱仪(FTIR-650),天津市港东科技发展股份有限公司产品;分析天平( FA1004B),上海佑科仪器仪表有限公司产品;紫外分光光度计(T6),北京普析通用仪器有限责任公司产品;超微粉碎机(NLD-6DI),济南纳力德超微粉碎技术公司产品;高效液相色谱仪( 1260 infinity),安捷伦科技(中国)有限公司产品;反应釜,上海予华科技仪器设备产品。
1.2 测定方法
1.2.1 还原糖含量的测定還原糖含量的测定采用DNS法[9]。
1.2.2 总糖含量的测定 向待测液中加入终质量浓度为72 g/L的浓硫酸,沸水浴2h,用6 mol/L氢氧化钠溶液中和至中性。按还原糖的测定方法测定待测液中总糖含量[iO]。
1.3 水热预处理玉米芯
超微粉碎后的玉米芯,按照1:6(质量体积比)的料液比加水后置于高压反应釜中,在150 -190℃下分别处理20 min、40 min、60 min、80 min和100nun。过滤后得到提取液,并将滤渣烘干备用。
1.4 酶解糖化
将150 -190℃水热预处理60 min后的提取液添加1%的木聚糖酶(质量体积比),50℃水浴酶解30 min。然后置于90℃下灭酶10 min,冷却,得到酶解液[ll]。
1.5 玉米芯组织结构扫描电镜分析
采用扫描电子显微镜( SEM)分别对超微粉碎后的玉米芯、水热预处理后玉米芯和酶解后的玉米芯的微观结构进行分析,研究不同处理条件下玉米芯组织结构变化。
1.6 玉米芯水热预处理和酶解糖化组分分析
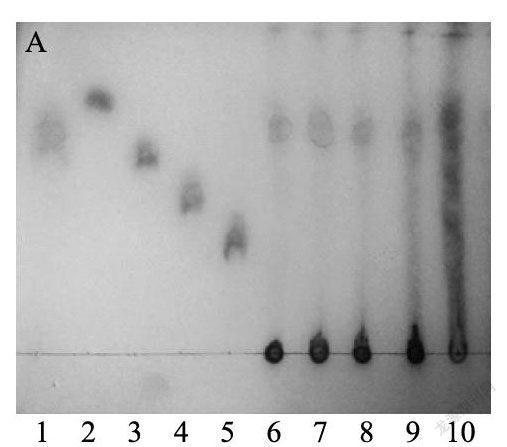
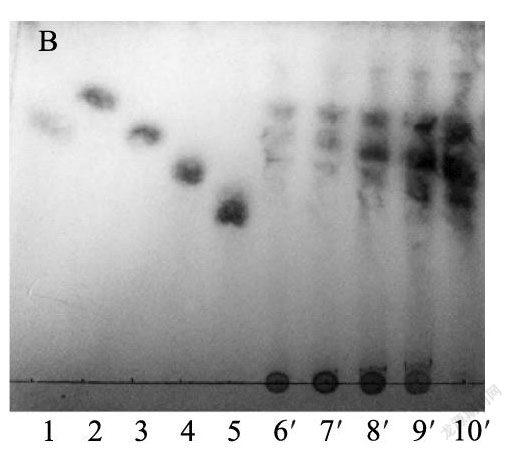
1.6.1 薄层层析分析层析板为硅胶板,展开剂为乙腈和水(体积比85:15),显色剂为甲醇和5%硫酸(体积比为95:5)。分别对水热预处理提取液和酶解糖化液组分进行定性分析[12]。
1.6.2 高效液相色谱分析 色谱柱为Hi-Plex Na(300.0 mmx7.7 mm,ioILm),流动相为水,流速为0.2 ml/min,柱温78℃。分别对水热预处理提取液和酶解糖化液组分进行定量分析[13]。
2 结果与分析
2.1 温度对水热预处理玉米芯的影响
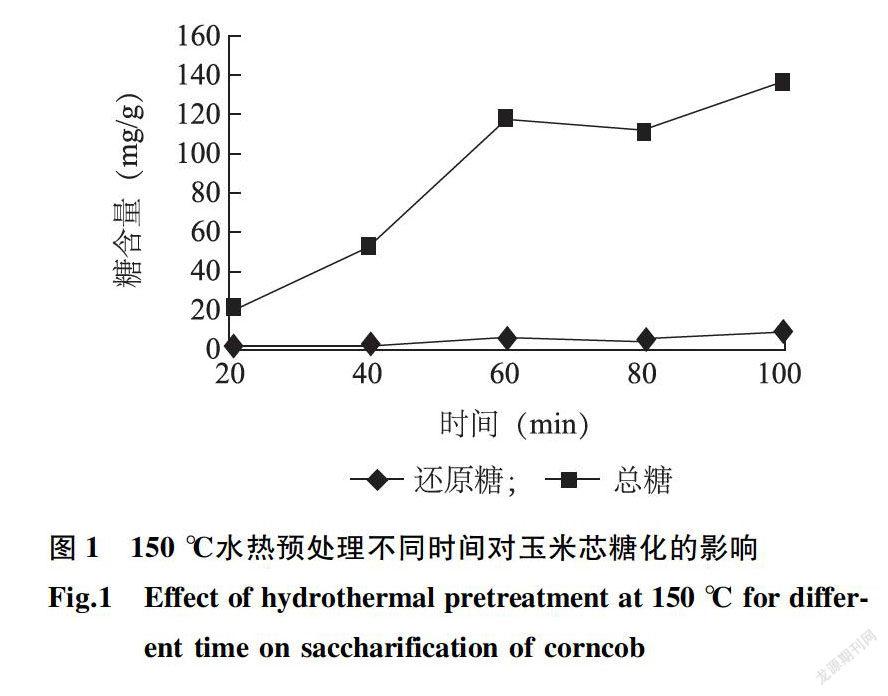
150℃水热预处理玉米芯不同时间对还原糖、总糖的影响如图1所示。随着时间延长,还原糖的含量变化不明显,总糖含量先增加再减少最后又增加。在高温条件下木聚糖脱乙酰形成乙酸,降低了体系的pH,阿拉伯糖的主链和侧链都发生了水解,木聚糖从原来的组织结构中游离出来,聚合度降低,溶解度提高,导致总糖含量增加。
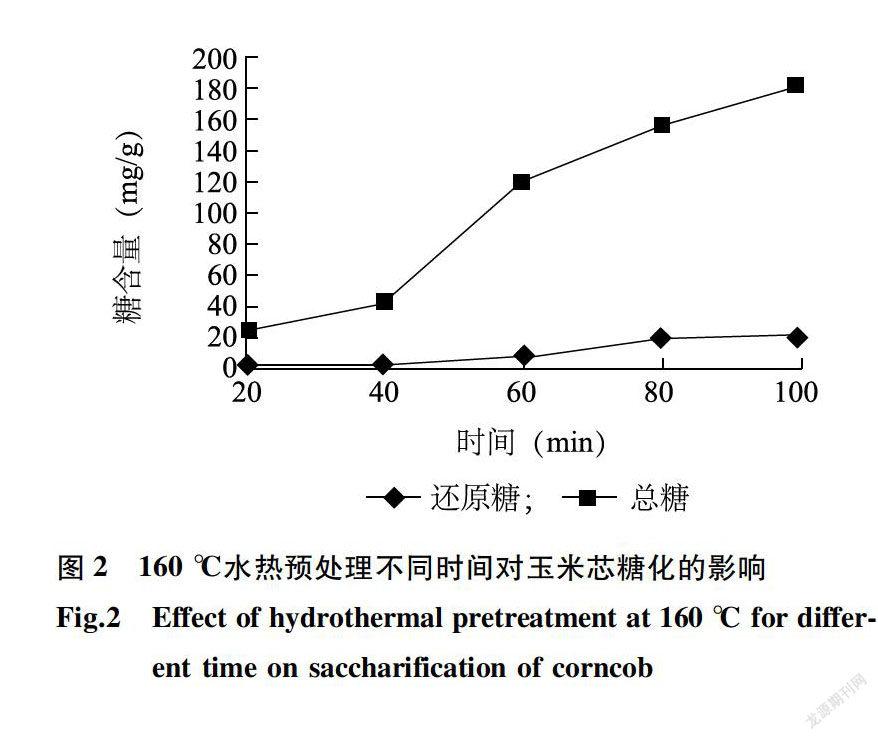
在160℃水热预处理中,随着时间的延长,还原糖和总糖的含量均呈现增加的趋势,其中还原糖含量增加缓慢,总糖含量增加明显(图2)。说明延长预处理时间,可以大幅度提高总糖的得率。木聚糖水解生成低聚木糖,低聚木糖的得率大于单糖。
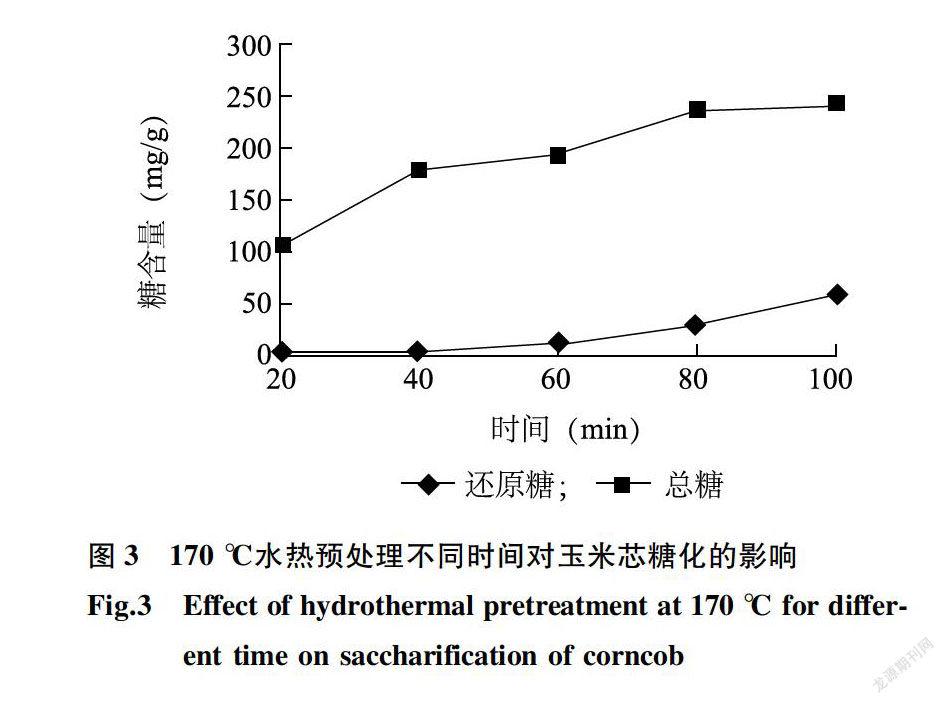
170 ℃水热预处理中,随着时间的增加,水解液中还原糖和总糖含量均呈现增加趋势,并且其含量比160℃水热预处理的含量高出很多(图3)。说明增加温度,有助于纤维素和半纤维素的水解,使水解液中还原糖含量增加。
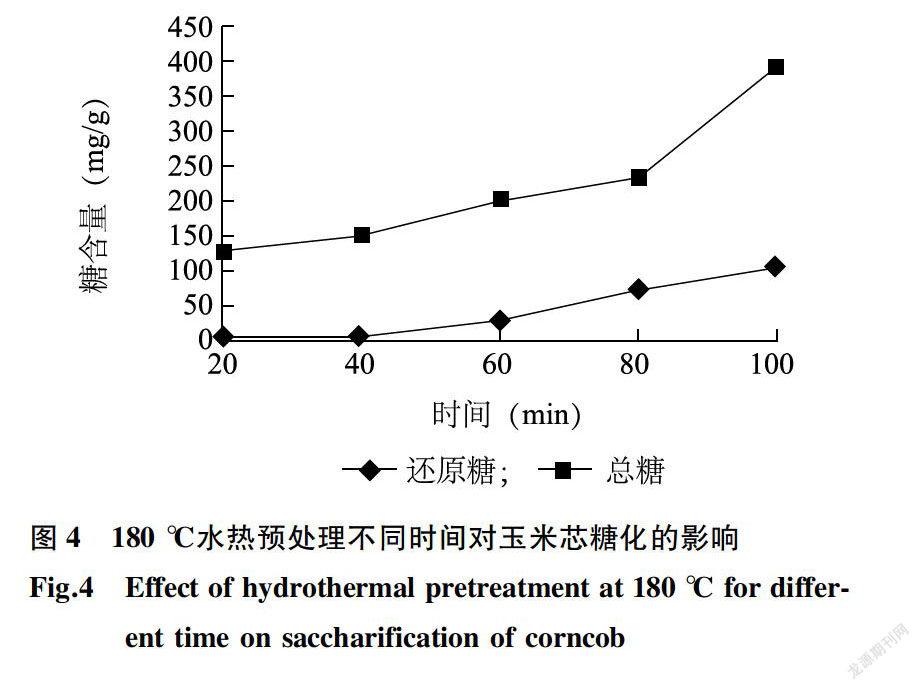
180 ℃水热预处理中,随着处理时间的增加,还原糖、总糖含量呈上升趋势(图4)。随着温度和处理时间的增加,玉米芯中纤维素、半纤维素和木质素结构遭到破坏[14],使得水解液中还原糖和总糖含量增加。
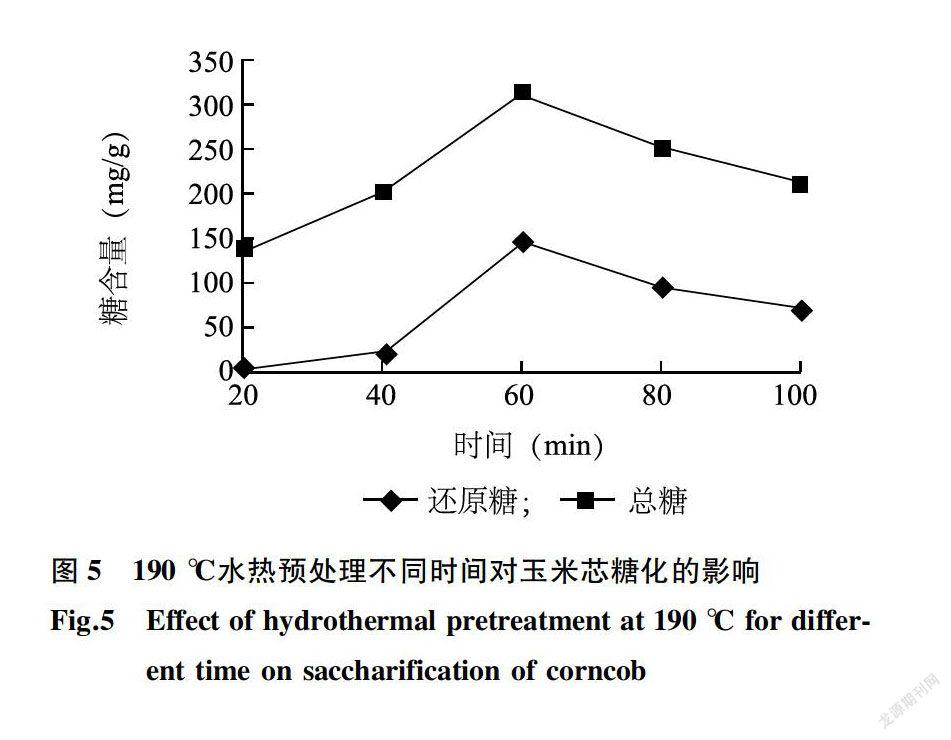
190 ℃水热预处理中,随着处理时间的延长,还原糖、总糖的含量先上升后下降,在60 min时还原糖、总糖含量达到了最高值(图5)。在此处理条件下,纤维素,木质素和半纤维素之间的化学键断裂,各自水解成相应的单糖。
2.2 不同温度水热预处理下玉米芯的组织结构变化
图6为超微粉碎玉米芯和水热预处理不同条件下玉米芯的扫描电镜图。未经处理的玉米芯结构完整,组织形态细密,表面光滑;水热预处理的玉米芯片状变为卷曲状,温度越高卷曲越明显,原来较为完整致密的玉米芯大块组织被撕裂成小块组织,形成了许多微孔,使原料结构疏松。与150 - 170 ℃ 60mm处理相比,180 ℃ 60 min和190℃60 min处理的玉米芯组织变得更为零散,组织结构微细化,存在大量碎片和块状组织,组织表面已经由处理前的平面结构变成蜂窝状结构。因为水热预处理后玉米芯组织结构受到破坏,表面积与体积比增大,部分结构分解,产生了低聚合度的糖类物质[15]。
2.3 玉米芯水热预处理提取液及酶解液组分分析
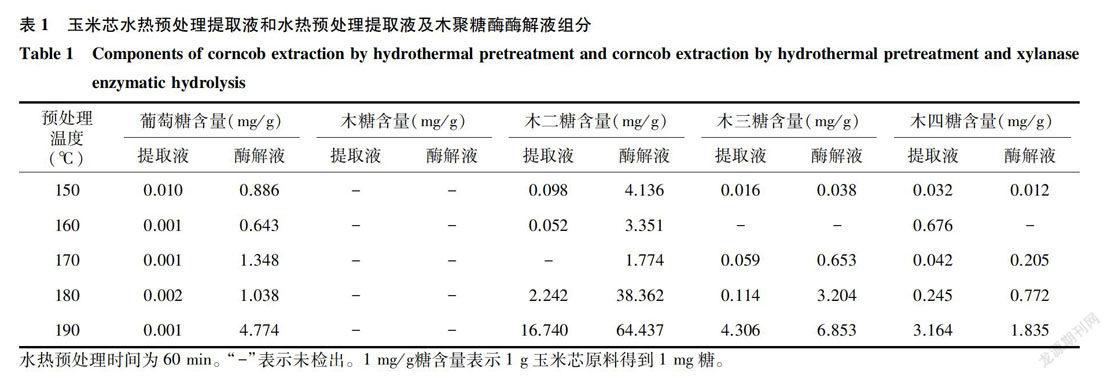
薄层层析分析结果(图7)和高效液相色谱分析结果(表1)表明,在190℃水热预处理60 min的提取液中木二糖含量较高,葡萄糖、木二糖、木三糖、木四糖的得率分别为0.001 mg/g、16. 940 mg/g、4.304mg/g、3.164 mg/g;提取液经木聚糖酶酶解后,葡萄糖、木二糖、木三糖、木四糖的得率分别为4. 771mg/g、64.437 mg/g、6.853 mg/g、1.835 mg/g。
3 结论
通过不同温度下水热预处理玉米芯后提取液组分糖含量变化分析可知,预处理温度越高,水解液中还原糖和总糖的含量越高,同一温度下处理时间的长短也会影响其含量。扫描电子显微镜分析结果显示,未处理的玉米芯原料组织结构为片状,经过水热预处理后,组织结构受到破坏,由片状变为卷曲状,温度越高卷曲越明显;处理后的玉米芯变得疏松多孔,呈蜂窝状结构。
水热预处理玉米芯提取液经木聚糖酶酶解后,组分主要含有葡萄糖、木二糖、木三糖、木四糖。水热预处理的温度和时间为190℃和60 min时提取液中糖得率较高,其中木二糖的得率最高,为16.940mg/g,此条件下提取液经木聚糖酶酶解后木二糖得率达到64. 437 mg/g。
参考文献:
[1]ZALDIVAR J,NIELSEN J,OLSSON L Fuel ethanol productionfrom lignoceLlulose: a challenge for metabolic metabolicengineering and process integration[J].Applied Microbiology andBiotechnology, 2001, 56( 1/2): 17-34.
[2] KAMM B,KAMM M.Biorefineries-multi product processes[J].Advances in Biochemical Engineering /Biotechnology, 2007, 105:175-204。
[3]孫曼钰,彭太兵,何士成,等.联合生物加T木质纤维素生产生物乙醇的研究进展[J].江苏农业科学,2018,46(8):5-10.
[4]SUN S N,SUN S L,CAO X F,et al-The role of pretreatment inimproving the enzymatic hydrolysis of lignocellulosic materials[J].Bioresource Technology, 2016, 199: 49-58.
[5]LEIF J J,CARLOS M. Pretreatment of lignocellulose: Formationof inhibitory by-products and strategies for minimizing their effects[J]. Bioresource Technology, 2016, 199: 103-112.
[6]郭晓亚,张莉,舒思韬,等,玉米芯水热预处理条件优化及木质素的结构表征[J].环境T程学报,2016,10(9):5210-5216.
[7]周婷.生物质不同方法预处理及酶解发酵的研究[D].北京:北京化T大学,2017.
[8]马贤武,王凯,刘轩,等,揉搓与稀碱联合预处理对水稻秸秆酶解产糖率及结构的影响[J].江苏农业学报,2018 ,34(6):1294-1299.
[9]MILLER G L Use of dinitrosalicylic acid reagent for determinationof reducing sugar[J].Analytical Chemistry, 1959, 31(3): 426-428.
[10]孙军涛,张智超,肖付刚,等.采用高温高压预处理玉米芯和复合酶法制备低聚木糖研究[J].河南农业大学学报,2018,52 (2):259-264.
[11]姚笛,叶曼曼,李琳,等.响应面法优化玉米芯中低聚木糖的酶法提取工艺[J].中国粮油学报,2014,29(11):14-18.
[12] SAMANTA A K, NATASHA J,KOLTE A P,et al.Enzymaticproduction of xylooligosacchandes from alkali solubilized xylan ofnatural grass( Sehima nervosum)[J].Bioresource Technology.2012. 112:199-205.
[13] DORRA D, SOUMAYA Z E,FATMA C, et al.Production and invitro evaluation of xylooligosaccharides generated from comcobs u-sing immobilized PeniciLlium occitanis xylanase[J].Journal of Mo-lecular Catalysis B:Enzymatic, 2014, 102: 146-153.
[14]张莉,王征,舒思韬,等,玉米芯水热预处理对纤维素结构的影响[J].上海大学学报,2017 ,23(3):464-472.
[15]王绍清,王琳琳,范文浩,等.扫描电镜法分析常见可食用淀粉颗粒的超微形貌[J].食品科学,2011, 32(15):74-79.

