丛枝菌根真菌对还田麦秆分解及玉米生物量的影响
贾艳艳 顾大路 杨文飞 吴传万 孙爱侠 诸俊 王伟中 杜小凤

摘要:通过盆栽试验探索接种丛枝菌根真菌摩西管柄囊霉(Funnelifon7zis mosseae)对麦秆分解速率、土壤微生物量、分解酶活性和玉米生物量的影响。结果表明,培养90 d,F mosseae能与玉米根系形成共生系统,定殖率超过63%,秸秆还田同时接种F mosseae菌剂显著提高了玉米根系干物质质量。与单独秸秆还田(对照)相比,接种F.mosseae菌剂并进行秸秆还田处理显著促进了麦秆的分解。培养90 d,接种F mosseae菌剂并进行秸秆还田处理的土壤微生物量以及与碳、氮、磷元素矿化相关的土壤纤维素酶活性、土壤蛋白酶活性和土壤碱性磷酸酶活性均显著高于对照。说明,接种F mosseae菌剂并进行秸秆还田处理可以通过提高土壤微生物量和分解酶的活性,直接或间接地影响小麦秸秆的矿化过程,正向调节农田土壤生态系统中有机质的养分循环。
关键词: 丛枝菌根真菌;秸秆分解;土壤酶活性;土壤微生物量
中图分类号:S154.36
文献标识码:A
文章编号: 1000-4440( 2019) 03-0612-06
作物秸秆是农作物的主要副产品,含有丰富的有机资源。近年来随着栽培水平的不断提高,秸秆量也不断增大,秸秆就地还田是秸秆绿色处理,维持农业可持续发展的重要手段[1-4]。越来越多的秸秆在农田土壤中被分解,作物秸秆的分解主要是在土壤微生物及其分泌的各种酶系统作用下,通过将复杂的有机化合物分解为简单的小分子来完成的[5-8]。土壤的生化过程受控于酶的催化活性,因此土壤微生物分解酶的活性决定着秸秆在土壤中的分解状态和最终的还田培肥效果。
丛枝菌根( Arbuscular mycorrhizal,AM)真菌是土壤微生物区系中分布最广泛的一类真菌,能与80%的陆生植物形成共生体,这种共生体的互利性是通过双向营养交换来体现的,即植物通过光合作用为菌根真菌提供碳水化合物,而菌根真菌通过其强大的外部菌丝系统提高植物对土壤矿质营养元素的吸收,增强植物对外界不良环境的抵抗能力[9]。自Hodge等[1O]报道AM真菌可加速有机物分解后,AM真菌对凋落物分解的积极作用日益受到重视。Cheng等[11]发现,增加二氧化碳浓度后,AM真菌能通过促进作物光合产物的释放来调控分解系统,推测AM真菌与分解系统之间存在供求关系。采用分根装置对AM真菌与凋落物的分解关系进行研究,证明接种AM真菌能够通过提高土壤酶活性,增加作用于玉米秸秆[12-13]和蚕豆秸秆[14]的微生物量和活性,加快秸秆的分解。在中等土壤养分环境中,AM真菌通过增大菌丝密度和硝酸还原酶的活性显著促进栓皮栎凋落叶的分解[15]。
小麦是全球主要粮食作物之一,还田麦秆的分解对整个农田土壤的养分具有主导和支配作用。明确接种AM真菌对农田麦秆分解过程的影响,对深入理解AM真菌在农田土壤养分循环系统中的作用有重要意义。到目前为止,在小麦一玉米轮作农田土壤生态系统中,AM真菌对还田麦秆分解过程的影响还缺少深入研究。本研究拟以盆栽玉米作为宿主植物,研究接种AM真菌对还田麦秆分解的影响,并通过测定玉米生物量、麦秆分解速率和分解酶活性的变化情况,解析AM真菌对麦秆分解的作用机理及对宿主生物量的影响,以期为AM真菌对还田麦秆的有效分解和元素转化机制研究提供参考。
1 材料与方法
1.1 试验材料
盆栽用土采集于江苏徐淮地区淮阴农业科学研究所科研创新基地麦田(ll9°3′57″E,33°52′89″N)。土壤类型为沙壤土,肥力一般,pH值为7.65。土壤(0-20 cm)有机质含量22.84 g/kg,全氮1.26g/kg,速效磷26.27 mg/kg,速效钾85. 35 mg/kg。采集的土壤风干后过2 mm筛,在121℃下湿热灭菌2h,备用。
供试玉米品种为苏玉30号。播种期为6月初,种子采用10% H202表面消毒10 min,用去离子水反复清洗数遍,沥干水分备用。供试秸秆为新鲜收获的淮麦30号地上部分麦秆,统一切割长度为( 10+2) cm,室内60℃烘干后备用。试验所用菌种为广适菌种摩西管柄囊霉(Funnelifornzis nzosseae),购自北京市农林科学院丛枝菌根真菌种质资源库。菌种预先经高粱盆栽繁殖,接种菌剂含有扩繁后产生的相应基质、AM真菌孢子、根外菌丝和植物根段,1g菌剂含有10-20个孢子。
1.2 试验设计
本试验采用室内盆栽法,设5个处理,分别为:盆栽玉米时接种灭活F.mosseae菌剂处理(M),盆栽玉米时接种F.mosseae菌剂(MG),盆栽玉米时接种灭活F.mosseae菌剂并进行秸秆还田处理(MS),盆栽玉米时接种F.mosseae菌剂并进行秸秆还田处理(MGS)以及单独秸秆还田对照(s),每个处理设3个重复。所用塑料盆大小为20 cmx 20 cm(口径×高),每盆放置4 kg灭菌土(含400g接种菌剂)。盆栽中秸秆还田量参考已报道的小麦草谷比,以中量级7 500 kg/hm在盆深15 cm土层处以网袋法直接还田[16]。各盆土壤放置麦秆后,在盆深10 cm处进行菌剂接种处理。玉米种子以1盆3粒进行播种。出苗后定苗1株,并每隔5d浇灌1次,1盆浇灌霍格兰氏营养液100 ml。所有盆栽置于人工氣候室中随机排列,生长期间控制土壤含水量保持在田间最大持水量的60% - 70%,室温维持在25 - 30℃,光照时间为10 h/d。
1.3 测定项目与方法
丛枝菌根真菌定殖率采用脱色一酸性品红染色法[7]测定。在成熟期进行测定,每个处理取100个0.5 -1.0 cm长的根段,在载玻片上染色固定,并进行镜检观察,记录染色结果。玉米生物量和秸秆剩余量采用称质量法测定,最后一次取样时取出盆中玉米的根系部分和麦秆网袋,小心去除表面土壤,65℃烘干至恒质量后称量计算。
土壤微生物量的测定采用底物诱导呼吸法[18]。将1.0 g新鲜土样加入100 ml的西林瓶中,加入1ml 0.01 g/ml的葡萄糖溶液,在通风处敞口放置30mm,测定瓶内CO,体积分数,封口25℃培养1 h后,再测一次CO,体积分数,计算2次测量结果的差值。土壤微生物量单位定义为1 g土样th内分解0. 01g葡萄糖所产生的C02量。土壤分解酶活性的测定按照周礼恺等[19]的方法,土壤纤维素酶单位酶活性(IU)定义为1g土样1 min分解产生1 mg葡萄糖所需的酶量,土壤脲酶IU定义为1g土样1h分解产生1 mg氨基氮所需的酶量,土壤蛋白酶IU定义为1g土样1 h分解生成1μg酪氨酸所需的酶量,土壤碱性磷酸酶IU定义为1g土样1 h分解产生l mg P205所需的酶量。
室内试验在江苏徐淮地区淮阴农业科学研究所中心实验室进行,所用溶液和化学试剂均为国药分析纯。
1.4 数据处理
90 d后的分解速率根据Olson[20]的方法计算,计算公式为:
根据玉米生物量计算AM真菌对玉米各部分菌根效应的贡献情况,计算公式:菌根效应=(菌根植物某部分干物质质量一相应非菌根植物某部分干物质质量)/菌根植物某部分干物质质量×100%。
试验数据用SPASS 19.0软件进行显著性分析,采用双因素方差法分析比较接种AM真菌和秸秆还田对土壤微生物量、土壤分解酶活性和玉米生物量的影响。
2 结果与分析
2.1 玉米菌根定殖率
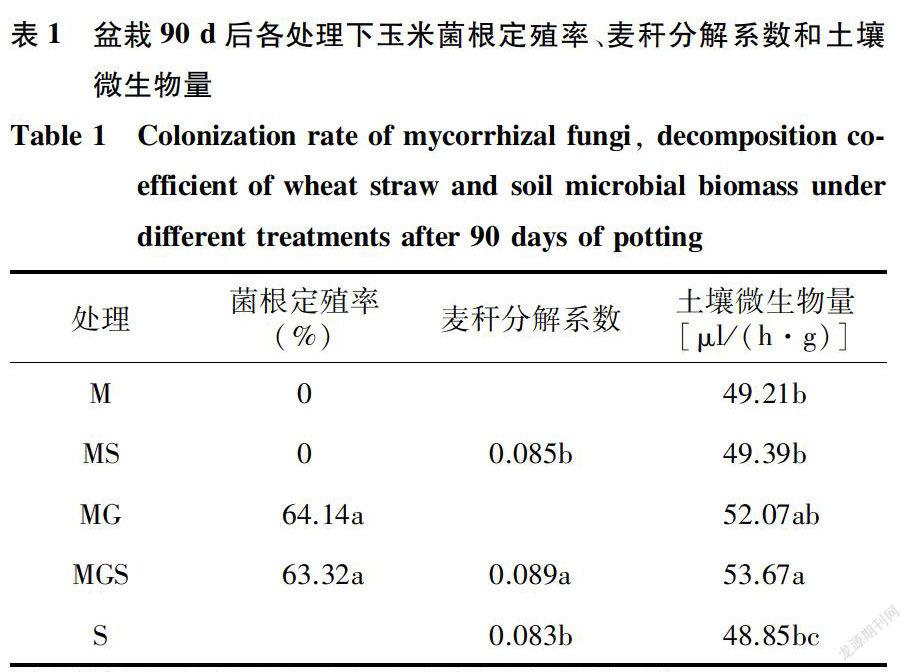
菌根定殖率反映了菌根真菌与玉米之间的亲和力,是菌株在土壤中与宿主共生生长状况的重要指示参数。M处理和MS处理的玉米根系中未检测出菌根真菌,菌根定殖率为0,MG处理和MGS处理的根际菌根定殖率分别为64.14%和63. 32%,二者间差异不显著(表1)。说明在当地土壤环境中Fmosseae成功与苏玉30号玉米形成菌根共生体。
2.2 接种AM真菌对还田麦秆分解速率的影响
分解系数是衡量分解速率的一个指标,分解系数越大其分解速度就越快。表1显示,经过90 d的盆栽分解试验,MS和MGS处理中小麦秸秆的分解系数均高于S对照,其中MGS处理显著促进麦秆的分解,与S对照相比,分解系数的增幅为7. 23%。MS处理下的麦秆分解系数为0.085,虽然高于S对照的0.083,但无显著差异。说明,接种丛枝菌根真菌能加快小麦秸秆的分解,提高麦秆中元素的矿化速率。
2.3 接种AM真菌对土壤微生物量和分解酶活性的影响
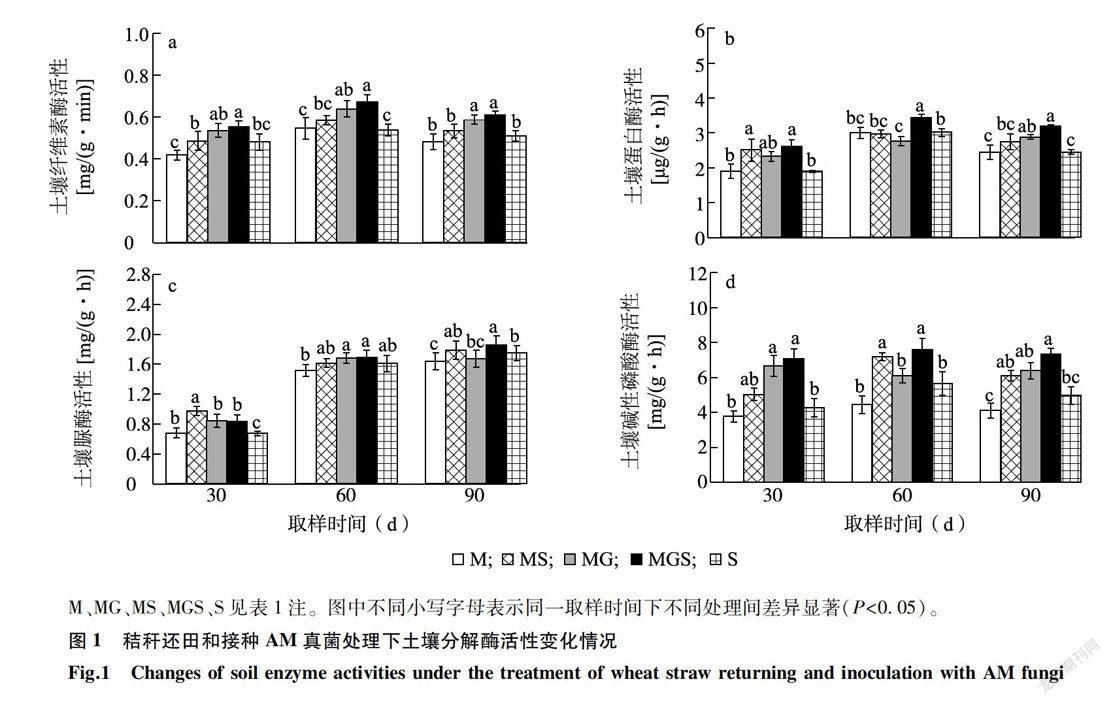
2.3.1 土壤微生物量 土壤微生物量是评价土壤基质中碳稳定性的重要指标。表1显示,S对照中土壤微生物量最低,与M处理、MS处理、MG处理相比无显著差异。与MS处理相比,MGS处理下土壤微生物量显著增加(P<0.05)。双因素方差分析结果(表2)表明,单独接种AM真菌以及接种AM真菌与秸秆还田二者的交互作用均显著影响土壤微生物量。 2.3.2 土壤分解酶活性图1显示,经过90 d的分解试验,与M处理、MS处理和S处理相比,MG处理和MGS处理下与碳分解相关的土壤纤维素酶活性、与氮分解相关的土壤蛋白酶活性以及与磷转化相关的土壤碱性磷酸酶活性较高。在整个试验过程中,土壤纤维素酶活性在MG处理和MGS处理下均高于其他处理,在第90 d表现出显著差异。培养90 d的双因素方差分析结果(表2)也表明,单独接种AM真菌以及秸秆还田和接种AM真菌二者的交互作用均对土壤纤维素酶活性有显著影响。
土壤蛋白酶和脲酶直接参与土壤含氮有机化合物的转化,其活性强度常用来表征土壤氮素供应强度。图1显示,MGS处理下的土壤蛋白酶活性最强,显著高于S对照。在30 d取样时,MS处理土壤脲酶活性最高,随着培养时间的增加,MGS处理脲酶的活性逐渐升高,在第90 d取样时,MGS处理脲酶活性最高。双因素方差分析结果(表2)显示,秸秆还田和接种AM真菌的交互作用会显著影响土壤蛋白酶和脲酶的活性,而且在第90 d取样时,MGS处理下的土壤蛋白酶和脲酶活性最高,说明秸秆还田条件下接种AM真菌能促进土壤蛋白酶和脲酶的分泌,加快秸秆中含氮有机化合物的分解。
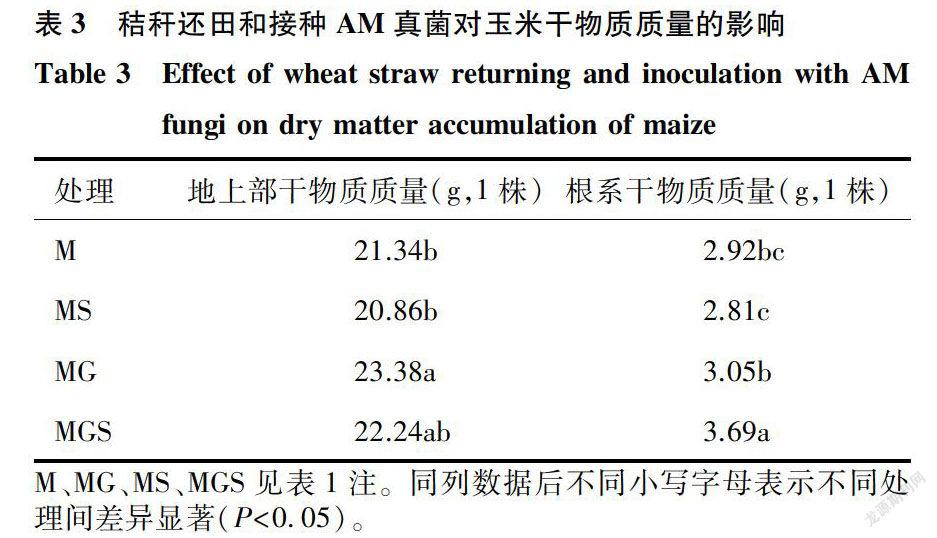
土壤碱性磷酸酶的主要功能是水解有机质中的磷脂键,提高有机磷的脱磷速度,提高土壤磷素的有效性。图l显示,在第90 d取样时,MGS处理下的土壤碱性磷酸酶活性显著高于M处理和S处理。第60 d取样时,MGS处理下土壤碱性磷酸酶活性最强,与S处理相比增加了40. 32% (P 表3显示,经过90 d的盆栽试验,秸秆还田和接种AM真菌对玉米地上和地下部分的生长均有很大影响。与M处理和MS处理相比,MG处理显著增加了玉米地上部干物质质量。MG处理玉米地上部干物质质量与MGS处理的差异不显著,说明接种AM真菌条件下进行秸秆还田并未显著增加玉米地上部生物量。与MS处理相比,MG处理和MGS处理玉米根系干物质质量显著增加。与MG处理相比,MGS处理显著促进了玉米地下部分的生长发育。双因素方差分析结果(表2)也表明,接种AM真菌显著促进玉米地上部干物质质量和根系干物质质量的增加,秸秆还田处理显著影响玉米根系干物质质量,而且接种AM真菌与秸秆还田处理之间的交互作用对玉米根系干物质质量的影响极显著,说明秸秆直接还田条件下接种AM真菌加快了玉米根系的生长,对根系的促生作用强。 3 讨论 接种AM真菌对玉米叶片养分含量、茎粗、总生物量和产量均有促进作用[21-22]。这种增产促进作用一般依赖于AM真菌与宿主之间的亲和力,即菌根定殖率。本试验中,MG处理下,AM真菌F.mosseae在宿主苏玉30号玉米根系中的定殖率达到64.14%。与MG处理相比,MGS处理下宿主植物玉米的地上部干物质质量没有显著变化,但玉米根系干物质质量显著提高,秸秆还田与接种AM真菌处理之间的交互作用对玉米根系干物质质量的影响极显著,这可能是因为秸秆还田条件下,玉米植株本身与AM真菌的共生作用,改变了根际的生态环境,影响了植株生物量的分配比例。 接种AM真菌能够促进麦秆的分解,增加土壤微生物量。AM真菌定殖宿主植物形成共生体,导致植物残体分解速率发生变化[23-24]。Nuccio等‘25]发现,AM真菌主要通过氮输出对土壤微生物群落结构进行调控,约10%的细菌群落、放线菌群落对AM真菌做出积极响应。有数据显示,在凋落物分解后期(180 d),AM真菌与土壤微生物群落相互竞争养分,抑制土壤中真菌和细菌的生长[24]。AM真菌对凋落物分解的促进作用与所在土壤的养分含量有关,在中等营养土壤环境中接种丛枝菌根真菌能够调控凋落物中氮素的矿化速度,加快分解[15]。本研究中,接种AM真菌处理的土壤微生物量与对照相比明显增加,可能盆栽玉米的适时追肥保证了土壤中足够的养分供给,使得AM真菌与土壤微生物分解功能群之间协调生长,减少了AM真菌与土壤微生物分解功能群对土壤养分的竞争。 土壤分解酶直接参与了土壤有机物质的矿化过程,是土壤系统生化反应大小和方向的调控者[26]。土壤酶主要来自土壤微生物的代谢,还有部分来自动植物分泌,其活性在一定程度上反映了微生物的代谢速率和土壤养分转化的动态进程[27-28]。AM真菌不能像腐生微生物群一样直接分泌分解酶,菌丝单独存在时并不能矿化土壤中的凋落物[29],但AM真菌能够促进土壤中多种酶的分泌,增强多种土壤酶(如β一葡萄糖苷酶[30]、碱性磷酸酶[31-32]、过氧化氢酶[13]、脲酶[32]和硝酸还原酶[15])的活性,对植物残体的降解产生作用[33]。本研究发现,接种AM真菌处理对与碳、氮和磷分解相关的土壤纤维素酶、土壤蛋白酶以及土壤碱性磷酸酶的活性有显著影响,故而本研究中AM真菌能够促进麦秆分解,是因为其除了通过对土壤微生物量进行调控外,还通过增加参与麦秆分解过程中的各种土壤酶活性来促进有机质的分解。 综上所述,小麦秸秆还田同时接种AM真菌的处理能够增加玉米根系干物质质量,通过提高土壤微生物量、土壤蛋白酶活性和土壤碱性磷酸酶活性,直接或间接地参与催化小麦秸秆的矿化过程,促进小麦秸秆的分解。通过根系微环境调控地下凋落物分解的过程是多元且复杂的,AM真菌与宿主根系活动以及秸秆分解之间的相互作用机制尚需进一步研究。摩西管柄囊霉菌作为优化促生菌种之一,可应用于玉米一小麦轮作农田地下有机质的养分循环研究中。 参考文献: [1] 曾宪楠,高斯倜,冯延江,等.水稻秸秆还田对土壤培肥及水稻产量的影响研究进展[J].江苏农业科学,2018,46(18): 13-16. [2]潘剑玲,代万安,尚占环,等,秸秆还田对土壤有机质和氮素有 效性影响及机制研究进展[J].中国生态农业学报,2013. 21(5):526-535. [3] 孙小祥,常志卅,靳红梅,等.太湖地区不同秸秆还田方式对作物产量与经济效益的影响[J].江苏农业学报,2017,33(1): 94-99. [4]宋朝玉,官明波,高倩,等.长期玉米秸秆还田模式下氮肥用量对玉米生长发育及土壤养分的影响[J].山东农业科学, 2017,49( 10):55-59. [5]BURNS R G.Enzyme activity in soil: location and a possible rolein microbial ecology[J].Soil Biology and Biochemistry, 1982, 14(5):423-427. [6]韩梦颖,王雨桐,高丽,等.降解秸秆微生物及秸秆腐熟剂的研究进展[J].南方农业学报,2017 ,48(6):1024-1030. [7] JIA Y, KONC X, WEISER M D, et al.Sodium limits litter de-composition rates in a subtropical forest: Additional tests of the so-dium ecosystem respiration hypothesis[J].Applied Soil Ecology,2015, 93:98-104. [8]尹蕾,王伟舵,陈子璇,等.水稻秸秆高效降解菌株的筛选鉴定及其降解产物分析[J].江苏农业科学,2018,46( 19):292- 296,305. [9]SELOSSE M, ROUSSET F. The plant-fungal marketplace[J].Sci-ence, 2011, 333( 6044): 828. [10] HODCE A, CAMPBELL C D, FITTER A H.An arbuscular my-corrhizal fungus accelerates decomposition and acquires nitrogendirectly from organic material[J].Nature, 2001, 413: 297-299. [11] CHENG L,BOOKER F L,TU C, et aL Arbuscular mycorrhizalfungi increase organic carbon decomposition under elevated C02[J]. Science, 2012, 337( 6098):1084-1087. [12]羅珍,朱敏,王晓锋,等,分根装置中接种AM真菌对玉米秸秆降解及土壤微生物量碳、氮和酶活性的影响[J].中国生态农业学报,2013,21(2):149-156. [13]郭涛,罗珍,朱敏,等.丛枝菌根真菌对玉米秸秆降解的影响及其作用机制[J].生态学报,2014,34( 14):4080-4087. [14]郭涛,石孝均,朱敏,等.分根装置中丛枝菌根真菌影响蚕豆秸秆降解作用研究[J].草业学报,2014, 23(5):263-270. [15] KONC X, JIA Y. SONC F,et al_Insight into litter decompositiondriven by nutrient demands of svmbiosis system through the hyphabridge of arbuscular mycorrhizal fung[J].Environmental Scienceand PoLlution Research, 2018, 25(6):5369-5378. [16]王虎,王旭东,田宵鸿,秸秆还田对土壤有机碳不同活性组分储量及分配的影响[J].应用生态学报,2014, 25( 12): 3491-3498. [17] PHILLIPS J M. HAYMAN D S.Improved procedures for clearingroots and staining parasitic and vesicular-arbuscular mycorrhizalfungi for rapid assessment of infection[J].Transactions of theBritish Mycological Society, 1970, 55(1):158-161. [18] BAILEY V L,PEACOCK A D, SMITH J L,et al.Relationshipsbetween soil microbial biomass determined by chloroformfumigation-extraction, substrate-induced respiration, and phospho-lipid fatty acid analysis[J].Soil Biology and Biochemistry, 2002,34(9):1385-1389. [19]周禮恺,张志明.土壤酶活性的测定方法[J].土壤通报,1980(5):37-38. [20] OLSON J S.Energy storage and the balance of producers and de-composers in ecological systems[J].Ecology, 1963, 44( 2):322-331. [21]钟旺,曾慧兰,王建武,Rt基因导入对侵染丛枝菌根真菌的玉米生长生理及磷转运基因表达的影响[J].中国生态农业学报,2017,25(8):1198-1205. [22]任稹,王建武,冯远娇,等,丛枝菌根真菌侵染Bt玉米及对其生长的影响[J].生态学杂志,2011, 30(6):1163-1168. [23]李欢,李晓林,向丹,丛枝菌根真菌对羊草凋落物降解作用的研究[J].生态环境学报,2010, 19(7):1569-1573. [24] CUI H, HYDE K, XU J,et al.Arbuscular mycorrhiza enhancethe rate of litter decomposition while inhibiting soil microbial com-munity development[J].Scientific Reports, 2017,7:42184. [25] NUCCIO E E,HODGE A, PETT R J,et al.An arbuscular my-corrhizal fungus significantly modifies the soil bacterial communitvand nitrogen cycling during litter decomposition[J].EnvironmentalMicrobiology, 2013, 15(6):1870-1881. [26] JIA Y, LYU Y, KONC X, et al.Insight into the indirect functionof isopods in litter decomposition in mixed subtropical forests inChina[J].Applied Soil Ecology, 2015, 86: 174-181. [27] TURNER S,SCHIPPERS A, MEYER-STUVE S,et al-Minera-logical impact on long-term patterns of soil nitrogen and phosphorusenzvme activities[J].Soil Biology and Biochemistry, 2014, 68:31-43. [28] FREEMAN C,OSTLE N, KANG H.An enzymic' latch' on aglobal carbon store[J].Nature, 2001, 409( 6817): 149. [29]NOTTINGHAM A T,TURNER B L,WINTER K, et al-Root andarbuscular mycorrhizal mycelial interactions with soilrmcroorganisms in lowland tropical forest[J].FEMS MicrobiologyEcology, 2013, 85(1): 37-50. [30] ARMADA E,LOPEZ-CASTILL0 0,ROLDAN A,et al- Potentialof mycorrhizal inocula to improve growth, nutrition and enzvmaticactivities in Retama sphaerocarpa compared with chemical fertiliza-tion under drought conditions[ J]. Journal of Soil Science andPlant Nutrition,2016, 16: 380-399. [31] ZAREA M J,KARIMI N, GOLTAPEH E M, et al.Effect of crop-ping systems and arbuscular mycorrhizal fungi on soil microbial ac-tivity and root nodule nitrogenase[J].Joumal of the Saudi Societyof Agricultural Sciences, 2011, 10(2):109-120. [32] ZHANG H, WU X, LI G,et al.Interactions between arbuscularmycorrhizal fungi and phosphate-solubilizing fungus(Mortierellasp.) and their effects on Kostelelzkya virginica growth and enzvmeactivities of thizosphere and bulk soils at different salinities[J].Biology and Fertility of Soils, 2011, 47(5):543. [33] ATUL-NAYYAR A, HAMEL C,HANSON K, et al. The arbuscu-lar mycorrhizal symbiosis links N mineralization to plant demand[J]. Mycorrhiza, 2009, 19(4): 239-246. (责任编辑:王妮)

