黄野螟中性肽链内切酶基因表达的时空动态
吕子豪 王春燕 林同



摘要:从黄野螟(Heortia vitessoides Moore)转录组文库中成功筛选到具有完整ORF框的黄野螟中性肽链内切酶基因( NEP)序列,命名为HvNEP(登录号:MH298329)。该序列ORF框长2 310 bp,共编码769个氨基酸。同源比对分析结果表明,HvNEP蛋白氨基酸序列与棉铃虫(Helicoverpa armigera Hubner) NEP蛋白氨基酸序列的同源性最高,达79%。RT-qPCR结果显示,HvNEP在黄野螟成虫中表达量最高,为卵(对照)的113. 77倍。HvNEP在黄野螟不同组织间存在表达差异,幼虫阶段在头部表达量最高,为体壁(对照)的5.28倍。成虫阶段,HvNEP在翅中表达量最高,为腹(对照)的11.06倍,在足中最低(0.11倍)。分析黄野螟NEP时空表达动态发现,HvNEP可能与昆虫行为的调控及神经系统的完善有关。在60 ng/μl和120 ng/μl的20-羟基蜕皮激素(20E)胁迫下,HvNEP表达量均高于对照,表明HvNEP作为蜕皮激素的次级应答基因,其表达受20-羟基蜕皮激素调节。
关键词:黄野螟;中性肽链内切酶;蜕皮激素
中图分类号: S435.79
文献标识码:A
文章编号: 1000-4440( 2019) 03-0573-08
黄野螟(Heortia vitessoides)属鳞翅目(Lepi-doptera)草螟科(Crambidae)齿螟亚科(Odonti-inae),是植物土沉香(Aquilaria sinensis)的重要食叶害虫[1-2]。该虫在中国南部分布广泛,主要活动范围在广东省、广西省、海南省、云南省、福建省以及中国台湾和香港等地[1]。其幼虫生长发育迅速,在爆发时期,虫口密度大,食量大,短时间内便可吃光被害树叶片,严重影响土沉香的产量和结香质量[3]。近年来,随着广东和海南等地大规模种植土沉香,黄野螟虫害问题愈发严重。
蛋白酶在多种生理系统中起着关键作用,其中M13家族的中性肽链内切酶(NEP)参与神经肽和肽激素的加工,主要由膜结合锌蛋白酶组成[4]。NEP属于M13锌金属蛋白酶家族,是一种Ⅱ型整合细胞膜糖蛋白[5],存在于多种细胞膜上。1974年,Ma等首次在兔肾小管的刷状缘发现NEP[6]。2001年,Zhao等在一种无脊椎动物家蚕(Bombyx mori)中克隆出中性肽链内切酶24.11 -like基因,并将其命名为bmNEP-l[7]。随后Butler研究发现,NEP在果蝇胸侧板、背侧和腹侧铰链中均有表达[8]。NEP与昆虫头部和足部的再生有关[9]。
M13金属蛋白酶参与调控哺乳动物的疾病,例如阿尔茨海默病[10-11]、炎症[12]、癌症[13]等,亦会影响生殖健康与繁殖[4,14-15]。然而,关于它们在昆虫中的生理作用研究较少。仅有的研究结果表明,NEP作为20-羟基蜕皮激素(20 -hydroxyecdysone,20E)次级应答基因,可能参与昆虫变态发育[9]和翅原基的形成[7,16]。研究NEP不仅对明确昆虫神经系统发育具有重要意义,而且对经济昆虫的利用、农林害虫的控制和昆虫生长调节剂与生物害虫农药的开发具有重要指导价值。因此,本研究从黄野螟转录组文库中筛选NEP基因,并对其进行生物信息学及时空表达分析,旨在为黄野螟NEP基因及其编码的蛋白质研究提供分子生物学信息。
1 材料与方法
1.1 试验材料
黄野螟幼虫采自广州天鹿湖森林公园,1-5龄幼虫在培养箱中用土沉香叶片饲养,老熟幼虫移至铺有沙土的塑料养虫盒中,待其化蛹羽化。饲养温度为26℃,相对湿度为70% - 75%,光照周期为光/暗= 14 h/10 h。
总RNA提取试剂盒(E.Z.N.ATM Total RNAKitⅡ),购自OMEGA公司;反转录试剂盒(Pri-meScript RT reagent Kit With gDNA Eraser)及实时荧光定量试剂盒( TB Green premix Ex TaqTM),均购自TaKaRa公司。20E试剂购自上海源叶生物科技有限公司。
1.2 试验方法
1.2.1 样品处理选取40头健康的4龄幼虫,经无菌水清洗后,在腊盘上解剖,获得幼虫的头、体壁、脂肪体、中肠、马氏管等样品,立即置于无菌去酶的EP管中,经液氮速冻后,存放在-80 ℃冰箱中备用。选取30头健康的1日龄成虫在腊盘上解剖,获取成虫的触角、足、头、胸、腹、翅等组织样品,立即置于无菌去酶的冻存管中,经液氮速冻后,存放于-80℃冰箱中备用。用二甲基亚砜( DMSO)将20-羟基蜕皮激素(20E)稀释至10 mg/ml,存放于-20 ℃冰箱备用。用lxPBS将20E稀释至60 ng/μl和120 ng/μ 2个质量浓度,并分别从虫体腹部侧面注射。注射前用75%酒精擦拭虫体,每头注射lμl,对照注射等量稀釋的DMSO。
1.2.2 总RNA提取及cDNA合成 按照E.Z.N.A Total RNA KitⅡ提取试剂盒说明书提取各样品总RNA。检测合格后,置于-80 μ冰箱中保存备用。按照PrimeScript RT reagent Kit With gDNA E—raser反转录试剂盒说明书进行第一链cDNA合成,合成后稀释20倍,作为实时荧光定量PCR( RT-qPCR)反应的模板,置于-20 ℃冰箱中保存备用。
1.2.3 引物设计及基因的表达以4龄幼虫cDNA为模版,通过普通PCR扩增目的基因及内参基因片段。琼脂糖凝胶电泳检测结果显示,条带大小符合预期且无杂带,并测序确认。RT-qPCR的熔解曲线只有1个信号峰,说明引物特异性高,结果可靠。用实时荧光定量PCR反应(RT-qPCR)检测基因的表达量,所用引物为:5’-GCTGATGGAGTCCGTGCT-GAAC-3’ 和5'-CGAGTAGAAGGCGTTGACGATGG-3',内参基因为卢-actin,阴性对照为无菌超纯水。反应体系为:cDNA模板20.0μl,TB Green Premix ExTaq 10.0μl,上游引物0.4μl,下游引物0.4μl,ddH20 7.2μl。反应程序为:95℃预变性5 min; 95℃解链10 s,60℃延伸20 s,共进行40个循环。每个样品设置3个重复。反应结束后,使用LightCy-cle480荧光定量PCR仪自带的分析软件,选择相对定量分析模式并导出原始数据,使用2-△△Ct相对定量法计算NEP的相对表达量,2-△△Ct即为目的基因的相对表达倍数。采用SPSS 18.0软件进行单因素方差分析与邓肯氏多重比较分析,采用GraphPadPrism 5绘图。
1.2.4 生物信息学分析 在NCBI网站(http://blast。st-va. ncbi. nlm. nih. gov/Blast. cgi)进行基因序列同源比对,用P rotP aram软件分析理化性质,用Signal P 4.1(http: //www. cbs. dtu. dk/services/SignalP -4.11)进行信号肽预测,用NetNGlye软件分析Ⅳ一糖基化修饰( http://www. cbs.dtu),用NetPhos3.1( http://www. cbs. dtu. dk/services/NetPhos/)预钡 iJ磷酸化修饰位点,用TMpred软件(https://embnet.vital-it. ch/cgi-bin/)进行跨膜区分析,用PSORT软件( https://psort. hgc.j p/cgi-bin/runpsort. pl)进行亚细胞定位,用NPS在线工具(https://npsa-prabi.ibcp. fr/cgi-bin/secpred—gor4.pl)预测蛋白质二级结构,用SWISS-MODEL在线工具(https://www.swissmodel. expasy. org/interactive/yrSsgx/models/)进行蛋白质高级结构建模,用ClustalX软件和MEGA5.0软件构建系统发育进化树(NJ法)。
2 结果与分析
2.1 黄野螟中性肽链内切酶基因序列及其编码的蛋白质结构
从黄野螟cDNA文库中筛选出具有完整ORF框的中性肽链内切酶基因,将其命名为HvNEP(登录号:MH298329),序列包含2 310 bp长的ORF框,编码769个氨基酸(图1)。使用ProtParam软件分析HvNEP的理化性质,结果显示该蛋白质的分子量为86 909.14,等电点为6.76,脂肪系数为80.59,不稳定指数为38. 49。总平均疏水性计算结果为-0.335,推测其为亲水性蛋白质。NetPhos3.1软件分析结果显示HvNEP含有9个酪氨酸磷酸化位点,23个苏氨酸磷酸化位点和42个丝氨酸磷酸化位点(得分>0.5)。NetNGlye软件分析结果显示HvNEP有6个糖基化位点。SignalP在线工具预测结果显示,HvNEP无信号肽,推测其为非分泌蛋白质。非分泌蛋白质不存在N-糖基化位点,所以我们推测6个预测的糖基化位点只是潜在的位点。TMpred软件分析结果表明,HvNEP为跨膜蛋白质,具有7个跨膜结构域,其中得分大于2 000的2个重要跨膜区域中,一个是从内向外的,位于37至56位氨基酸,另一个从外向内的重要跨膜区域位于32至56位氨基酸。亚细胞定位预测结果显示,HvNEP位于内质网的可能性最大(为30.4%),其次是位于线粒体(有26.1%的可能性),位于高尔基体和细胞质的可能性则较低(均为17.4%),位于细胞核的可能性最低(4.3%)。
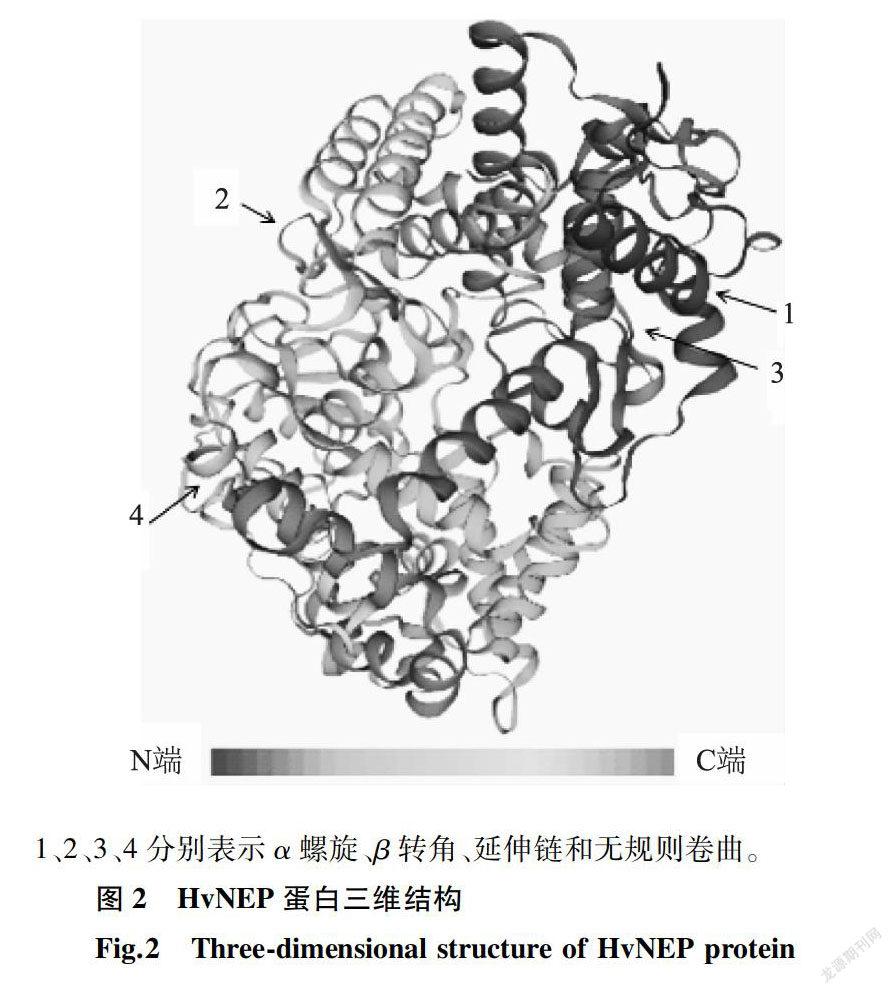
使用Sopma软件进行蛋白质二级结构预测,结果显示构成HvNEP蛋白的主要元件为α螺旋和无规则卷曲,分别占50.20%和37.71%。此外,延伸链和β转角,则各占8.58%与3.51%。使用SWISS-MODEL软件进行蛋白质三级结构建模,结果显示HvNEP基因编码的蛋白质主要由α螺旋与无规则卷曲组成(图2),预测结果与Sopma软件预测的一致。Conserved Domains軟件分析结果显示,HvNEP属于锌谷氨酸蛋白超基因家族中的M13家族,包含锌结合基序HEITH和2个重要催化基序VNAFY和GENIAD[1](图1)。
2.2 HvNEP序列的同源性比对及系统发育树分析
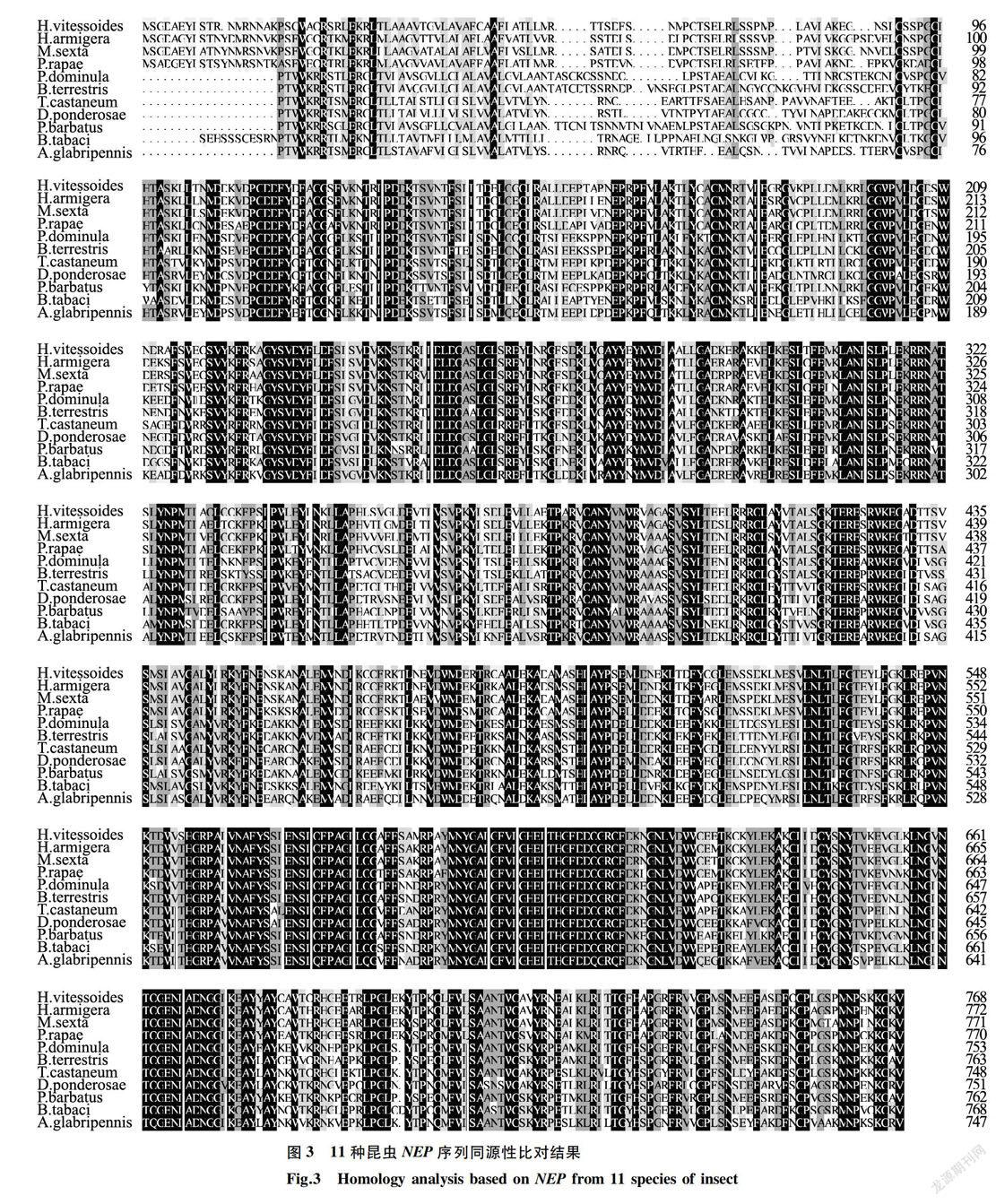
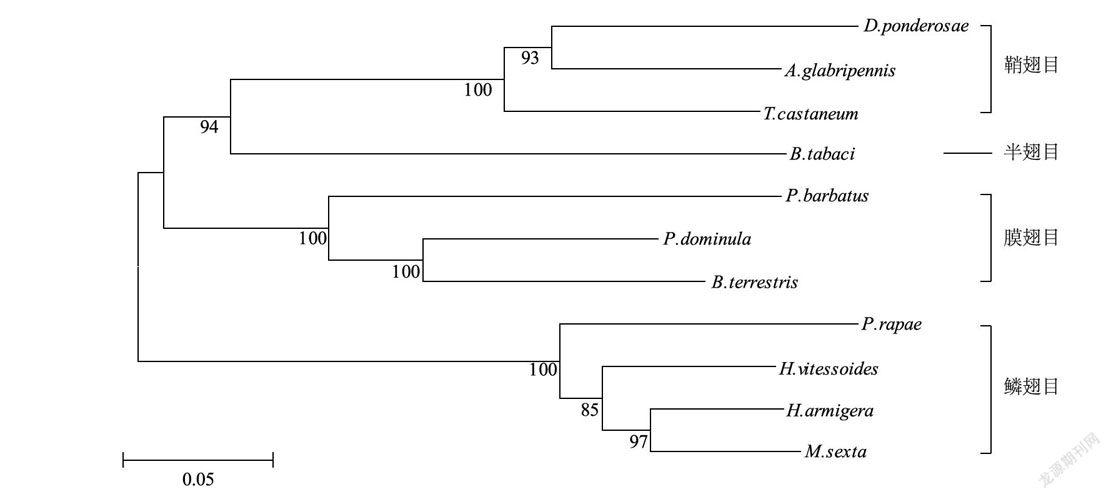
通过Blast与MEGA5.0软件进行同源性比对,结果显示HvNEP序列与棉铃虫NEP的同源性最高(79%),与烟粉虱(Bemisia Tabaci)的同源性最低(67%)(图3)。为研究HvNEP与其他物种昆虫间的亲缘关系,基于其与鳞翅目、膜翅目、鞘翅目、半翅目等4个目中10种昆虫的NEP蛋白氨基酸序列,采用NJ法构建系统发育树。结果表明,黄野螟与烟粉虱同源性最低,与棉铃虫处于同一分支(图4)。
2.3 HvNEP基因在黄野螟不同虫态和不同组织中的表达
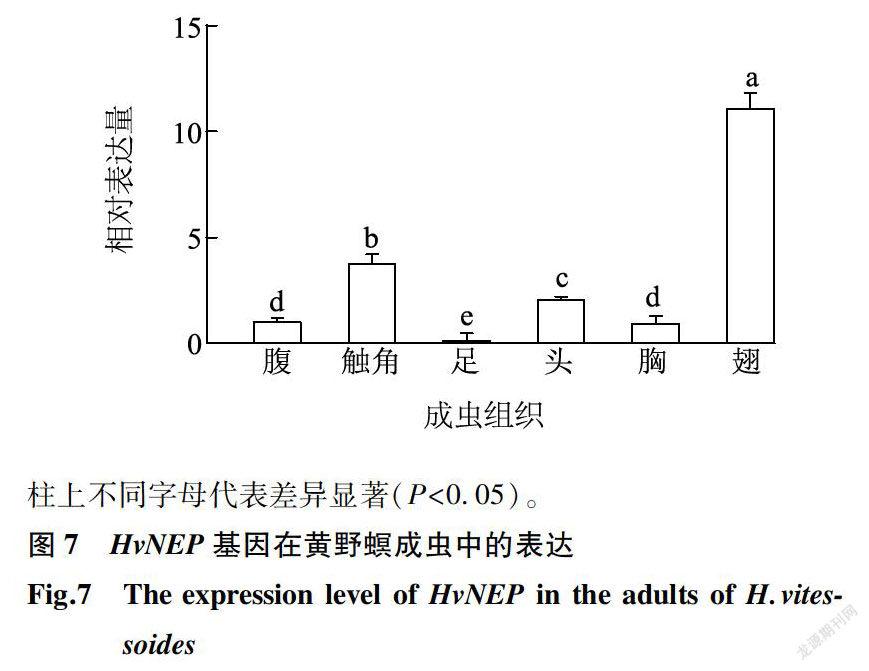
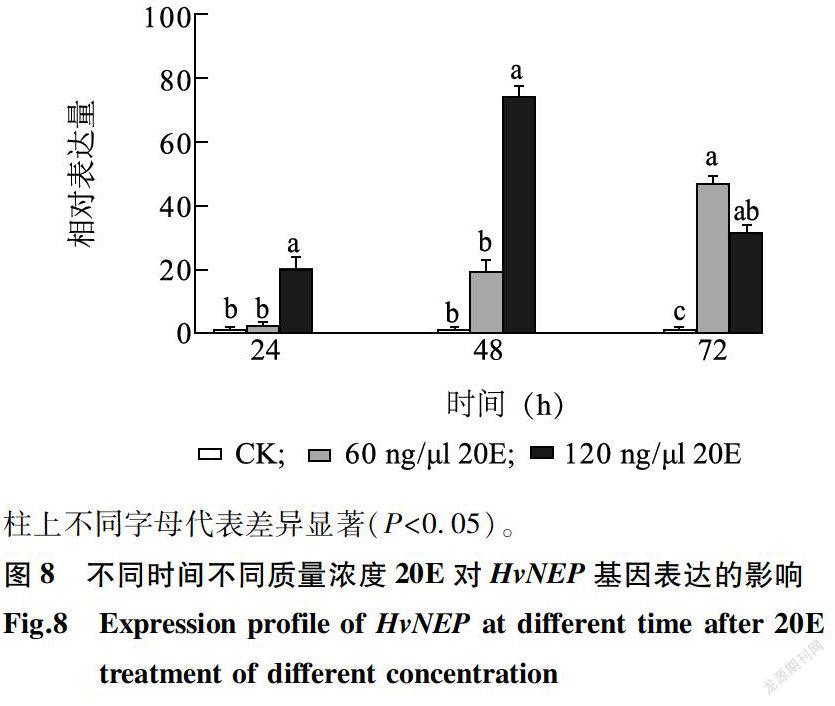
由图5可知,HvNEP在黄野螟各虫态中均有表达,且各虫态间差异显著。在成虫中表达量达到峰值,为卵的113.77倍;在3龄和4龄幼虫时表达量最低,仅为卵的1.31倍和0.60倍。由图6可知,HvNEP在黄野螟幼虫各组织中均有表达,在体壁中表达量最低。在头部表达量最高,为体壁的5.28倍;其次是马氏管中,表达量为体壁的2.89倍。成虫时,HvNEP在翅中表达量最高,为腹的11.06倍,其次是触角与头,表达量分别为腹的3.75倍与2.08倍(图7)。为研究蜕皮激素对HvNEP表达量的影响,以等量稀释的DMSO为对照,探讨不同时间不同20E质量浓度梯度下HvNEP的表达量差异(图8)。在20E注射质量浓度为60 ng/μI时,HvNEP的表达量随时间增加而升高,但在24 h时黄野螟HvNEP基因的表达变化不明显,在48 h和72h时HvNEP基因的表达量显著提高;在注射质量浓度为120 ng/μl时,HvNEP的表达量随时间的增加先升高后降低,在48 h时表达量达到峰值,为对照的74.03倍。说明HvNEP基因的表达水平受蜕皮激素调控,且在注射质量浓度为120 ng/μl后48 h,蜕皮激素对其表达量的影响最显著。
3 讨论
Neprilysin( M13)家族蛋白高度保守部分为HEITH锌结合基序和2个重要的催化基序VNAFY和GENIAD[17]。VNAFY基序存在于各种昆虫的M13肽酶中,影响底物对P1和P1’位置间肽键的取向[18-19],其结构的变化可能会对酶性质产生连锁效应[17];GENIAD已被证明是影响内肽酶活性的关键。此基序若发生显著变异,很可能导致酶活性丧失[20]。
在昆虫生长过程中,NEP基因参与昆虫的变态[9]。RT-qPCR结果表明,HvNEP在黄野螟各发育阶段均有表达,在1龄和2龄幼虫期表达量较高,分别为卵的6.44倍和5.97倍。有研究结果表明,过表达Neprilysin2基因会导致果蝇表现出新的行为表型(异常攀爬行为),说明果蝇运动的改变可能是神经肽信号遭到干扰所致[21]。同属中性肽链内切酶(M13)家族的HvNEP可能也与神经肽信号有关,并在黄野螟1龄和2龄幼虫期发挥重要作用。HvNEP在成虫期的表达量极为突出,为卵的113.77倍。我们推测,黄野螟羽化后存活时间较短,因此其成虫神经系统需要迅速发育,神经肽和肽激素的合成变得旺盛,为生殖行为做好准备,与之相关的HvNEP基因在此阶段应有极高的表达量。
大多无脊椎动物存在类NEP活性物质[22]。RT-qPCR结果表明,HvNEP基因在黄野螟幼虫各组织中均有表达,在头部的表达量最高,为体壁的5.28倍。脑是昆虫的神经中枢,调控昆虫行为和生理活动[23]。推测HvNEP参与调控黄野螟幼虫脑神经发育与神经肽酶水平[24-25]。昆虫马氏管不仅有助于昆虫排泄代谢废物和调节水盐平衡[26],还具有免疫调控功能[27],神经肽在昆虫免疫过程中起一定作用[28]。本研究结果显示HvNEP在马氏管中表达量较高,推测其与马氏管行使免疫功能有关。
分析成虫组织荧光定量结果发现,HvNEP在成虫触角和头均有较高表达,分别为腹的3.75和2.08倍。蛾类昆虫嗅觉中枢发达,触角内含丰富的神经纤维球[29],HvNEP可能参与成虫嗅觉神经系统的完善。HvNEP在成虫翅中表达量最高,为腹的11.06倍。有研究结果表明,在蜕皮激素诱导下,翅原基中会形成类NEP活性物质[16]。翅是昆虫的飞行器官,而神经肽信号系统调控昆虫的行为[28],NEP参与神经肽的加工[4],推测HvNEP在翅中的高表达与昆虫行为有密切关系。
蜕皮激素在动植物体中普遍存在,能够诱导昆虫组织细胞程序化死亡[30],20E是其在昆虫体内的活性形式。当昆虫体内保幼激素滴度较高时,20E引起昆虫脱皮,当保幼激素滴度较低时,20E诱导昆虫进入下一龄期或发生变态[31]。本研究对黄野螟进行了外源20E胁迫,在注射20E后24 h,黄野螟HvNEP的表达水平上升,且注射质量浓度越高影响越明显。当注射质量浓度为60 ng/μl时,HvNEP的表达量随时间增加而上升;当注射质量浓度为120ng/μl时,HvNEP的表达量随时间增加先上升后降低。此结果说明,HvNEP作为蜕皮激素的次级应答基因,其表达受20E调节。另外,注射不同质量浓度的蜕皮激素对HvNEP基因表达量的影响不同,在注射后72 h,120 ng/μl的外源20E对HvNEP表达的诱导效果不如60 ng/μl,推测较高质量浓度的20E胁迫会激发虫体内的负反馈调节机制。
本研究结果为探究昆虫中性肽链内切酶基因提供了分子依据。NEP是昆虫生长发育中不可或缺的一员,具有成为害虫控制剂靶标的潜力。后期我们将基于本研究成果,运用基因编辑和RNA干扰技术,更深入地研究HvNEP的功能。
参考文献:
[1]茅裕婷,张蒙,靳秀芳,等,土沉香对黄野螟的抗性研究[J].华南农业大学学报,2017, 38(6):89-96.
[2] 田耀华,原慧芳,倪书邦,等.沉香属植物研究進展[J].热带亚热带植物学报,2009, 17 (1):98-104.
[3]乔海莉,陆鹏飞,陈君,等,黄野螟生物学特性及发生规律研究[J].应用昆虫学报,2013, 50(5):1244-1252.
[4]SITNIK J L,FRANCIS C,HENS K,et aI.Neprilysins: an evolu-tionarily conserved familv of metajloproteases that play important roles in reproduction in Drosophila[J].Genetics, 2014, 196(3):781-797.
[5]HONC Y,JTURNER A. Old enzyme with new interest: Review ofnewly understood NEP functions and its potential regulators[J].Chinese Journal of Biochemistry&Molecular Biology, 2007, 23(2):85-92.
[6] MA K,AJ K.The purification and specificity of a neutral endo-peptidase from rabbit kidnev brush border[ J]. BiochemicalJournal. 1974, 137(3):477-488.
[7]ZHAO X,MITA K,SHIMADA T,et al.Isolation and expressionof an ecdvsteroid-inducible neutral endopeptidase 24. ll-like genein wing discs of Bombyx mori[J].Insect Biochemistry&MolecularBiology, 2001, 31(12): 1213-1219.
[8]BUTLER M J.Discovery of genes with highly restricted expressionpatterns in the Drosophila wing dise using DNA oligonucleotide mi-croarrays-J].Development, 2003, 130(4):659-670.
[9]WILSON C L,SHIRRAS A D,ISAAC R E.Extracejlular peptida-ses of imaginal discs of Drosophila melanogaster[J].Peptides,2002, 23( 11): 2007-2014.
[10] MULDER S D,VEERHUIS R,BLANKENSTEIN M A,et al- Theeffect of amyloid associated proteins on the expression of genes in-volved in amyloid-,β clearance by adult human astrocytes[J].Ex-perimental Neurology, 2012, 233(1):373-379.
[11] KLEIN C,PA-ITEMENSAH C,TALEB O,et al-The neuroprotector kyrnurenic acid increases neuronal cell survival throu~ neprilysin in-duction[J].Neuropharmacology,2013, 70(1):254-260.
[12] WONG S S,SUN N N,FASTJE C D,et al-Role of neprilysin in airwav inflammation induced bv diesel exhaust emissions[J].Re-search Report, 2011, 120( 159): 3-40.
[13] SMOLLICH M, C.OTrE M, YIP G W. et al. On the role of endothe-Jin-converting enzyme-l( ECE-1) and neprilysin in human breastcancer[J]. Breast Cancer Res Treat, 2007,106(3): 361-369.
[14] SECURA J, RUILOPE L M.Dual-acting angiotensin receptor-ne-prilysin inhibition[J].Current Hypertension Reports, 2011, 13(1):74-78.
[15] WICK M J. BUESING E J. WEHLINC C A, et al. Decreased ne-prilysin and pulmonary vascular remodeling in chronic obstructivepulmonary disease [J] . American Journal of Respiratory & CriticalCare Medicine, 2011 , 183 ( 3) : 330-340.
[16] BARRETT A J, RAWLINCS N D, WOESSNER J F. Handbook ofproteolytic enzymes [M]. London: Elsevier Academic Press,2004: 419-436.
[17] BLAND N D, PINNEY J W, THOMAS J E, et al. Bioinformaticanalysis of the neprilysin ( M13) family of peptidases reveals com-plex evolutionary and functional relationships [J]. BmcEvolutionary Biology , 2008 , 8 ( l) : 1-10.
[18] OEFNER C, D ARCY A, HENNIC. M, et al. Structure of humanneutral endopeptidase ( neprilysin ) complexed withphosphoramidon l[ J] . Journal of Molecular Biology, 2000, 296
[19] LAURENT V, SALZET M. Metabolism of angiotensins by headmembranes of the leech Theromyzon tessulatum[J] . Febs Letters ,1996. 384( 2) : 123-127.
[20] KENNY A J, BOUSTEAD C M. Cell-surface peptidases in healthand disease [M] . Oxfordshire : BIOS Scientific Publishers Ltd,1997: 59-78.
[21] BLAND N D, ROBINSON P. THOMAS J E, et al. Locomotor andgeotactic behavior of Drosophila melanogaster over-expressing ne- prilysin 2[J] . Peptides . 2009, 30( 3) : 571-574.
[22] KASHI Y. Simple sequence repeats as advantageous mutators in e-volution [J] . Trends in Genetics Tig, 2006, 22( 5) : 253-259.
[23]CHAPMAN R F. The insects : structure and function [M] . NewYork : American Elsevier Publishing Co , 1969 : 1317.
[24] CARPENTIER M. CUILLEME'17E C, BAILEY J L, et al. Re-duced fertility in male mice deficient in the zinc metaLlopeptidaseNLl [J] . Molecular & Cejlular Biology , 2004 , 24 ( 10) : 4428.
[25] ISAAC R E. Neuropeptide-degrading endopeptidase activity oflocust ( Schistocerca gregaria ) synaptic membranes [ J ].Biochemical Journal, 1988 , 255 ( 3 ) : 843-847.
[26] DOW J A T. Insights into the Malpighian n.tbule from functionalgenomics[ J ] . Journal of Experimental Biology , 2009 , 212 ( 3 ) :435-445.
[27]趙新慧.家蚕马氏管响应BmNPV感染相关miRNAr初步研究 [D] .镇江 : 江苏科技大学 , 2013.
[28]桂顺华.桔小实蝇 Tachykinin和 Natalisin信号系统的生理功能
[29] ZHAO X C, CHEN Q Y, GUO P, et al. Glomerular identificationin the antennal lobe of the male moth Helicoverpa armigera [ J] .Journal of Comparative Neurology , 2016 , 524(15) : 2993-3013.
[30 ]姚大彬 .外源 20-羟基蜕皮激素对洋虫的影响及其 EcR和 HR3基因的表达分析 [D] .哈尔滨 :东北学 . 2013.
[31] RIDDIFORD L M, HIRUMA K, ZHOU X. et al. Insights into themolecular basis of the hormonal control of molting and metamor-phosis from Manduca sexta and Drosophila melanogaster [J] . Insect Biochemistry & Molecular Biology, 2003. 33( 12) : 1327-1338.

