蔗渣原料中阿魏酸和对香豆酸的定量分析
李明富 万广聪 贾转 郭晨艳 运晓静 覃程荣 王双飞 闵斗勇


摘 要:利用碱水解法处理蔗渣原料,分别采用气相色谱(GC)和气相色谱-质谱联用仪(GC-MS)定量分析碱水解液中的阿魏酸和对香豆酸得率,以确定分析检测方法的优异性。同时,采用先碱水解再酸水解法提取蔗渣中的阿魏酸和对香豆酸,探究萃取溶剂和水解温度对阿魏酸和对香豆酸提取率的影响。结果表明,采用GC-MS定量分析碱水解液中阿魏酸和对香豆酸的效果优于GC。与蔗渣的碱水解法相比,先碱水解再酸水解的方法具有更高的分离效率,阿魏酸和对香豆酸得率分别从0.06%和2.00%提高到0.33%和4.04%。与三氯甲烷相比,乙酸乙酯作为萃取溶剂时,阿魏酸得率提高了23.53%,对香豆酸得率提高了6.1倍。蔗渣中阿魏酸酯和对香豆酸酯的水解效率随着水解温度的升高而提高,当温度从25℃升高到60℃,阿魏酸和对香豆酸的得率分别提高5.88%和1.78%。分析结果还表明,蔗渣原料中酯键和醚键分别占对香豆酸总键连的97.27%和2.73%,酯键和醚键分别占阿魏酸总键连的51.51%和48.49%。由此表明,蔗渣原料中对香豆酸主要以酯键与木素/碳水化合物连接,阿魏酸则以酯键和醚键与木素/碳水化合物连接。
关键词:蔗渣;阿魏酸;对香豆酸;水解萃取;GC-MS
中图分类号:TS721
文献标识码:A
DOI:10.11981/j.issn.1000-6842.2019.02.01
阿魏酸(4-羟基-3-甲氧基肉桂酸,Ferulic acid,FA)和对香豆酸(对羟基肉桂酸, p-Coumaric acid,p-CA)是植物细胞壁中主要的羟基肉桂酸[1]。在非木材原料细胞壁形成过程中,羟基肉桂酸在与木素单体发生反应的同时,也与聚糖发生酯化反应形成阿魏酸酯和对香豆酸酯等结构[2]。因此,在细胞壁木质化过程中,羟基肉桂酸通过酯键和醚键与木素和多糖连接,形成木素-羟基肉桂酸酯-多糖复合结构[3]。这些交联结构对植物细胞壁的生长起着重要作用,可以调节细胞壁的机械性能和生物降解性能[4-5]。阿魏酸通过醚键和酯键与木素/碳水化合物连接,对香豆酸则主要通过酯键方式与木素/碳水化合物连接,在细胞壁形成初期,少量对香豆酸与阿拉伯糖基聚木糖发生酯化反应,大量对香豆酸则与木素发生酯化反应[5-6]。
阿魏酸和对香豆酸广泛存在于农林废弃物玉米芯、蔗渣、秸秆等木质纤维生物质细胞壁中。阿魏酸和对香豆酸具有抗氧化、清除自由基的作用[7],可以用于食品添加剂和食品保鲜剂,也可用于医药防治疾病和化妆品添加剂以抑制黑色素的形成,抵抗紫外线辐射[8-11]。利用化学方法合成阿魏酸、对香豆酸存在反应时间长、溶剂用量大、转化率低、成本高等缺点,限制了阿魏酸和对香豆酸的广泛应用。因此,利用农林生物质作原料分离阿魏酸和对香豆酸,不仅能大量获取阿魏酸和对香豆酸,还能促进其在食品、医药等相关领域的应用。
目前,主要采用碱水解法[12-13]或先碱水解再酸水解法从植物原料中分离对香豆酸和阿魏酸[5,14]。由于酯键和醚键的化学稳定性不同,它们对酸碱的稳定性亦不同。碱水解主要破坏阿魏酸和对香豆酸与木素/碳水化合物间的酯鍵来分离阿魏酸和对香豆酸,同时伴随着木素和半纤维素溶出。酸水解则主要通过破坏阿魏酸和对香豆酸与木素/碳水化合物间的醚键来分离阿魏酸和对香豆酸[5, 14]。目前,主要采用光谱法或色谱法定量分析羟基肉桂酸类化合物,其中光谱法可以直接进行测定,色谱法则需要先分离羟基肉桂酸化合物再进行测定。Torre等[15]采用稀碱水解玉米穗后,利用高效液相色谱法(HPLC)检测出水解液中阿魏酸和对香豆酸的浓度分别为1171 mg/L和2156 mg/L。HPLC样品制备简单,无需特殊处理,但分离能力较弱,难以分离并检测碱水解过程中产生的羟基肉桂酸二聚体[16-18]。Lao等[19]发现,利用气相色谱-质谱联用仪(GC-MS)能快速地定量分析当归萃取液中的阿魏酸、川芎内酯和其他四氯苯酞等13个组分的含量。
本研究采用碱水解法处理蔗渣原料,对比分析气相色谱(GC)和GC-MS定量分析一步碱水解液中的阿魏酸和对香豆酸的差异性。其次,采用先碱水解再酸水解法处理蔗渣,探究萃取溶剂和水解温度对阿魏酸和对香豆酸得率的影响,最后分别计算阿魏酸和对香豆酸与木素/碳水化合物连接的醚键及酯键比例,建立蔗渣原料中阿魏酸和对香豆酸的高效分离和检测方法。
1 实 验
1.1 原料与试剂
蔗渣,由广西某造纸厂提供。蔗渣粉碎后收集40~60目组分作原料。原料经苯-醇(体积比为2∶1)抽提8 h以除去有机抽提物。抽提原料先风干再真空干燥24 h后,利用行星球磨仪球磨24 h,球磨样品用作实验起始原料。
化学试剂:NaOH、HCl、无水MgSO4、苯、乙醇、乙酸乙酯、吡啶、三氯甲烷、二氧六环,均为分析纯。阿魏酸、对香豆酸、2-羟基肉桂酸标准样品为色谱纯。
1.2 实验方法
1.2.1 蔗渣一步碱水解法
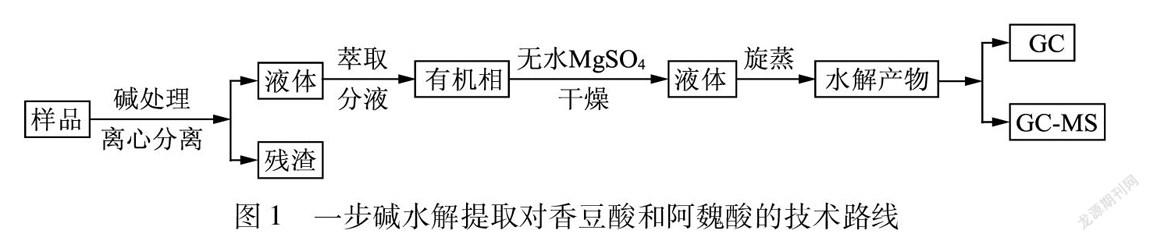
称取1 g球磨蔗渣样品置于250 mL锥形瓶中,加入50 mL 1 mol/L的NaOH,常温下避光搅拌24 h后,离心分离得到水解液和残渣。用蒸馏水洗涤残渣3次,洗涤液与水解液混合、待测。残渣先冷冻干燥48 h,再真空干燥24 h,计算碱抽提残渣得率。用2 mol/L的HCl调节混合液pH值为2后[5],利用乙酸乙酯萃取3次,离心分离收集有机相,加入无水MgSO4干燥,过滤、减压旋蒸,得到固体水解产物。固体水解产物先冷冻干燥48 h,再真空干燥24 h后,加入内标物2-羟基肉桂酸,溶解在200 μL吡啶中,经0.45 μm有机滤膜过滤,转移100 μL溶液至1.5 mL气相色谱样品瓶中,加入100 μL NO-双(三甲基硅烷)三氟乙酰胺硅烷化试剂(TMCS),水浴70℃反应1 h后,分别采用GC和GC-MS测定。本实验中对照样采用如下方法,将对香豆酸、阿魏酸的标准样品和内标物2-羟基肉桂酸溶解于1 mol/L NaOH中反应24 h后,调节pH值为2,经乙酸乙酯萃取,旋蒸干燥后,溶解于吡啶中进行衍生化后,分别采用GC和GC-MS测定。一步碱水解提取对香豆酸和阿魏酸的流程图见图1。
1.2.2 蔗渣先碱水解再酸水解
两步水解提取蔗渣中的对香豆酸和阿魏酸技术路线图见图2。
1.2.2.1 原料碱水解
取5 g球磨蔗渣原料置于500 mL锥形瓶中,加入250 mL 1 mol/L的NaOH,在常温或60℃下避光搅拌反应24 h。反应结束后,离心分离得到水解液和残渣。用蒸馏水洗涤残渣3次,收集洗涤液与水解液混合,用于提取阿魏酸和对香豆酸。残渣先冷冻干燥,再真空干燥48 h后,存放于干燥器中备用,部分残渣用作酸水解原料。用2 mol/L的HCl调节洗涤液与水解液的混合液pH值为6,加入等体积95%乙醇以沉淀除去半纤维素后,旋转蒸发除去乙醇,再次调节溶液pH值为2,沉淀出木素,悬浮液离心分离得到水解液和木素,木素真空干燥,备用[5]。分别利用乙酸乙酯和三氯甲烷萃取水解液3次,分液收集有机相,旋转蒸发除去有机溶剂,得到碱水解产物。碱水解产物先冷冻干燥48 h,再真空干燥24 h后,加入内标物2-羟基肉桂酸,溶解在200 μL吡啶中,经0.45 μm有机滤膜过滤,转移100 μL溶液至1.5 mL棕色色谱瓶中,加入100 μL TMCS,在70℃条件下反应1 h 后,采用GC-MS测定。
1.2.2.2碱水解残渣的酸水解
取1 g碱水解残渣,与100 mL二氧六环/HCl混合液(体积比9∶1,HCl浓度2 mol/L)混合后[5],在80℃油浴中回流反应3 h,冷却后,离心分离得到离心液和沉淀。用二氧六环/水(体积比1∶1)洗涤沉淀3次,将洗涤液与离心液混合,旋转蒸发除去二氧六环,調节pH值为6,离心分离得到沉淀和水解液。用等体积乙酸乙酯萃取水解液3次,分液收集有机相,旋转蒸发除去乙酸乙酯,得到酸水解产物。酸水解产物冷冻干燥48 h再真空干燥24 h后,加入内标物2-羟基肉桂酸,溶解在200 μL吡啶中,经0.45 μm有机滤膜过滤,转移100 μL溶液至1.5 mL棕色色谱瓶中,加入100 μL TMCS,在70℃条件下反应1 h后,采用GC-MS测定。
1.3 分析方法
1.3.1 原料化学组分分析
蔗渣原料中的碳水化合物、木素等化学组分和灰分均采用美国可再生能源实验室(NREL)的方法测定[20-21]。取0.3 g原料放入10 mL坩埚中,加入1.5 mL质量分数72%的H2SO4润胀2 h后,加入56 mL蒸馏水将H2SO4浓度稀释至3%,再在121℃条件下反应4 h,过滤得到固体和滤液,固体为酸不溶木素(Klason木素)。利用紫外可见分光光度计(SPECORD 50 PLUS,Analytik Jena,德国)在205 nm处分析滤液中酸溶木素含量。利用离子色谱(HPIC,Thermo Dionex5000+ DC,美国)分析滤液中碳水化合物含量。称取2 g样品置于马弗炉中,在575℃下灼烧6 h,残留物即为原料灰分。
1.3.2 GC分析测试
利用GC(Agilent 7890B GC,Agilent,美国)定量分析水解液中阿魏酸和对香豆酸。色谱柱为HP-5MS UI(30 mm×0.25 mm×0.25 μm),载气为高纯氦气,检测器为FIRD。测试条件如下:柱箱起始温度200℃,保持1 min,以2℃/min速率升温至250℃后,保持4 min,进样温度250℃,分流比1∶50,尾气吹扫4 min,进样体积1 μL。
1.3.3 GC-MS分析测试
利用GC(Agilent 7890B GC,Agilent,美国)和MS(5977A MSD,Agilent,美国)定量分析水解液中阿魏酸和对香豆酸,色谱柱为HP-5MS UI(30 mm×0.25 mm×0.25 μm),载气为高纯氦气,检测器为MS。GC测试条件同1.3.2。MS测试条件:离子源温度230℃,四级杆温度150℃,传输线温度280℃,扫描范围35~350。
2 结果与讨论
2.1 蔗渣原料主要化学组分分析
经检测,蔗渣原料主要化学组分含量为:纤维素49.50%,半纤维素19.00%,木素20.51%,灰分1.20%,其他9.79%。结果表明,蔗渣的木素含量低于马尾松(27.96%)和桉木的木素含量(30.43%),蔗渣综纤维素含量(68.50%)高于马尾松(64.38%)和桉木的综纤维素含量(64.03%)[22]。蔗渣原料中还含有其他组分(9.79%),如果胶、蛋白质、脂肪酸等抽出物。
2.2 一步碱水解法提取阿魏酸和对香豆酸
禾草类植物原料细胞壁中的羟基肉桂酸包括对香豆酸、阿魏酸、香草醛。两种羟基肉桂酸通过酯键/醚键与木素/碳水化合物连接形成复合物,如图3所示[23-24]。
在室温条件下,1 g蔗渣经1 mol/L NaOH水解24 h后,残渣得率为29.90%。分别利用GC和GC-MS定量分析碱水解后的阿魏酸和对香豆酸,分析结果见表1。从表1可知,碱水解液中含有对香豆酸及少量的阿魏酸。GC分析结果显示,一步碱水解法提取的阿魏酸和对香豆酸得率分别为0.06%和2.00%;GC-MS结果显示,一步碱水解法提取的阿魏酸和对香豆酸得率分别为0.07%和2.10%。由于碱能破坏酯键,因此推断酯键是对香豆酸与木素/碳水化合物连接的主要方式,而不是阿魏酸与木素/碳水化合物连接的主要方式。相对于GC检测结果,GC-MS测定的阿魏酸和对香豆酸含量分别提高了5.0%和16.7%,表明GC-MS具有更高的测量精度。而且GC-MS分析结果还显示,碱水解液中的阿魏酸和对香豆酸分别存在顺式和反式两个同分异构体,如图4所示。
图5是蔗渣碱水解产物中羟基肉桂酸的总离子流色谱图。根据GC-MS谱库匹配识别可知:图5中保留时间为3.4 min(d)和4.7 min(c)的峰分别为顺式对香豆酸和对香豆酸;保留时间为4.5 min(b)和6.3 min(a)的峰分别是顺式和反式阿魏酸;保留时间为3.6 min的峰是内标物2-羟基肉桂酸(e)。Newby等[25]采用不同溶剂与羧酸混合抽提紫花苜蓿芽中的羟基肉桂酸,也发现阿魏酸和对香豆酸存在顺式和反式同分异构体。虽然反式对香豆酸和阿魏酸稳定性较高,但是光催化作用能将少量反式对香豆酸和反式阿魏酸转化为顺式对香豆酸和顺式阿魏酸。
阿魏酸、对香豆酸和2-羟基肉桂酸标样的质谱图如图6所示。由图5和图6可知,2-羟基肉桂酸与阿魏酸、对香豆酸的质谱图不同,总离子流色谱图中出峰位置也不同,表明2-羟基肉桂酸可以作为内标物分析样品中的阿魏酸和对香豆酸。GC-MS的定量分析结果如表2所示。表2结果表明,阿魏酸、对香豆酸和2-羟基肉桂酸标准样品的萃取得率分别为99.00%、97.50%和99.00%,误差小于3%,GC-MS可用于样品中阿魏酸和对香豆酸的定量分析。
2.3 先碱水解再酸水解的兩步法分析
2.3.1 碱水解萃取溶剂和水解温度对阿魏酸和对香豆酸得率的影响
蔗渣样品中阿魏酸和对香豆酸的含量不同,两者与木素/碳水化合物连接的酯键和醚键在酸碱溶液中的稳定性也不同。因此,可利用先碱水解再酸水解两步法分离出蔗渣中的阿魏酸和对香豆酸,并计算其中酯键和醚键的比例。
碱水解能破坏羟基肉桂酸与木素间的酯键连接,因此,能分离出酯键连接的阿魏酸和对香豆酸,还能溶出部分木素和半纤维素。碱水解完成后过滤水解液,用HCl调节水解液pH值为6,将水解液加入到95%乙醇溶液中沉淀出半纤维素,再调节水解液pH值为2沉淀出碱溶木素。结果如表3所示,其中半纤维素得率约13.60%,占原料半纤维素的71.57%;木素得率约9.40%,占原料木素的45.85%。通过醇沉除去溶液中的半纤维素和酸沉除去溶液中的木素,有利于减少半纤维素和木素对阿魏酸和对香豆酸的干扰,提高阿魏酸和对香豆酸的提取得率和纯度。此外,碱水解后,半纤维素溶出得率高于木素,可能是由于碱水解有效破坏细胞壁,使木素和碳水化合物的连接键发生断裂导致。
2.3.1.1 萃取溶剂对阿魏酸和对香豆酸提取的影响
分别采用乙酸乙酯和三氯甲烷为溶剂萃取蔗渣碱水解液中的阿魏酸和对香豆酸,分别加入内标物2-羟基肉桂酸后,再利用GC-MS进行定量分析,分析结果见表4。由表4可知,乙酸乙酯作为萃取溶剂时,碱水解后阿魏酸和对香豆酸得率分别为0.17%和3.93%;三氯甲烷作为萃取溶剂,阿魏酸和对香豆酸得率分别为0.13%和0.64%。乙酸乙酯萃取阿魏酸得率比三氯甲烷的高23.53%,乙酸乙酯萃取对香豆酸得率比三氯甲烷的高6.1倍。实验结果表明,阿魏酸和对香豆酸在乙酸乙酯中的溶解性均高于三氯甲烷,主要原因是阿魏酸和对香豆酸是极性物质,而乙酸乙酯极性高于三氯甲烷,因此乙酸乙酯的萃取效率更高。此外,乙酸乙酯不能萃取溶液中的淀粉和糖类物质,这也有利于提高对香豆酸和阿魏酸的萃取效率。Choi等[26]研究也发现,阿魏酸在乙酸乙酯中的溶解性明显高于三氯甲烷和乙醚等溶剂。
2.3.1.2 碱水解温度对阿魏酸和对香豆酸提取的影响
水解温度是影响蔗渣碱水解提取阿魏酸和对香豆酸的主要因素之一,实验研究了水解温度25℃和60℃下对阿魏酸和对香豆酸提取的影响。如表4所示,当水解温度为25℃时,阿魏酸和对香豆酸的得率分别为0.17%和3.93%;当温度提高到60℃时,阿魏酸和对香豆酸得率分别增加到0.18%和4.00%,分别提高了5.88%和1.78%。根据热力学基本原理,提高反应温度有利于化学键的断裂。Xu等[14]的研究结果也显示,当水解温度从20℃提高到40℃,蔗渣中木素溶出率从9.9%增加到13.4%,半纤维素溶出率从18.6%增加到20.8%,对香豆酸得率从0.60%提高到0.70%。Mussatto等[27]优化谷物中阿魏酸和对香豆酸提取工艺的结果同样表明,当反应温度从80℃提高到120℃,水解液中阿魏酸和对香豆酸的浓度分别增加了26.08 mg/L和22.68 mg/L。综上所述,水解温度的提高,不仅有利于半纤维素和木素的溶出,而且有利于阿魏酸和对香豆酸分离效率的提高。
2.3.2 酸水解对阿魏酸及对香豆酸提取的影响
由于酸水解能够破坏醚键,因此对蔗渣原料进行酸水解能释放出以醚键连接的阿魏酸或对香豆酸。利用二氧六环/HCl对碱水解残渣进行酸水解,再利用乙酸乙酯进行萃取,加入内标物2-羟基肉桂酸,最后利用GC-MS进行定量分析,结果如图7和表5所示。表5结果可知,酸水解后阿魏酸和对香豆酸的得率分别为0.16%和0.11%。结果表明,通过醚键与木素/碳水化合物键连的阿魏酸多于对香豆酸。
对蔗渣先碱水解再酸水解能先后破坏细胞壁中的酯键和醚键,因此能更有效地从蔗渣中分离出阿魏酸和对香豆酸。比较表4、表5可知,碱水解从蔗渣原料中分离出更多阿魏酸和对香豆酸,且对香豆酸的得率高于阿魏酸;而酸水解从残渣中分离的阿魏酸和对香豆酸较少,且阿魏酸和对香豆酸得率相近。根据表4和表5中计算阿魏酸和对香豆酸的总得率分别为0.33%和4.04%。此外,分别计算阿魏酸和对香豆酸各自比例表明,对香豆酸在蔗渣原料中主要以对香豆酸酯存在,酯键约占总键连的97.27%,此外还存在少量醚键,约占总键连的2.73%。Newby等[25]的研究结果也表明,碱处理可以释放大部分酯键连接的羟基肉桂酸和少部分酰胺键连接的羟基肉桂酸。这也表明,碱水解主要破坏酯键连接。与对香豆酸不同,阿魏酸不但通过酯键与碳水化合物连接,而且通过醚键与木素连接,酯化阿魏酸和醚化阿魏酸分别约占51.51%和48.49%。Lam等[28]研究通过均相催化剂和三乙基硼氢化锂进行氢化研究稻草节间细胞壁中羟基肉桂酸的结合方式,结果也表明,分离的阿魏酸中醚化阿魏酸较少,约占40%。Xu等[14]的研究结果也表明,蔗渣中44.0%~55.0%的阿魏酸通过酯键与半纤维素连接,另一部分则通过酚羟基与木素发生醚化。Huang等[29]分别进行竹青、竹黄中阿魏酸和对香豆酸的分离研究;实验结果表明,竹青、竹黄细胞壁中醚键连接的阿魏酸含量高于对香豆酸。由此表明,蔗渣原料中酯化阿魏酸和对香豆酸的比例大于醚化阿魏酸和对香豆酸,且酯键连接的对香豆酸高于阿魏酸,醚键连接的阿魏酸高于对香豆酸。
3 结 论
本课题主要对比分析采用碱水解和先碱水解再酸水解对提取蔗渣原料中阿魏酸和对香豆酸得率的影响,通过改变水解条件和检测方法能有效提高阿魏酸和对香豆酸得率和检测准确性,主要结论如下。
3.1 比较碱水解一步法和先碱水解再酸水解两步法分离蔗渣原料中阿魏酸酯和对香豆酸酯的得率,结果表明,先碱水解再酸水解两步法具有更高的分离效率,阿魏酸和对香豆酸的得率(对蔗渣原料)分别为0.33%和4.04%;而碱水解一步法分离阿魏酸和对香豆酸的得率分别为0.06%和2.00%。
3.2 采用GC-MS檢测水解液中的阿魏酸和对香豆酸不但具有良好的检测精度,还能鉴别出二者的同分异构体。与三氯甲烷作为萃取溶剂相比,乙酸乙酯对蔗渣中阿魏酸和对香豆酸具有更高的萃取效率。此外,提高水解温度有利于提高阿魏酸酯和对香豆酸酯的水解效率。
3.3 蔗渣原料中的对香豆酸主要以酯键方式与木素/碳水化合物连接,约占总键连的97.27%,醚键则占2.73%;阿魏酸分别以酯键和醚键方式与木素/碳水化合物连接,其中酯键约占总键连的51.51%,醚键约占48.49%。
参 考 文 献
[1]Tai D S, Pan X Q, Ji W L, et al. Chemical properties of grass lignin[J]. China Pulp & Paper, 1989, 8(1): 11.
邰瓞生, 潘小琪, 纪文兰, 等. 禾草木素的化学特性[J]. 中国造纸, 1989, 8(1): 11.
[2]Lin L, Chen C, Gratzl J S. Advance in the study of structure of wheat straw lignin[J]. Transactions of China Pulp and Paper, 2001, 16(1): 121.
林 鹿, Chen C, Gratzl J S. 麦草木素结构的研究进展[J]. 中国造纸学报, 2001, 16(1): 121.
[3]Ralph J, Grabber J H, Hatfield R D. Lignin-ferulate cross-links in grasses: Active incorporation of ferulate polysaccharide esters into ryegrass lignins[J]. Carbohydrate Research, 1995, 275: 167.
[4]Larsen E, Andreasen M F, Christensen L P. Regioselective Dimerization of Ferulic Acid in a Micellar Solution[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 3471.
[5]Pan G X, Bolton J L, Leary G J. Determination of ferulic and p-coumaric acids in wheat straw and the amounts released by mild acid and alkaline peroxide treatment[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 5283.
[6]Ralph J, Hatfield R D, Quideau S, et al. Pathway of p-Coumaric Acid Incorporation into Maize Lignin As Revealed by NMR[J]. Journal of the American Chemical Society, 1994, 116: 9448.
[7]Prasad N R, Ramachandran S, Pugalendi K V, et al. Ferulic acid inhibits UV-B-induced oxidative stress in human lymphocytes[J]. Nutrition Research, 2007, 27: 559.
[8]Kanski Aksenova M, Stoyanova A, Butterfield D A. Ferulic acid antioxidant protection against hydroxyl and peroxyl radical oxidation in synaptosomal and neuronal cell culture systems in vitro: structure-activity studies[J]. Journal of Nutritional Biochemistry, 2002, 13: 273.
[9]Liyana-Pathirana C M, Shahidi F. Importance of insoluble-bound phenolics to antioxidant properties of wheat[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 1256.
[10]Srinivasan M, Sudheer A R, Pillai K R, et al. Influence of ferulic acid on gamma-radiation induced DNA damage, lipid peroxidation and antioxidant status in primary culture of isolated rat hepatocytes[J]. Toxicology, 2006, 228: 249.
[11]Hu Z R, Liu Y H, Yuan R S, et al. Progress in preparation and application of p-coumaric acid[J]. Food Science, 2009, 30(21): 438.
胡铮瑢, 刘玉环, 阮榕生, 等. 对香豆酸碱法制备及应用研究进展[J]. 食品科学, 2009, 30(21): 438.
[12]Buranov A U, Mazza G. Extraction and purification of ferulic acid from flax shives, wheat and corn bran by alkaline hydrolysis and pressurised solvents[J]. Food Chemistry, 2009, 115: 1542.
[13]Torre P, Aliakbarian B, Rivas B, et al. Release of ferulic acid from corn cobs by alkaline hydrolysis[J]. Biochemical Engineering Journal, 2008, 40: 500.
[14]Xu F, Sun R, Sun J, et al. Determination of cell wall ferulic and p-coumaric acids in sugarcane bagasse[J]. Analytica Chimica Acta, 2005, 552: 207.
[15]Torre P, Aliakbarian B, Rivas B, et al. Release of ferulic acid from corn cobs by alkaline hydrolysis[J]. Biochemical Engineering Journal, 2008, 40(3): 500.
[16]Bunzel M, Ralph J, Marita J, et al. Identification of 4-O-5′Coupled Diferulic Acid from Insoluble Cereal Fiber[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 3166.
[17]Kalili KM, de Villiers A. Recent developments in the HPLC separation of phenolic compounds[J]. Journal of Separation Science, 2011, 34: 854.
[18]Zhang A P. Isolation and characterization of lignin in cell walls of plants: study on the cross-linking structure of lignin and ferulic acid ester in cell walls of gramineous plants[D]. Guangzhou: South China University of Technology, 2010.
張爱萍. 植物细胞壁中木素的分离与表征: 禾本科植物细胞壁壁中木素与阿魏酸酯交联结构的研究[D]. 广州: 华南理工大学, 2010.
[19]Lao S C, Li S P, Kan K, et al. Identification and quantification of 13 components in Angelica sinensis (Danggui) by gas chromatography-mass spectrometry coupled with pressurized liquid extraction[J]. Analytica Chimica Acta, 2004, 526(2): 131.
[20]Sluiter A, Hames B, Ruiz R, et al. Determination of Ash inBiomass[S]. Laboratory Analytical Procedure (LAP), 2005.
[21]Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass national renewable[S]. Laboratory Analytical Procedure (LAP), 2012.
[22]Lan W. Dissolution of wood fibers in ionic liquid and separation of component[D]. Guangzhou: South China University of Technology, 2012.
蓝 武. 木质纤维在离子液体中的溶解以及组分分离[D]. 广州: 华南理工大学, 2012.
[23]Buranov A U, Mazza G. Lignin in straw of herbaceous crops[J].Industrial Crops and Products, 2008, 28(3): 237.
[24]Buranov A U, Mazza G. Extraction and purification of ferulic acid from flax shives, wheat and corn bran by alkaline hydrolysis and pressurised solvents[J].Food Chemistry, 2009, 115(4): 1542.
[25]Newby V K, Sablon R M, Synge Rim, et al. Free and bound phenolic acid of Lucerne (MEDICAGO SATWA CV EUROPE)[J]. Phytochemistry, 1980, 19: 651.
[26]Choi M, Park J, Min J Y, et al. Efficient release of ferulic acid from sweet patato (Ipomoea batatas) stems by chemical hydrolysis[J]. Biotechnology and Bioprocess Engineering, 2008, 13: 319.
[27]Mussatto S I, Dragone G, Roberto I C. Ferulic and p-coumaric acids extraction by alkaline hydrolysis of brewers spent grain[J]. Industrial Crops and Products, 2007, 25: 231.
[28]Lam Thi Bach Tuyet, Iiyama Kenji, Stone Bruce A. An approach to the estimation of ferulic acid bridges inunfractionated cell walls of wheat internodes[J]. Phytochemistry, 1994, 2: 327.
[29]Huang C X, He J, Min D Y, et al. Quantitative Determination of Ferulic andp-Coumaric Acids in Cell Wall of Moso Bamboo Green and Bamboo Yellow[J]. Chemistry and Industry of Forest Products, 2016, 36(3): 16.
Determination of Ferulic Acid and p-Coumaric Acid in Sugarcane Bagasse
LI Mingfu WAN Guangcong JIA Zhuan GUO Chenyan1,2
YUN Xiaojing QIN Chengrong WANG Shuangfei MIN Douyong1,2,*
(1. College of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi Zhuang Autonomous Region, 530004;
2. Guangxi Key Laboratory of Clean Pulp & Papermaking and Pollution Control, Nanning, Guangxi Zhuang Autonomous Region, 530004)
(*E-mail: mindouyong@gxu.edu.cn)
Abstract:Sugarcane bagasse was treated with alkaline hydrolysis, and ferulic acid and p-coumaric acid in one-step alkaline hydrolysate were quantitatively analyzed by gas chromatography (GC) and gas chromatography-mass spectrometry (GC-MS). Mean while, ferulic acid and p-coumaric acid from sugarcane bagasse were extracted by alkaline hydrolysis followed by acid hydrolysis, and the effects of extraction solvent and hydrolysis temperature on the extraction rate of ferulic acid and p-coumaric acid were investigated. The results showed that compared with alkali extraction, combination of alkali extraction and acid extraction hydrolyzed more p-coumarate and ferulate acids. The yields of p-coumaric acid and ferulic acid were increased from 0.06% and 2.00% to 0.33% and 4.04%,respectively. The yields were also improved with the temperature increasing. When temperature increased from 25℃ to 60℃, yields of ferulic acid and p-coumaric acid were increased by 5.88%and 1.78%,respectively. Compared with using chloroform as extraction solvent, ethyl acetate could increase yields of ferulic acid and p-coumaric acid by 23.53% and 6.1 times, respectively. As a result, it was demonstrated that ester bond was the main linkage between p-coumaric acid to lignin and carbohydrate which accounted for 97.27% of total linkages in sugarcane bagasse. While, both of ester bond and ether bond were the linkages of ferulic acid to lignin or carbohydrate which respectively account for 51.51% and 48.49% of total linkages.
Keywords:sugarcane bagasse; ferulic acid; p-coumaric acid; extraction; GC-MS

