猪非典型性瘟病毒RT-PCR检测方法的建立及初步应用
郭佳琪 杨晓宇 冯宇 杨钒 徐志文 朱玲


摘要:为建立一种快速、准确检测猪非典型性瘟病毒(APV)的方法,根据Genbank发布的APPVNS2基因序列,设计合成1对扩增后目的基因片段大小为500bp的特异性引物。建立的R’T-PCR方法对猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV)和猪瘟病毒(CSFV)的检测结果均为阴性,该方法对APPV的最低检岀量为1μl4.95×10拷贝,重复性试验中组间、组内试验结果均与预期相符。应用该方法对68份疑似患病的仔猪样品进行检测,阳性病料检出率为7.35%。利用Mega7.0绘制APⅤ系统进化树,对APPⅤ进行遗传进化分析,结果显示本试验检出的APPⅤ(SC株)与中国报道的APPV的亲缘关系较近。建立的APPV RT-PCR检测方法可用于APPV的临床诊断及流行病学检测。
关键词:猪非典型性瘟病毒;RT-PCR;检测
中图分类号:S858281.34+7
文献标识码:A
文章编号:1000-4440(2019)02-0357-06
仔猪先天性震颤(Congenital tremors,CT)会导致仔猪出生后数小时内出现骨骼肌双侧痉挛性收缩,妨碍仔猪站立、步行和寻找乳头3,致使仔猪饥饿和初乳摄入不足,严重的可导致仔猪死亡。一般根据神经系统是否发生病变,将CT分为A型和B型,A型有明显的大脑和脊柱的组织学损伤,B型无损伤45。A型又可分为A~A-V5种亚型,其中只有A-I型与AⅡ型具有传染性。A-型一般认为是由猪瘟病毒(Classical swine fever virus,CSFV)引起,以小脑发育不全为特征67。AⅡ型的病因存在一定争议,直到2015年,Hause等通过宏基因组测序发现了猪非典型性瘟病毒(Atypical porcine pestivirus virus,APPV)2016年,Arruda9确定APPV是A的病因。随后,德国、荷兰、奥地利等多个国家先后发现猪群存在APPV流行0。2017年,华南农业大学许古明等1首次发现中国猪群APPV的发生,这使中国兽医学界展开了对APPV的研究。
APPⅤ属于黄病毒科瘟病毒属,该病毒属还包括牛病毒性腹泻病毒1型(Bovine viral diarrhea virus1,BVDV-1)和2型(Bovine viral diarrhea virus-2BVDV-2)、猪瘟病毒(CSFV)和边界病病毒(Borderdisease virus,BDV)及之后发现的其他瘟病毒(Ho[12]1-llke pestivirus APPV是基因组长约11kb的RNA病毒,包含上游5UTR、ORF和下游3UTR,ORF区编码的蛋白质可分为4种结构蛋白(C、Ems、E1、E2)和8种非结构蛋白(Npro、P7、NS2、NS3、NS4A、NS4B、NS5A、NS5B)[14]。
RT-PCR检测方法对样品纯度要求低,不用分离病毒及培养细胞,具有操作简单快速、成本低、敏感性高等特点5,建立APPV的RT-PCR检测方法对于国内猪非典型性瘟病毒的检测研究具有重要意义。我们根据Gen bank发表的APPⅤ基因组序列,选择APPV MS2基因,建立RT-PCR快速检测方法,通过该方法对采自规模化猪场的疑似患病样品进行检测,并对其阳性样品PCR产物进行基因测序和遗传进化分析,为兽医临床诊断提供一种可靠的检测方法。
1材料与方法
1.1 病毒和病料
猪繁殖与呼吸综合征病毒(Porcinereproductiveandrespiratorysyndromevirus,PRRSV)、伪狂犬病毒(Pseudorabiesvirus,PRV)和猪瘟病毒(CSFV)均由四川农业大学动物生物技术中心保存。病料(颌下淋巴结、小脑、腹股沟淋巴结等)采自四川省遂宁、邛崃、大邑、崇州、宜宾等地区的规模化养猪场。
1.2 主要试剂
5×Prime script buffer、Prime Script rt enzyme MixI、Oligo dT primer、Random 6 mers,RNase free dH2O、DL2000 DNA marker、Trizol、Taq Hs、10×Reaction buffer(Mg2+free)均購自宝生物工程(大连)有限公司。质粒提取试剂盒(Plasmid Kit I)购自Omega公司。
1.3 APPV引物设计与合成
根据Genbank发表的APⅤ基因组序列,选择APPVNS2基因,应用NCB设计引物,由生工生物工程(上海)股份有限公司合成。上游引物序列为5′GAACTAAGACCAACACGGAT-3′,下游引物序列为5′-GAGGGTAGGAAGGGAAAG-3′,其预期扩增片段大小为500bp,稀释为20μmo/L备用。
1.4 病毒RNA的提取及反转录
将疑似患非典型性猪瘟的样品充分剪碎,加入液氮研磨成粉末,再加入适量生理盐水保存于EP管中备用。采用Til法提取病料RNA,随后用反转录试剂盒将提取的RNA反转录成CDNA。反转录体系(10.0):RNase free dH2O 3.51,5×Prime script buffer 2.0ul,Random 6 mers 0.5 ul,Oligo dT primer0.5 ul,Primer Script RT enzyme Mix 10.5 ulRNA模板3.0μ。产物于-20℃冰箱保存备用。
1.5 APPV的RT-PCR方法建立
PCR反应体系(25.0μl)为:eDNA2.0μl,10xReactionbuffer2.5μl,dNTPMix1.0μl,TaqHs0.5μl,上、下游引物各0.5μl,加ddH20至25.0μl。反应条件为:95.0C4min;95.0C30s,58.4C30s,72.0C30s,30个循环;72.0C7min。
1.5.1 Mg2+、TaqHs、dNTPMix用量的优化PCR反应体系总体积25.0μl保持不变,分别调整Mg2*、TaqHs、dNTPMix的用量,對反应体系进行优化。Mg2+用量依次为0.5μl、1.0μl、1.5μl、2.0μl、2.5μl和3.0μl,TaqHs用量依次为0.1μl、0.2μl0.3μl、0.4μl、0.5μl和0.6μl,dNTPMix用量依次为1.0μl、1.5μl、2.0μl、2.5μl、3.0μl和3.5μl。在单一变量的情况下,选取目的条带扩增效果最好的试剂用量。
1.5.2 引物用量及退火温度优化在Mg2*、TaqHs、dNTPMix用量优化的基础上,分别改变引物用量(1.0 μl、1.5 μl、2.0 μl和2.5 μl)和退火温度(52.0℃、52.7℃、54.0℃、55.9℃、58.4℃、60.3℃、61.4℃、和62.0℃、),进行PCR扩增,筛选最适引物用量和退火温度。
1.5.3 RT-PCR的特异性试验在上述优化条件下,应用建立的RT-PCR方法对APPV、PRRSV、PRV、CSFV进行特异性检测,设阴性对照组,验证该方法的特异性。
1.5.4 RT-PCR的敏感性试验用质粒提取试剂盒提取APPV质粒,用核酸蛋白质仪测定所构建的阳性质粒浓度,计算出模板的拷贝数。在上述优化条件下,将模板进行倍比稀释进行RT-PCR,以验证本方法的敏感性。
1.5.5 RT-PCR的重复性试验提取APPV阳性病料RNA,以反转录的产物为模板,应用建立的RT-PCR方法分别进行组间、组内重复性试验,以验证本方法的稳定性。
1.6 临床样品检测及阳性样品鉴定
将68份样品病料充分剪碎,加入液氮研磨成粉末,再加入适量生理盐水制得研磨液,-20℃、保存备用。Trizol法提取病料的RNA,随后用反转录试剂盒将提取的RNA反转录成eDNA,然后用建立的RT-PCR方法进行APPV检测,对检测数据进行统计分析。
1.7 遗传进化分析
应用Mega7.0软件对获得的阳性序列、GenBank公布的APPV基因序列和同是黄病毒科瘟病毒属的BVDV-1、BVDV-2、BDV、CSFV等毒株基因序列共同绘制系统进化树,分析APPV的遗传与进化规律,丰富完善APPV流行病学资料。
2 结果
2.1 猪非典型性瘟病毒NS2基因的RT-PCR扩增
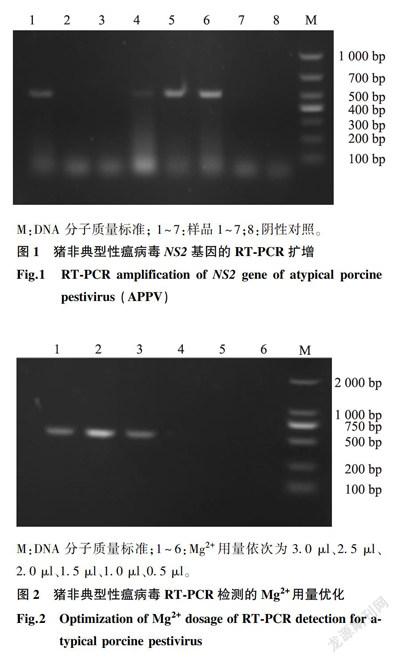
将疑似患病样品处理后提取其RNA,用设计的引物进行RT-PCR反应。电泳结果显示,本研究设计的引物扩增出1条约500 bp的条带(图1),与预期结果一致。
2.2 猪非典型性瘟病毒(APPV)RT-PCR检测的优化反应条件
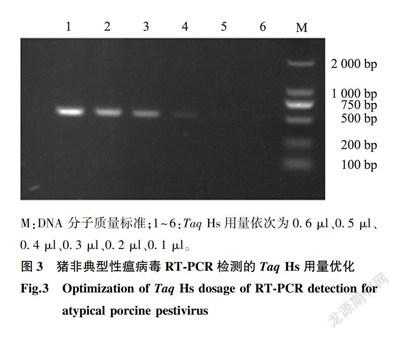
在其他条件不变的情况下对Mg2+、Taq Hs、dNTP Mix用量单一变量进行优化。结果显示,当Mg*+、Taq Hs、dNTP Mix用量分别为2.5 μl、0.6 μl、1.0 μl时,扩增的条带最为清晰(图2、图3、图4)。
固定25μlPCR反应体系的其他条件不变,对引物用量和引物退火温度进行优化。结果表明最佳引物用量为2.5 μl(图5),最佳退火温度为58.4℃(图6)。
2.3 猪非典型性瘟病毒(APPV)RT-PCR检测的特异性
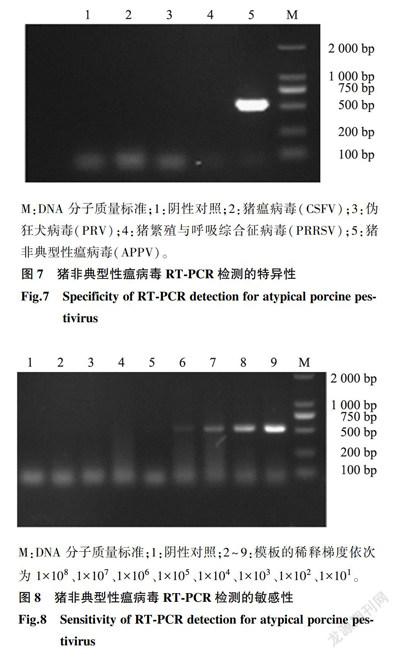
对建立的APPVRT-PCR检测方法的特异性进行试验,结果表明建立的APPV RT-PCR检测方法对猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV)和猪瘟病毒(CSFV)的检测结果均为阴性(图7)。说明本研究建立的方法特异性强,与其他病原无交叉反应。
2.4 猪非典型性瘟病毒(APPV)RT-PCR检测的敏感性
采用建立的RT-PCR检测方法对倍比稀释后的APPV阳性质粒进行扩增,1%琼脂糖电泳观察。用NanoDrop测定6号APPV样品检出量为1 μl4.95x10*拷贝(图8),表明该方法敏感性较强。
2.5 猪非典型性瘟病毒(APPV)RT-PCR检测的重复性
对样品中猪非典型性瘟病毒核酸分别进行组间、组内重复性试验,结果均一致(图9),表明本试验方法的重复性较好。
2.6 建立的APPVRT-PCR检测方法对临床样品的检测应用
利用本试验建立的RT-PCR检测方法对68份疑似患病样品进行检测,共检出阳性样品5份,阳性检出率为7.35%。将5份阳性样品的PCR产物进行测序,测序结果证实目的条带均为APPV NS2基因的特异性片段。测序分析结果与RT-PCR结果高度一致,进一步验证了本试验建立的检测方法的特异性与准确性。
2.7 猪非典型性瘟病毒(APPV)遗传进化分析
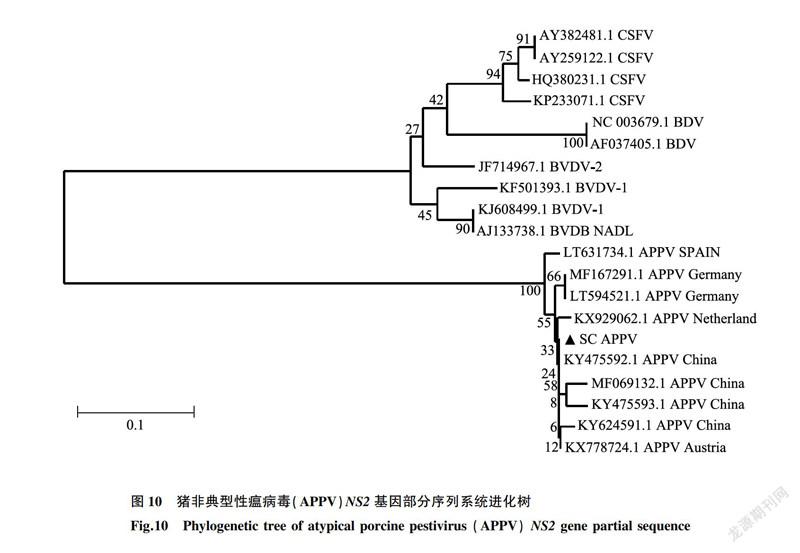
将检出的临床阳性样品RT-PCR产物送至生工生物工程(上海)有限公司测序。用Mega7.0软件对APPV阳性样品的基因序列和GenBank已发表的APPV基因序列,以及与APPV同科同属的BVDV-1、BVDV-2、BDV、CSFV等基因序列进行遗传进化分析。结果(图10)表明,本研究中检出的猪非典型性瘟病毒(SC株)NS2基因序列与所有APPV基因参考序列均处于同一分支,与其他APPV核苷酸序列的同源性在92%以_上。SC株与中国报道的APPV的亲缘关系较近,与国外报道的APPV的亲缘关系较远。且与CSFV、BDV及BVDV均不在同一分支内。
3 讨论
猪非典型性瘟病毒(APPV)是中国最近几年才检测出的一种新病毒。人工感染试验证实APPV是一种可以引起A-I型仔猪先天性震颤的病原9]。感染该病毒的仔猪四肢、头部或全身出现有节奏的震颤[16],强烈的重复性震颤使仔猪无法寻找乳头,导致仔猪母乳摄入不足,严重时会导致仔猪死亡。如果护理得当,大多数仔猪断奶后震颤现象自行消失以。中国养猪业规模庞大,在受影响的养殖场中发现约1%~2%的流行率,由于养猪业的规模和100%淘汰率,AP-PV造成了极大的经济损失[8],促使我们为兽医临床诊断建立一种简单快速的检测方法。
本试验根据GenBank中已发表的APPVNS2基因序列,设计了1对特异性引物并且成功建立了一种APPV的RT-PCR快速检测方法。特异性试验结果表明,本研究建立的方法可以特异性地从样品中检测出APPV,而与PRRSV、PRV和CSFV等病原无交叉反应,具有较高的特异性。敏感性试验结果表明,建立的RT-PCR检测方法的最低检出量为1 μl4.95x104拷贝。为验证该方法的稳定性,本研究进行了组间、组内重复性试验,结果表明该方法具有良好的重复性。对采自四川省遂宁、邛崃等地区的68份疑似患病样品进行检测,共有5份检测结果为阳性,阳性检出率为7.35%。同时,我们根据阳性产物测序结果利用Mega7.0绘制APPV的系统进化树[17],发现本研究检测的APPV SC株与其他APPV核苷酸序列的同源性在92%以上,SC株与中国报道的APPV的亲缘关系较近,并且国内大部分APPV分离株与国外分离株位于不同分支,表明国内的APPV的生物学特性、致病性等与国外分离株可能有所区别。以上试验结果均表明,本试验研究建立的APPV RT-PCR检测方法可应用于临床APPV的诊断、检测和流行病学调查,为今后开展APPV的深入研究提供了技术手段,有广阔的应用前景。
参考文献:
[1]ARRUDA B L,ARRUDA P H,MAGSTADT D R,et al.Identification of a divergent lineage porcine pestivirus in nursing pigletswith congenital tremors and reproduction of disease following experimental inoculation[J].PLoS ONE,2016,11(2):e0150104.
[2]杨晓宇,徐雷,殷鑫欢,等.猪非典型性瘟病毒与猪流行性腹泻病毒双重PCR方法的建立与应用[J].江苏农业学报,2018,34(5):1081-1086.
[3]PATTERSON DS,DONE J T,FOULKESJ A,et al.Neurochemistry of the spinal cord in congenital tremor of piglets(type AII)a spinal dysmyelimogenesis of infectious origin[J].Neurochem,1976,26:481-485.
[4]PATTERSON DS,SWEASEY D,BRUSH P J.Neurochemistry of the spinal cord in British Saddleback piglets affected with congenital tremor,type A-IV,a second form of hereditary cerebrospinal hypomyelinogenesis[J].J Neurochem,1973,21(2):397-406.
[5]BAUMGARTNER B G,BRENIG B.The role of proteolipid proteins in the development of congenital tremors type A I:A review[J].Dtsch Tierarztl Wochenschr,1996,103(10):404-407.
[6]DE GROOF A,DEIJS M,GUELEN L,et al.Atypical porcine pestivirus:A possible cause of congenital tremor type A-II in new-borm piglets[J].Viruses,2016,8(10):271.
[7]DONEJ T,WOOLLEY J,UPCOTT D H,et al.Porcine congenital tremor type All:Spinal cord morphometry[J].Br Vet J,1986,142:145-150.
[8]YUANJ,HANZ,LIJ,et al.Atypical porcine pestivirus as a novel type of pestivirus in pigs in China[J].Frontiers in Microbiology,2017,8:862.
[9]POSSATTI F,HEADLEY s A,LEME R A,et al.Viruses associated with congenital tremor and high lethality in piglets[J].Trans-boundary and Emerging Diseases,2018,65(2):331-337.
[10]POSTEL A,HANSMANN F,BAECHLEIN C,et al.Presence of atypical porcine pestiviru(APPV )genomes in new-born piglets correlates with congenital tremor[J].Sci Rep,2016,6:27735.
[11]许古明,葛士坤,张凯照,等.猪非典型瘟病毒的基因组特征分析及荧光定量RT-PCR检测方法的建立[J].中国善医科学,2017(11):1357-1362.
[12]MOSENA A CS,WEBER M N,DA CRUZ R A S,et al.Presence of atypical porcine pestivirus (APPV)in Brazilian pigs.[J].Transboundary and Emerging Diseases,2018,65(1):22-26.[13]BEER M,WERNIKE K,DRAGER C,et al.High prevalence of highly variable atypical porcine pestiviruses found in Germany[J].Transboundary and Emerging Diseases,2017,64(5):22-26.
[14]ZHANG H,WEN W,HAO G,et al.Phylogenetic and genomic characterization of a novel atypical porcine pestivirus in China.[J].Transboundary and emerging diseases,2018,65(1):202-204.
[15]夏文龍,余树培,吴植,等.荧光定量RT-PCR检测高致病性PRRSV接触感染仔猪增殖动态[J].江苏农业科学,2018,46(10):169-172.
[16]张文波,吴松松,邓舜洲,等.一种新型仔猪先天性震颤及其病原的初步研究[J].中国畜牧兽医,2017,44(7):2147-2154.
[17]董安国,高琳,赵建邦,等.基于DNA序列的系统进化树构建[J].西北农林科技大学学报(自然科学版),2008,36(10):221-226.

