外源水杨酸对日本落叶松几种主要防御蛋白活力的影响
陈咏梅,彭飞飞,林健
(湖北民族大学,湖北 恩施 445000)
诱导抗性是指植物在遇到损伤、捕食、外源信号化合物等外界因素的诱导下,能影响植食者行为或降低其偏好的反应[1],诱导抗虫性是指植物在植食昆虫摄取后表现出的一种抗虫特性[2]。目前已发现多种生物和非生物因子通过诱导植物部分或整株产生有毒的次生物质、防御蛋白、驱避性物质,或改变自身营养状态,或产生吸引天敌的挥发物等,从而使其免害或避害,达到抗虫、防御的目的[3]。苯丙氨酸解氨酶(phenylanlanine ammonia-lyase, PAL)、多酚氧化酶(polyphenol oxidase, PPO)是植物体内主要防御性酶,过氧化氢酶(Catalase, CAT)、过氧化物酶(Peroxidae, POD)是植物体内主要保护性酶,它们作为植物体内关键的防御蛋白,与植物抗性紧密关联[4]。马荣金[5]等对不同黄瓜品种的抗性研究表明,植物的抗性与PAL、PPO的活性密切相关,植物细胞为应对外界胁迫而激活其PAL活性,表明酶活性与植物抗虫能力密切相关[6]。
水杨酸( salicylic acid, SA)是植物体内常见的一种小分子酚类物质[7],其不仅能调节植物的生长和发育,还在植物对生物胁迫和非生物胁迫的抗性中起重要作用[8]。日本落叶松(Larixkaempferi),姿态优美,叶色翠绿,生长初期较快,木材机械性能好,是中山地带造林的优良树种,其引种栽培,不仅对国内木材供应、城市绿化等方面产生重大影响,而且具有较高的生态价值[9]。随着日本落叶松在我国种植面积的不断增大,其病虫害防治也应加大力度,目前对日本落叶松虫害的研究较少且缺乏系统性。鉴于此,本研究以不同浓度梯度的SA处理日本落叶松并测定针叶内主要防御蛋白活力变化,探讨不同浓度水杨酸对日本落叶松诱导抗性的影响,为有效防治落叶松球蚜和诱导抗虫性机制研究提供理论和实践依据。
1 材料与方法
1.1 试验材料及设计
试验地位于恩施州建始长岭岗林场,林场地处鄂西建始县龙坪乡,中心位置30°48′ N、110°03′ E,海拔1 600~1 900 m,属北亚热带气候,是国家林木良种基地,建有南方日本落叶松种子园,该县是中国南方最大的日本落叶松基地县[10]。2018年5月初,于试验苗圃地选取2000株2年生日本落叶松苗,自然条件下培育待用。7月末,将水杨酸配制成3种浓度的溶液对苗木进行诱导处理,对照喷施等量溶剂,每处理组150株。详见表1。
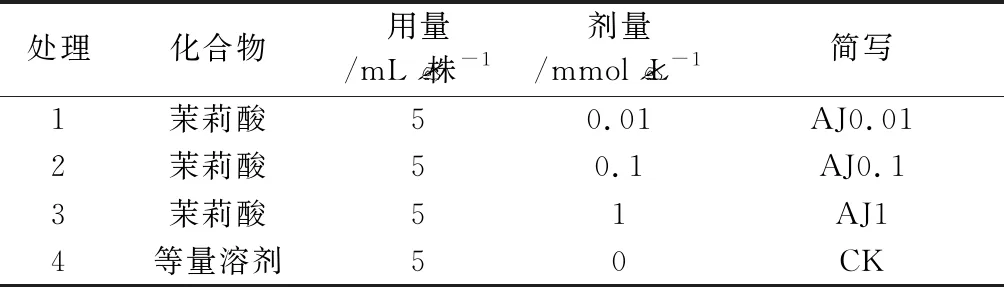
表1 外源水杨酸对日本落叶松的处理
处理后第1、3、5和7天进行落叶松针叶采集取样。取样时,在每株各方位上摘取完整的针叶,并充分混合均匀。每个处理采集16株,每4株为一个重复,重复4次,每个重复摘取30 g新鲜针叶。新鲜针叶立即进行液氮冷冻并置于冰箱冷冻保存待用。
1.2 仪器与试剂
仪器:D-37520冷冻离心机(德国)、电热恒温水浴锅(上海森信实验仪器有限公司)、UV-240紫外分光光度计(Biochtom Ltd. Cambridge CB4 OF J. England)、电子天平(奥豪斯国际贸易上海有限公司)、可调式移液器(上海雷勃分析仪器有限公司)。
试剂:PAL、PPO、CAT、POD试剂盒,均购自苏州科铭生物技术有限公司。
1.3 酶活力测定方法
取适量日本落叶松针叶鲜样进行液氮粗磨,后准确称取日本落叶松针粗磨样品0.1 g,低温保存备用。酶活力测定均按照试剂盒说明书操作。
1.4 数据分析
数据分析使用SPSS24.0软件,对试验数据进行处理和方差分析;差异显著性检验采用LSD、邓肯法。
2 结果与分析
2.1 不同处理4种酶活性随时间的变化趋势
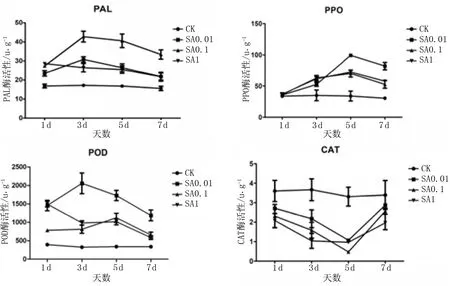
图1不同处理4种酶活性随时间的变化趋势
由图1可知,相对CK,不同浓度的SA处理后,PAL、PPO、POD活性均显著上升,并呈现先上升后下降的波动性变化;而CAT活性在处理后呈现先下降后回升的波动性变化,但未发现其与浓度呈现明显的依赖关系。
2.1.1 不同浓度SA对日本落叶松针叶内防御性蛋白活性的影响
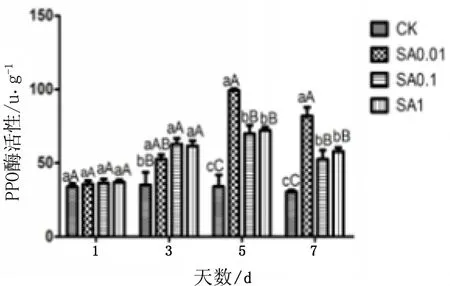
图2不同浓度SA对日本落叶松针叶内防御性酶活性的时序变化
注:上图同一天中柱形图上不同小写字母表示在P=0.05水平上差异显著,不同大写字母表示在P=0.01水平上差异显著;相同则表示差异不显著。以下同
由图2可知,不同浓度SA处理后的PAL、PPO活性显著高于CK,且在不同浓度梯度之间活性差异显著,其中SA0.1浓度下PAL活性最高、SA0.01浓度下PPO活性最高。
PAL活性,在SA0.01处理后,第1天及第3天时与CK差异极显著,第5天时与CK差异显著,第7天时与CK差异不显著;SA0.1处理在各时间段均与CK差异极显著;SA1处理仅在第1天时酶活性显著高于SA0.01和SA1处理CK。
PPO活性,在各浓度SA处理后,第1天均与CK差异不显著,第3天、5天、7天均与CK差异显著;SA0.01处理酶活性在第5天、7天均显著高于SA0.1和SA1处理。
2.1.2 不同浓度SA对日本落叶松针叶内保护性蛋白活性的影响
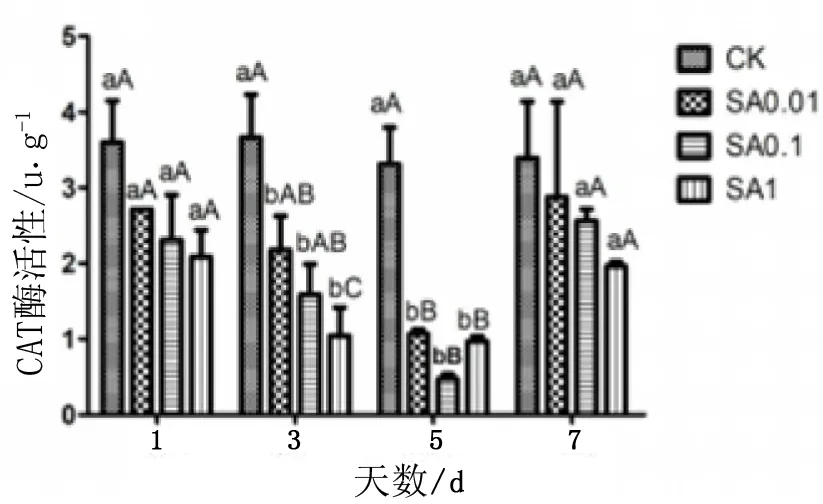
图3不同浓度SA对日本落叶松针叶内保护性酶活性的时序变化
由图3可知,CAT活性,在不同浓度SA处理后,均呈现先下降后上升的态势,且在不同浓度梯度之间活性差异不显著;各浓度处理在第1、7天时与CK差异不显著,而在第3、5天时与CK表现出显著差异。
POD活性,在SA0.01处理后,第1~7天均与CK差异极显著;SA0.1在第5天时与CK差异极显著,其余天数与CK差异显著;SA1处理除第7天外,其余天数均与CK差异极显著,且SA1处理在第1天后活性呈下降趋势;除第1天外,SA0.01处理酶活性均显著高于SA0.1和SA1。
3 结论与讨论
诱导抗性是植物非常重要的防御措施,具有非常复杂的适应可塑性[11]。相较于植物固有的组成抗性,诱导抗性是一种更为经济有效的防御机制[12]。PAL、PPO、CAT和POD与植物的防御抗性密切相关,常作为衡量植株抗性水平的关键酶,其活性改变预示着植物化学防御体系正在发生改变[13]。本研究表明,外源SA喷施后,日本落叶松内PAL、PPO、POD活性均显著增加,其中0.1 mmol·L-1的SA溶液对PAL活性的诱导效果最佳,0.01 mmol·L-1的SA溶液对PPO和POD活性的诱导效果最佳且酶活性持续时间长;而CAT活性均呈现下降趋势。这与刘凤权和原永兵[14,15]研究结果一致,表明外源SA能迅速诱导日本落叶松针叶内防御物质的表达和积累,提高日本落叶松的抗虫性。
研究外源水杨酸与植物防御之间的关系为害虫治理和抗虫植物培育提供了新的思路。本研究表明,SA能够在保持植株完好的情况下,诱导植物防御蛋白的变化,其作为植物抗虫诱导剂,具有高效、环保、可持续等特点,可实现林木害虫绿色防治,为探索环境友善型害虫防治技术奠定基础。但本试验仅作为一种基础性的研究,为日本落叶松诱导抗性提供实践和理论基础,后期可进行SA溶液缓释处理、控制酶活性的基因及处理后的针叶内挥发性物质进行进一步的研究,使外源SA诱导日本落叶松抗性增强技术能在林间综合治理中得到有效应用。

