MTHFD1及FPGS和GGH基因多态性对大剂量甲氨蝶呤中枢疗效的影响*
陈琴,何劲松,陈娟,赵秋玲,杨琳,谢瑞祥
(福建省肿瘤医院、福建医科大学附属肿瘤医院药剂科,福州 350014)
非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)是我国较常见的、起源于淋巴结及淋巴组织的恶性肿瘤。近年来其发病率呈持续上升趋势,超过大部分恶性肿瘤的增长速度[1]。大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)可透过血-脑、血-眼等生理屏障[2],是治疗原发性中枢神经系统淋巴瘤和NHL中枢转移的重要措施。HD-MTX的中枢治疗效果存在个体差异。研究表明,药物代谢过程关键酶的基因多态性与药物疗效的个体差异关系密切[3]。亚甲基四氢叶酸脱氢酶(methylenetetrahydrofolate dehydrogenase 1,MTHFD1)是叶酸代谢过程的关键酶之一,催化四氢叶酸一碳单位交换的3个连续反应,在5,10-亚甲基四氢叶酸和10-甲酰四氢叶酸的生成中起重要作用,从而影响DNA合成[4]。MTHFD1基因变异导致其活性的差异不仅可以影响不同疾病的易感性,还可以调节抗叶酸化疗药物的疗效[5]。
MTX进入体内后,在叶酰多聚谷氨酸合成酶(folylpolyglutamate synthetase,FPGS)的作用下聚谷氨酸化,生成主要活性产物MTX 多聚谷氨酸盐(MTXPGs)。γ-谷氨酰水解酶(gamma-glutamyl hydrolase,GGH)能够将长链MTXPGs去谷氨酸化为短链MTXPGs,最终变成游离MTX,泵出细胞外。MTXPGs能在细胞内更持久更强效地发挥作用,研究显示,FPGS和GGH的活性高低,会影响到细胞内主要活性代谢产物MTXPGs的浓度,可能影响MTX的疗效[6-8]。
目前研究主要集中在MTHFD1、FPGS和GGH基因多态性与HD-MTX血药浓度和不良反应的关系[9-11],较少涉及中枢疗效方面。本研究探讨MTHFD1 rs2236225、FPGS rs10106和GGH rs1800909基因多态性对NHL患者MTX中枢治疗效果的影响,以期为MTX的临床个体化合理使用提供理论参考依据。
1 资料与方法
1.1临床资料 选择我院2014年1月—2017年12月接受HD-MTX化疗的原发中枢和中枢转移的NHL患者。入选标准:汉族,年龄75岁以下,经病理组织学或细胞学确诊为NHL,符合原发中枢或中枢转移NHL的临床诊断标准,卡氏功能状态评分≥60分,预计生存期>3个月。排除标准:肝肾功能异常,其他严重并发症、精神疾病患者、妊娠及哺乳期妇女。本研究经我院伦理委员会批准,所有患者均签署知情同意书。
1.2药品、试剂和仪器 MTX注射液由江苏恒瑞医药股份有限公司提供(批号:13020512,14022416,15032215,1512015,170222AG);血液基因组DNA提取试剂盒由北京天根生化科技有限公司提供(批号:03611);Platinum®Taq DNA聚合酶、聚合酶链反应(PCR)扩增缓冲液体系、定制的引物均由Life TechnologiesTM提供;基因检测所用试剂由上海华大基因科技有限公司提供。
1.3MTHFD1、FPGS和GGH基因多态性检测 MTX 剂量为2.0~3.5 g·(m2)-1,化疗前常规给予静脉补液,碱化尿液[12]。给药前静脉采血2 mL,加入依地酸二钠(EDTA)抗凝管,颠倒混合后保存待用,采用Qiagen试剂盒提取DNA,使用紫外-分光光度计测定DNA的浓度与纯度,选择A260/A280(A值)在1~8的样本为后续基因检测标本。从Genbank上查得目标SNP的核苷酸序列,采用Primer3.0版软件设计扩增目的片段引物序列,所有引物均委托公司合成。用美国 Sequenom 公司 MassARRAY 时间飞行质谱技术检测位点基因多态性。
1.4MTX疗效判定标准 根据美国国家综合癌症网络指南中NHL的卢加诺缓解标准对患者化疗后的疗效进行评价[13],CR为完全缓解,PR为部分缓解,PD为疾病进展,总缓解率为(CR+PR)/总例数×100%。
1.5统计学方法 应用SPSS22.0版统计软件对数据进行处理,用拟合优度χ2检验考察MTHFD1、FPGS和GGH的基因型分布是否符合Hardy-Weinberg平衡;用卡方检验来比较不同基因型与MTX疗效之间的差异;纳入年龄、性别、疾病分期、MTX剂量等因素进行多元回归分析;以P<0.05为差异有统计学意义。
2 结果
2.1患者基本资料 共纳入71例原发中枢和中枢转移的NHL患者(原发中枢43例,中枢转移28例),其中男42例,女29例,平均年龄(57.3±10.5)岁。病理分型弥漫性大B细胞淋巴瘤63例(88.73%),T淋巴母细胞淋巴瘤8例(11.27%)。疾病分期I或II期患者40例,Ⅲ或Ⅳ患者31例。
2.2MTHFD1 rs2236225、FPGS rs10106和GGH rs1800909基因多态性分布情况 MTHFD1 rs2236225位点GG、GA和AA基因型的分布频率分别为60.56% (43例)、33.80%(24例)和5.63%(4例);FPGS rs10106位点GG、GA和AA基因型的分布频率分别为54.93% (39例)、40.85%(29例)和4.23%(3例);GGH rs1800909位点AA、AG和GG基因型的分布频率分别为71.83%(51例)、22.54%(16例)和5.63%(4例)。各位点基因多态性分布符合Hardy-Weinberg 平衡(P>0.05)。
2.3MTHFD1 rs2236225、FPGS rs10106和GGH rs1800909基因多态性与疗效的相关性分析 CR和PR患者共41例(57.75%),PD患者30例(42.25%)。其中MTHFD1 rs2236225突变型患者化疗后客观缓解率明显低于野生型患者(39.29%比69.77%,P=0.011);纳入年龄、性别、疾病分期、MTX剂量等因素进行多元回归分析后,MTHFD1 rs2236225与疗效仍然有显著相关性(P=0.023)。见表1,2。
3 讨论
遗传基因的多态性可能会引起药物体内过程中的转运蛋白、代谢酶和作用靶点的活性改变,从而导致药物疗效的改变。MTHFD1 基因中研究比较多的位点是G1958A(rs2236225),该位点发生突变时,原来的鸟嘌呤G被腺嘌呤A替代,导致谷氨酰胺代替精氨酸,降低 MTHFD1 的稳定性,从而可能减少MTHFD1对叶酸代谢的影响,降低MTX抑制肿瘤细胞增殖的作用[14]。KRAJINOVIC等[15]研究发现,MTHFD1 rs2236-225 突变会增加无事件生存率的风险。本研究检测了71 例NHL患者的MTHFD1rs2236225位点基因型情况,发现MTHFD1基因多态性与MTX化疗有效性之间存在相关性,携带突变型基因的患者化疗后客观缓解率明显低于野生型基因携带者。推测原因是突变影响了代谢酶MTHFD1的热稳定性,减少了酶的活性,从而降低了MTX的疗效。
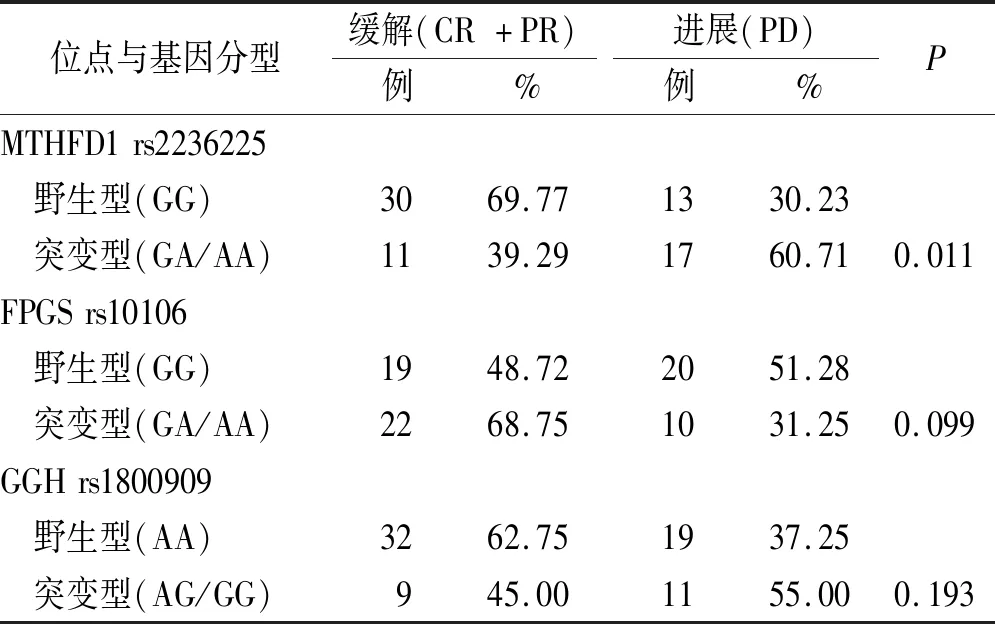
表1 MTHFD1 rs2236225、FPGS rs10106和GGH rs1800909基因多态性与疗效的相关性分析Tab.1 Correlation analysis between the efficacy and gene polymorphisms of MTHFD1 rs2236225,FPGS rs10106 and GGH rs1800909
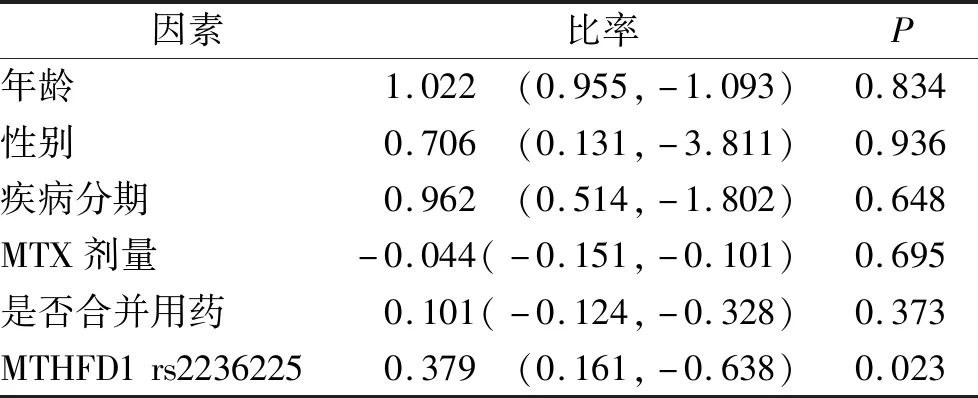
表2 MTHFD1 rs2236225与疗效的多因素回归分析Tab.2 Multivariate analysis of MTHFD1 rs2236225 and the efficacy
目前关于FPGS基因多态性与MTX疗效的相关研究主要集中在FPGS rs1544105和FPGSrs10106,结果存在争议。黄珍等[16]研究FPGS rs1544105 基因型与急性淋巴细胞白血病(ALL)患儿使用MTX化疗敏感性的关系,发现该位点突变纯合型患儿化疗有效率高于突变杂合型和野生型患儿,提示FPGS rs15441505基因多态性会影响MTX疗效;LIU等[17]、PANETTA等[18]研究却发现FPGS rs15441505野生型活性比非野生型增强,野生型患儿MTX疗效增加;而一项对内风湿性关节炎患者的研究显示,FPGS rs10106不影响MTX化疗敏感性[19]。
李越等[20]研究了FPGS和GGH的基因表达与MTX疗效相关性,结果显示,FPGS高表达组和低表达组复发率有显著差异,提示FPGS基因表达水平对ALL患儿的疗效有影响;而GGH基因表达水平与疗效的相关分析无明显相关性,提示GGH相对于FPGS,对MTXPG的浓度影响处于相对弱势的地位,当FPGS表达较高致MTXPG达到一定量时,GGH基因表达水平才可能发挥作用。本研究未发现FPGS rs10106、GGHrs1800909基因多态性与MTX中枢疗效的相关性,推测原因为:①FPGS和GGH的活性受调控区和编码区多个位点基因多态性影响,每个位点的权重尚不清楚[21-22];②本研究样本数量较少,患者MTX的剂量、联合用药等情况的差异对疗效影响的权重较大。
本研究结果提示MTHFD1 rs2236225的基因多态性与MTX中枢疗效之间存在一定相关性,由于本研究的样本数量较少,未来需要扩大规模来进一步明确该位点作为疗效预测指标的可行性。

