四唑化合物开环反应、晶体结构及相关抗微生物作用研究
房鹏金,齐冉,赵志龙,张慧珍
(临沂大学药学院,山东 临沂 276000)
随着抗生素的广泛使用甚至滥用,导致多药耐药菌株频发,严重威胁人类健康。近年来,将两种或两种以上的临床药物联用所产生的协同作用,常能克服多药耐药性,并提高药效和生物利用度。然而,对新型抗微生物药物的研发仍迫在眉睫,是药物化学家面临的严峻挑战。
四唑化合物作为一种重要的多氮芳杂环,能够发生多种非共价键相互作用,在医药、农药、化学、超分子等领域具有较大的应用前景[1-2]。因此,四唑化合物的合成和应用研究工作众多。值得一提的是,四唑类化合物不仅在医药领域显示出广泛的应用[3-4],如抗高血压药物奥美沙坦酯、坦坎地沙坦酯以及抗生素头孢雷特等,在农药领域[5-6]如除草剂四唑嘧磺隆,而且在材料领域[7-8],由于四唑类化合物结构稳定、含氮量高且生成焓高的特点,在起爆药、固体推进剂等含能材料的制备中应用普遍,此外,其在燃料电池、抗金属腐蚀、光敏材料和化学催化剂等方面的研究也较为活跃。因而,其广泛的潜在应用吸引了越来越多的努力致力于四唑类化合物的合成研究。
氨基四唑类化合物作为四唑类化合物的重要一员,其在医药领域的广泛应用同样吸引了无数研究致力于其合成研究[9]。基于课题组对唑类抗微生物化合物的研究,我们意外分离得到了氨基四唑环开环的结构产物(见图1),其结构经X-射线单晶衍射,并考察了所合成化合物的体外抗细菌抗真菌活性,与临床药物的联用效果,以及与小牛胸腺DNA的相互作用。

图1 氨基四唑的开环反应
1 实验部分
1.1 仪器与试剂 核磁共振仪(Bruker AV 300核磁共振仪);电热鼓风干燥箱(郑州长城科工贸有限公司);台式恒温振荡器(太仓市实验设备厂);LDZX-50KB立式压力蒸汽灭菌器(上海申安医疗机械厂);X-射线单晶衍射仪(日本理学Gemini E型单晶衍射仪,北京理化赛思科技有限公司)。
硅胶(青岛海洋化工厂);乙酰苯胺(国药集团化学试剂有限公司);氯磺酸、5-氨基四唑无水K2CO3、无水Na2SO4均为天津市恒兴化学试剂有限公司;二氯甲烷、丙酮、氯仿均为天津市富宇精细化工有限公司;氟康唑(富阳金伯士化工有限公司);诺氟沙星(重庆科瑞制药有限责任公司);氯霉素(四川泰华堂制药有限公司);小牛胸腺DNA(北京百泰生物技术公司)。
1.2 合成或制备
1.2.1 4-乙酰氨基苯-1-磺酰氯(4-acetamidobenzene-1-sulfonyl chloride)2的合成 在冰浴条件下,向化合物乙酰苯胺1(10.002 g,0.074 1 mol)中逐滴加入25 mL氯磺酸,搅拌至固体完全溶解后,将反应体系转移至60 ℃油浴中,继续反应2 h,冷却至室温.缓慢将反应体系倒入碎冰中,会产生大量的白色固体,抽滤,烘干滤饼得到白色固体2为16.212 g。
1.2.2 目标化合物3的合成 称取5-氨基四唑(3.658 g,0.043 mol)与无水碳酸钾(7.031 g,0.051 mol)于100 mL圆底烧瓶中,加入适量丙酮50 mL做溶剂,在50 ℃下搅拌反应1 h后,冷却至室温.然后加入化合物2(10.008 g,0.043 mol),继续室温下搅拌。用薄层色谱(展开剂:二氯甲烷/丙酮,5/1,体积比)跟踪反应。反应结束后,减压蒸出大部分丙酮后,加水30 mL,用氯仿(3×50 mL)萃取,合并有机相,无水硫酸钠干燥,减压浓缩,经柱色谱分离(展开剂:二氯甲烷/丙酮,5/1,体积比),析出块状无色透明晶体3,产率约70%。1H-NMRδ:11.32(s,1H,NH),10.32(s,H,NHCOCH3),7.82(d,2H,J=4.0 Hz,Ph-2,6-H),7.76(d,2H,J=4.0 Hz,Ph-3,5-H),2.09(s,3H,COCH3)。
1.4 抗细菌抗真菌活性测试 采用美国国家实验室标准委员会(NCCLS)[10]推荐的药敏实验方法进行化合物的抗细菌抗真菌活性测试。首先,二甲基亚砜(DMSO)溶解化合物和参考药物,配成 12.8 mg·mL-1溶液,并用无菌肉汤稀释至1 024 μg·mL-1。在无菌96孔板的每个孔中均加入100 μL菌液,采用倍比稀释法,将受试药液加入96孔板中的1~11号孔,使各孔中的药物浓度分别为512、256、128、64、32、16、8、4、2、1 和 0.5 μg·mL-1,12号孔不含药物,作阳性对照,此时,各孔中DMSO含量均低于1%,排除了溶剂DMSO对活性测试结果的影响。将96孔板在37 ℃恒温摇床上培养24 h。
1.5 化合物与临床药物联用活性测试 根据所测得的化合物3以及临床药物对测试细菌和真菌的MIC值,采用棋盘法,测定化合物与临床药物联用时,对细菌或真菌的抑制能力。联合作用效果用FIC指数来表征。FIC指数= 联合用药后化合物的MIC值/联合用药前化合物的MIC值 + 联合用药后临床药物的MIC值/联合用药前临床药物的MIC值。 FIC≤1,两者为协同作用;1
1.6 化合物与小牛胸腺DNA相互作用研究 采用紫外-可见光谱法初步研究化合物3与小牛胸腺DNA的相互作用。通过化合物3和小牛胸腺单独存在时吸光度之和和共存时吸光度值进行比较,增色性是由于破坏DNA的双螺旋结构引起的,化合物嵌插入DNA的双螺旋结构则造成吸光度降低。
2 结果与讨论
2.1 晶体结构 化合物3溶于二氯甲烷和丙酮的混合溶液中,其单晶是在室温下随着溶剂缓慢蒸发而生长的。化合物3的主要晶体结构参数和氢键数据见表1~2。
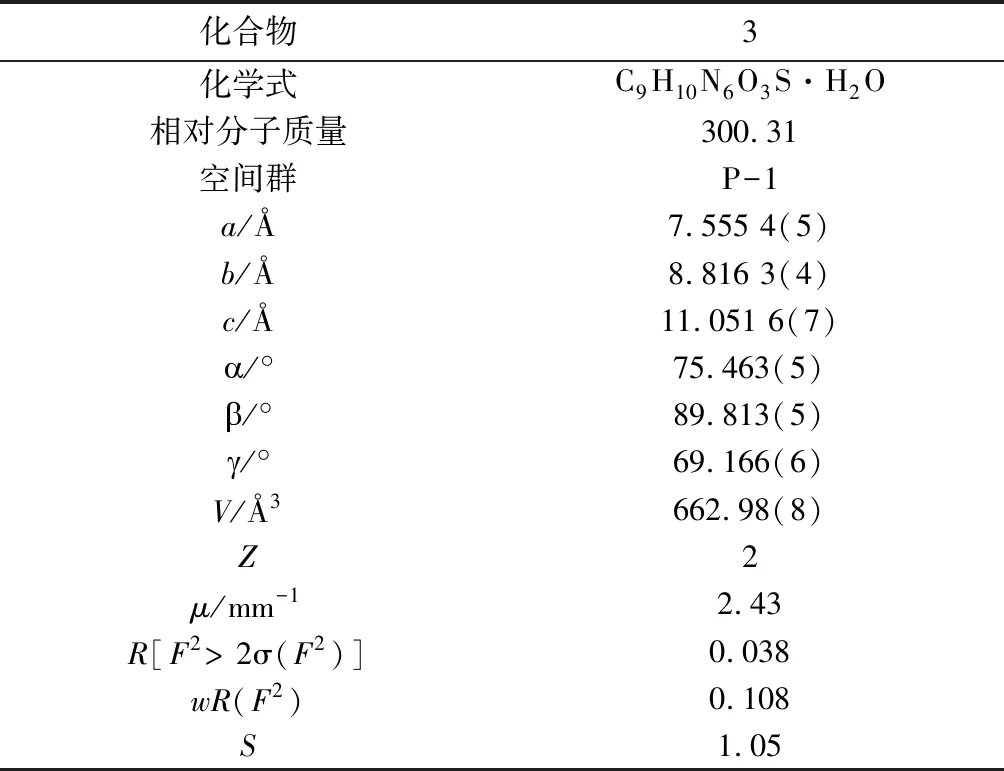
表1 化合物3的晶体学数据
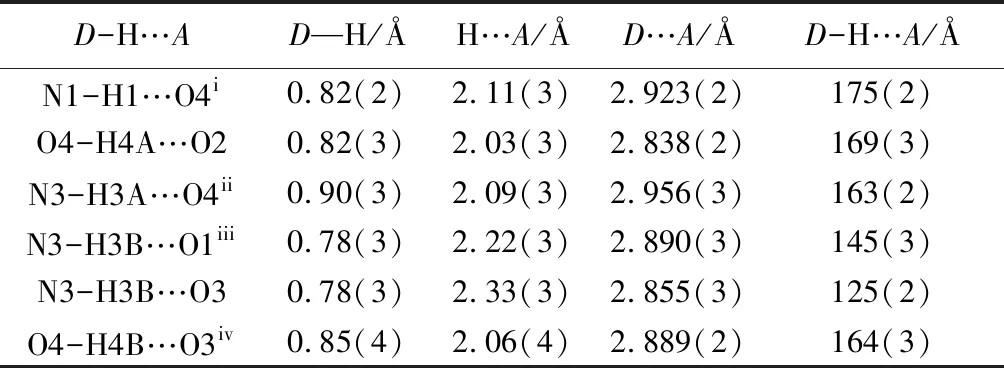
表2 化合物3中氢键的键长、键角数据
注:对称性操作代码:(i)x,y,z-1;(ii)-x+1,-y+2,-z+1;(iii)x,y+1,z;(iv)-x,-y+2,-z+1
图2是化合物3的晶体结构,从图中可以看出化合物含有一个结晶水,以水合物形式存在。化合物3分子间通过氧原子、乙酰氨基氮原子和氨基氮原子形成氢键,进而形成三维超分子结构,其沿a方向的空间堆积图如图3所示。
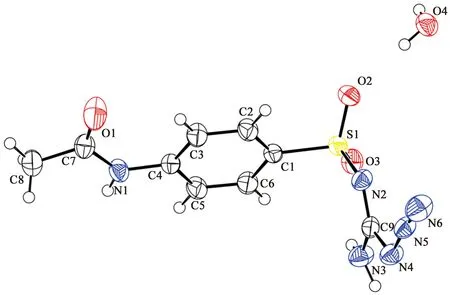
图2 化合物3的晶体结构图
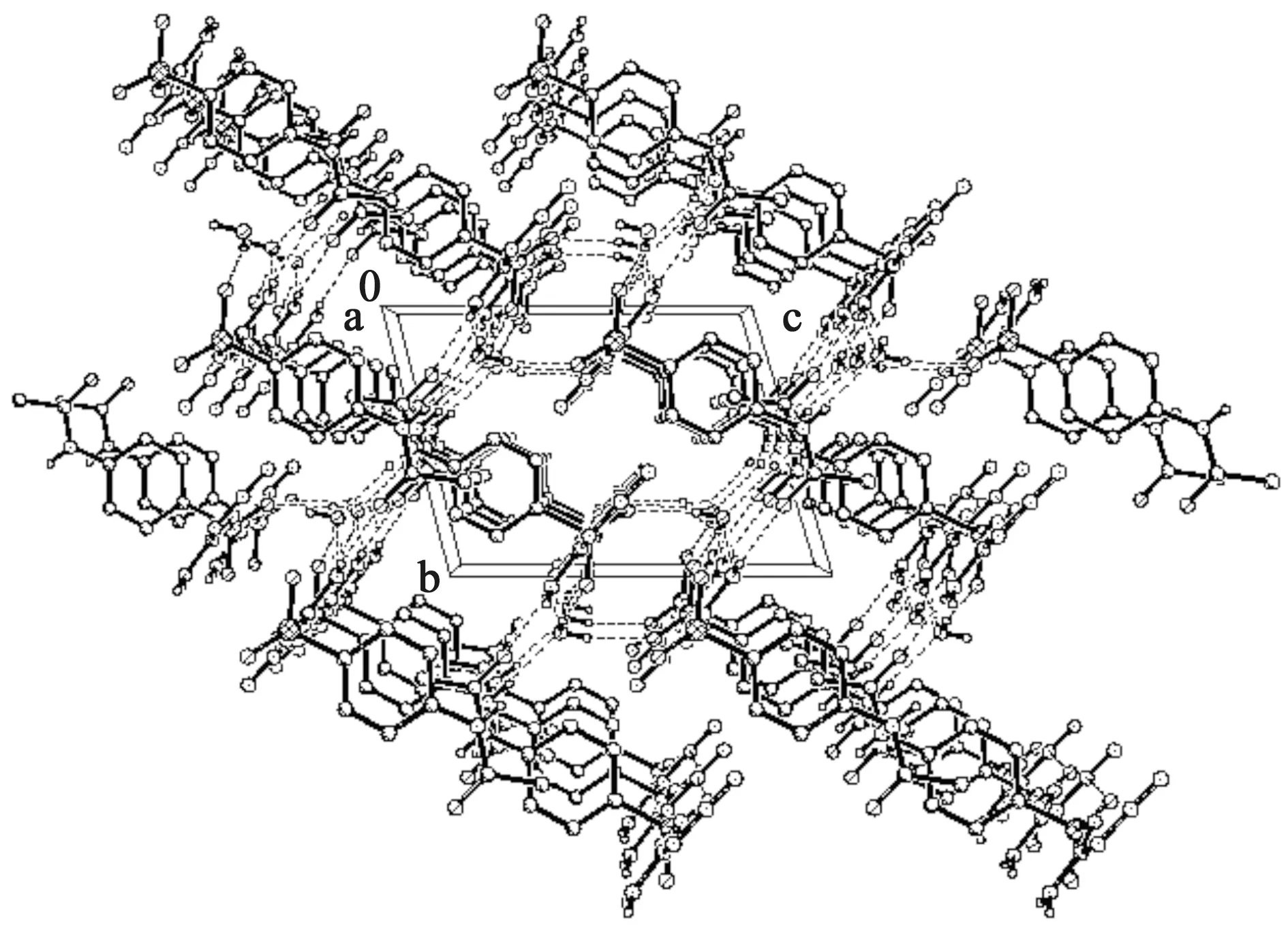
图3 化合物3垂直于a轴方向的三维堆积图
2.2 抗细菌抗真菌活性 化合物2和3的体外抗细菌、抗真菌数据见表3。测试的细菌有:金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌3种,和白色念珠菌、假丝酵母菌以及黄曲霉菌3种真菌。活性测试中分别选用氯霉素、诺氟沙星和氟康唑作为参考药物。

表3 化合物2和3的抗细菌和抗真菌活性(MIC,g·mL-1)
体外抗细菌和抗真菌活性结果表明:化合物2和3对所测试的细菌和真菌表现出弱到中等(MIC=64~256 μg·mL-1)的抑制活性.与参考药物氟康唑相比,化合物对耐氟康唑的黄曲霉菌的抑制活性强于氟康唑(MIC=256 μg·mL-1)。
2.3 化合物与临床药物联用活性 化合物3与临床药物氯霉素或诺氟沙星的联用抗细菌活性结果如表4所示。当氯霉素浓度为2~4 μg·mL-1或诺氟沙星浓度为0.25~1 μg·mL-1时,与化合物3联用即可显示有效的抗细菌活性,较单独用药时,剂量显著减少,抗菌能力明显增强.所有联用体系的FIC指数均小于1,显示较好的协同作用效果。

表4 化合物3和抗细菌药氯霉素或诺氟沙星的联用效果
临床药物氟康唑与化合物3的联用抗真菌活性结果(见表5)表明,化合物3与氟康唑的联用体系显示较好的抗白色念珠菌、假丝酵母菌和黄曲霉菌活性。当氟康唑浓度为0.25~1 μg·mL-1时,与一定浓度的化合物3(16~64 μg·mL-1)联用,即可显示较好的抗真菌活性。特别是对于耐氟康唑的黄曲霉菌,联用体系给出较好的抑制作用。因此,有望通过氟康唑与化合物的联用,拓宽氟康唑的抗真菌谱,改善其因用药剂量大而导致的毒性和耐药性等问题。
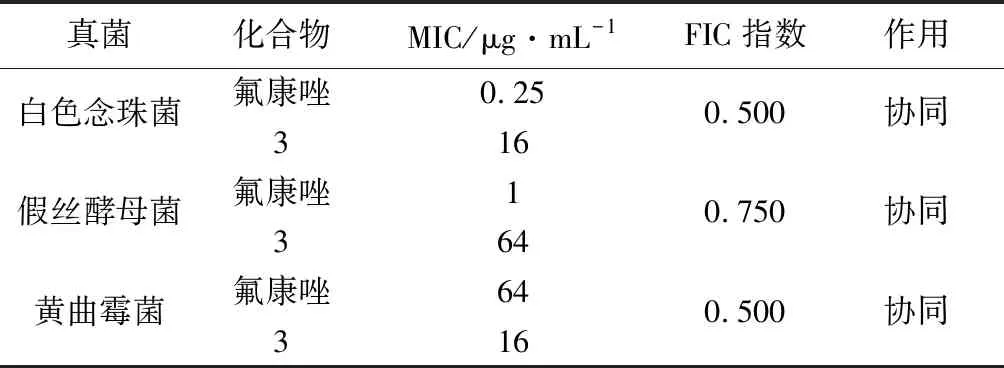
表5 化合物3和抗真菌药氟康唑的联用效果
2.4 化合物与小牛胸腺DNA的相互作用 DNA作为生物体中的重要生物大分子,对各种生命活动有着非常重要的作用,而且,其作为众多临床药物的主要靶分子,引起了广泛的关注。化合物与DNA的相互作用研究能够为新型DNA靶标药物的设计提供重要的理论指导。小牛胸腺DNA因其价廉易得等,而被普遍选择为研究的模型。利用紫外-可见光谱法研究了化合物3与小牛胸腺DNA的相互作用,初步从分子水平上探讨了其可能的抗微生物作用机制[12]。
一般认为,DNA吸收光谱的减色红移现象是由于化合物与DNA发生了嵌插作用,其芳香发色团与DNA的碱基对发生强烈的堆积,形成了DNA-化合物复合物导致;而增色性则是因为DNA双链的二级结构被破坏引起[13]。在图4中,随着化合物3浓度的增加,在260 nm处的DNA的吸光度比例增大。化合物3-DNA复合体系的吸光度值稍小于相应浓度的游离的化合物和DNA的吸光度之和(见图5),说明DNA的吸收光谱显示减色效应,其可能是因为化合物3嵌入DNA双螺旋结构,形成大的共轭体系引起[14]。
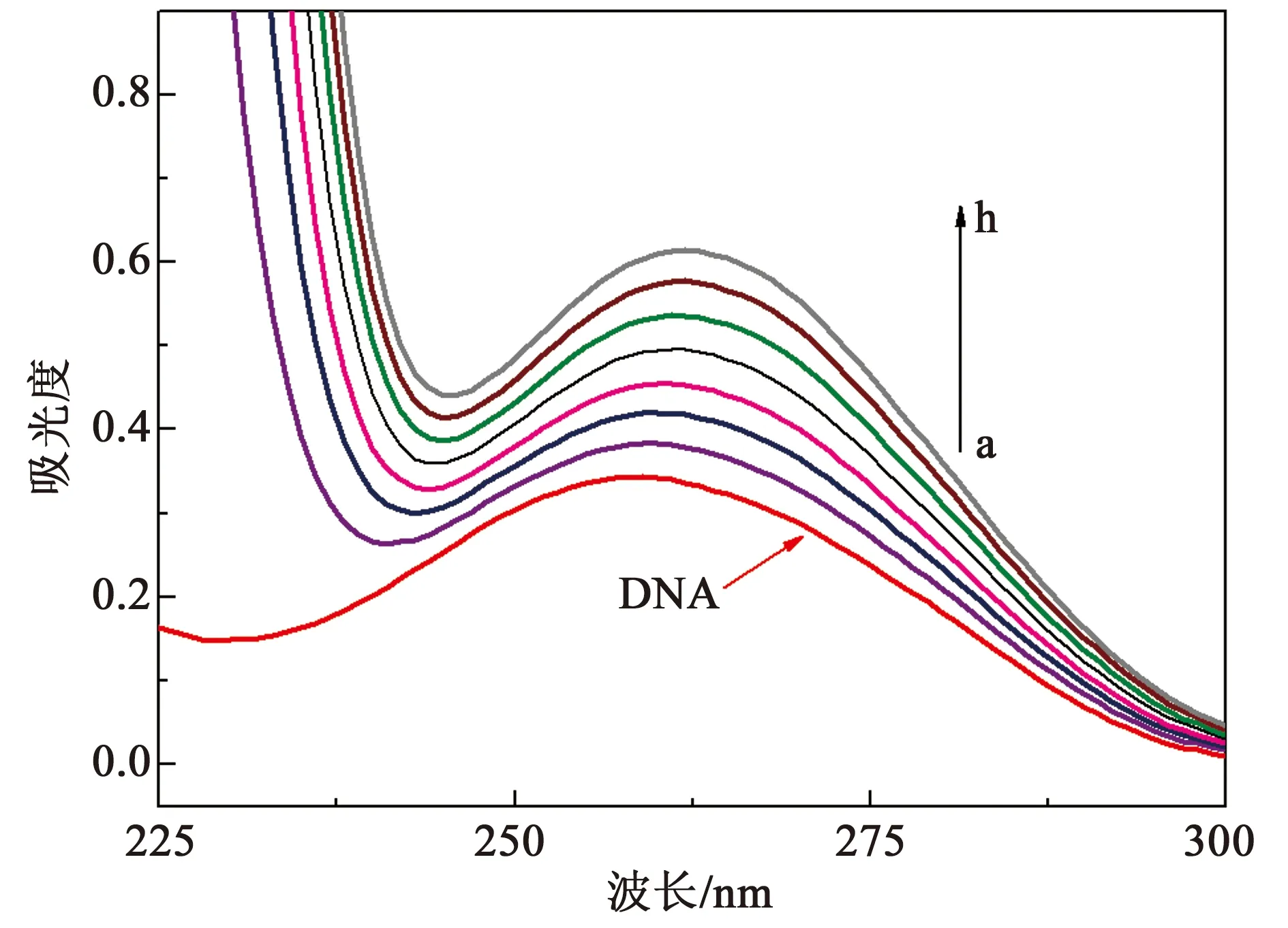
图4 DNA在不同浓度的化合物3存在下的紫外吸收光谱(pH=7.4,室温)
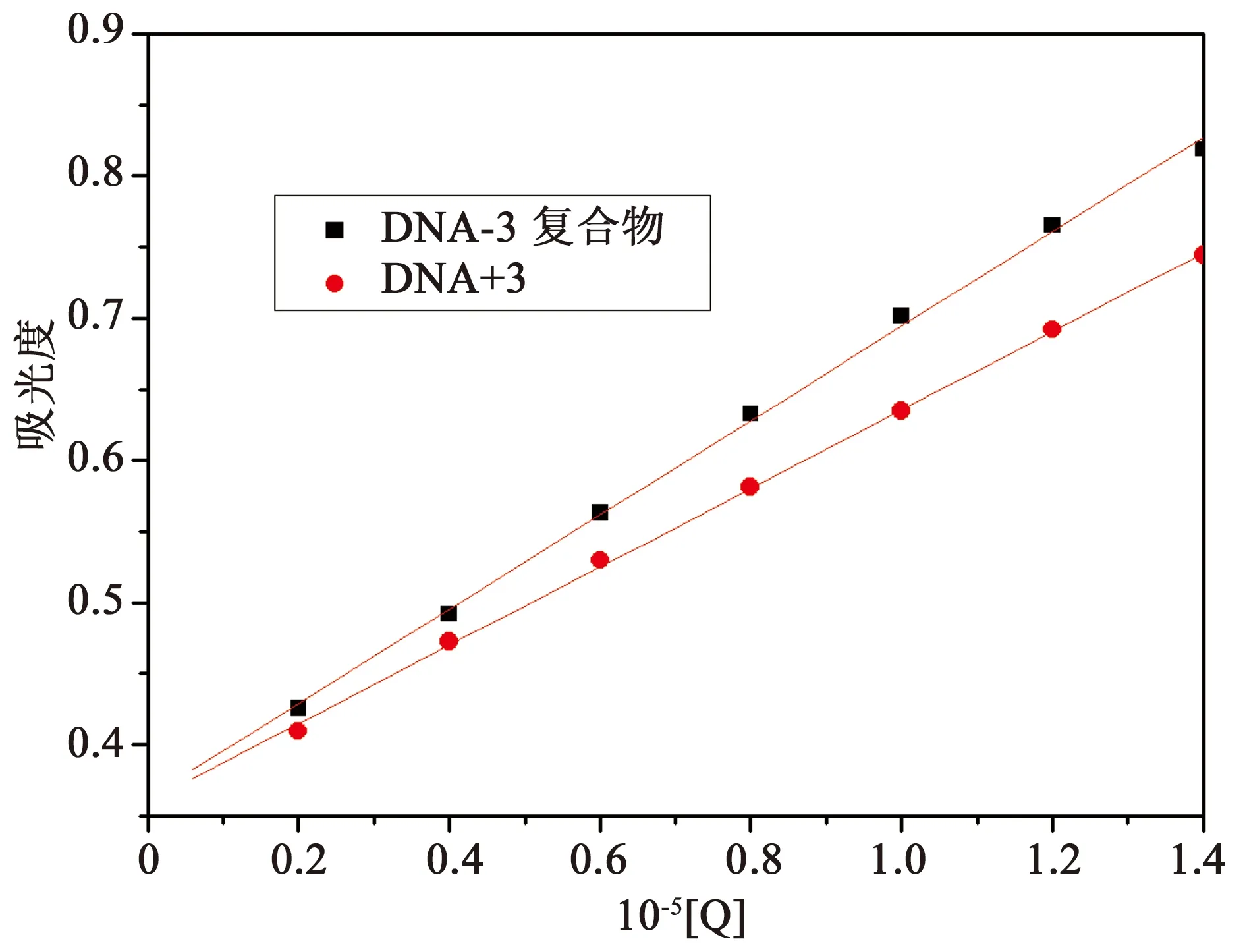
图5 260 nm处3-DNA复合物的吸光度以及游离的DNA与游离化合物3的吸光度之和
根据在化合物3存在下,DNA吸收光谱的变化,可用方程(1)分析计算DNA与化合物的结合常数K[15]。
(1)
A0和A分别代表没有和有化合物3存在下的DNA吸光度值,ξC和ξD-C表示化合物3和3-DNA体系的吸收系数,根据方程和吸收滴定拟合曲线图,可计算出相应的结合常数K=1.14×104L·mol-1,r=0.999,SD=0.08。
中性红(NR)可嵌插入DNA结构中,而且其本身毒性很低,水溶液可长时间放置。因此,选用中性红作为光谱探针研究化合物3与DNA的相互作用模式。图6显示了NR染料在DNA加入过程中的吸收光谱变化。结果表明,随着DNA浓度的增加,NR在460 nm附近的吸收峰逐渐减小,而在530 nm处出现一个新的吸收峰,这归因于新的DNA-NR复合物的形成,在504 nm处的等色点为DNA-NR复合物的形成提供了证据[16]。
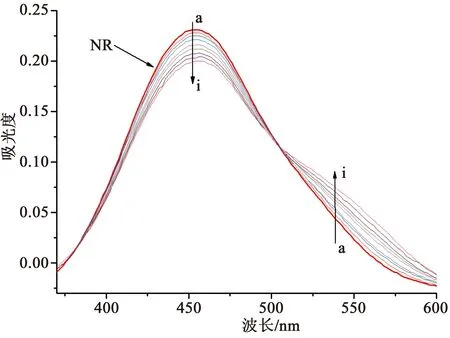
图6 中性红在不同浓度DNA下的紫外吸收光谱(pH=7.4,T=室温)
图7显示了中性红和化合物3与DNA竞争结合的吸收光谱。随着化合物3浓度的增加,最大吸收峰在530 nm的DNA-NR复合物的吸收下降,而在460 nm处的吸收略微增强,与随着DNA浓度增加时游离NR在460 nm左右的吸收相比(见图6),图7中的吸收光谱显示出相反的过程。因此,化合物3可能插入到DNA的双螺旋结构,代替NR,与DNA发生络合,形成化合物3-DNA复合物。
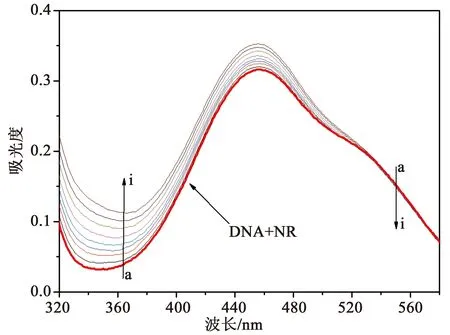
图7 DNA在中性红与化合物3竞争下的紫外吸收光谱
3 结论
本实验使用5-氨基四唑1和4-乙酰氨基苯磺酰氯2反应得到四唑开环化合物3,其结构经X-射线单晶衍射证实。结果表明,5-氨基四唑断键开环生成叠氮化物3含有一个结晶水分子,属于P-1空间群,晶胞参数a=7.555 4(5)Å,b=8.816 3(4)Å,c=11.051 6(7)Å,=75.46 3(5),=89.813(5),=69.166(6)。化合物通过氧原子、氮原子和氢原子形成氢键,进而形成三维超分子结构。抗微生物活性测试结果显示,所合成的化合物对所测试的细菌和真菌显示了较弱到中等(MIC=64~256 μg·mL-1)的抑制活性,与参考药物氟康唑相比,化合物对耐氟康唑的黄曲霉菌的抑制活性强于氟康唑(MIC=256 μg·mL-1)。此外,将化合物3与参考药物联用后,所有联用体系的FIC指数均小于1,抗微生物能力明显增强,减少了用药剂量,拓宽了抗微生物谱,显示较好的协同作用效果。因此,有望通过化合物与临床药物的联用,改善其因用药剂量大而导致的毒性和耐药性等问题。紫外-可见光谱法显示,化合物3与小牛胸腺DNA共存时其吸光度值小于单独存在时的吸光度之和,所以化合物3可能通过嵌入的方式与DNA形成复合物,进而发挥抗微生物作用。

