反刍动物亚急性瘤胃酸中毒的易感性因素及生物标记物研究进展
张智安,牛骁麟,李 飞,李发弟,2
(1. 草地农业生态系统国家重点实验室 / 兰州大学农业农村部草牧业创新重点实验室 / 兰州大学草地农业科技学院,甘肃 兰州 730030;2. 甘肃省肉羊繁育生物技术工程实验室,甘肃 民勤 733300)
SARA (subacute ruminal acidosis)是由于反刍动物采食过量易发酵碳水化合物后瘤胃内产生大量挥发性脂肪酸,过量酸不能及时被吸收或中和,导致瘤胃pH维持在5.2~5.8并超过3 h而引起的一种营养代谢性疾病[1]。随着现代集约化生产发展,增加日粮谷物及易发酵碳水化合物的比例是提高反刍动物生产效率的重要手段,该方法在满足反刍动物能量需求的同时亦增加其患SARA等营养代谢疾病的风险。该疾病对动物瘤胃健康、利用年限及经济效益造成巨大负面影响。据报道,北美地区每年因SARA最多可损失约10亿美元,我国众多农场也深受其害[2-4]。研究表明,SARA会导致机体干物质采食量(dry matter intake, DMI)、乳脂及乳蛋白含量等显著降低(P < 0.05)[5],并增加肝脓肿、腹泻、蹄叶炎等营养代谢疾病的患病机率[6-8]。该疾病具有隐蔽性,在群体养殖中不易被发觉[9],对动物饲养管理造成一定难度。沈泰钰[10]研究发现,患SARA奶牛首次发情天数、产犊间隔、初配天数等指标均显著高于健康奶牛(P < 0.01),且DMI减少,患瘤胃炎-肝脓肿-蹄叶炎综合征的风险大幅增加。即使遗传背景一致、饲养管理方式相同的反刍动物(奶牛、肉牛及绵羊)在饲喂相同日粮后,其个体对SARA的易感性仍存在明显差异[11],该差异会对反刍动物生产性能和瘤胃健康产生不同影响(表1)。因此,有必要寻找能衡量SARA易感性的标志物。但目前关于筛选和衡量SARA风险与易感性的生物标志物研究报道较少,相关数据还不完善[12,15],需要进一步的研究。
1 反刍动物SARA易感性差异及其影响因素
饲养管理条件一致,饲喂相同日粮的肉牛[17]、绵羊[18]及奶牛[19],其个体间瘤胃pH、患SARA的风险却存在明显差异[20-21]。Khiaosa-ard等[16]以18头西门塔尔牛为研究对象,饲喂精粗比为60∶40的日粮,持续监测瘤胃动态pH变化5周,结果表明,与耐受组奶牛相比,易感组瘤胃pH < 6.0持续时间显著增加(P < 0.01)。Gao等[12]给16头荷斯坦奶牛饲喂精粗比为65∶35的日粮,结果发现奶牛最低pH差异较大,范围为5.16~6.04;酸中毒指数也存在较大差异,范围为0.0~10.9。目前关于SARA的定义主要基于瘤胃pH,而瘤胃pH主要通过瘤胃中酸的产生和移除共同作用来确定,瘤胃中酸的移除途径主要有唾液中和(咀嚼)、流向后肠道的速率(挑食)、瘤胃上皮细胞吸收(吸收功能)等[22-23]。大量研究表明,SARA的发生与动物咀嚼行为、挑食行为及瘤胃上皮吸收功能等息息相关,与SARA高风险动物相比,采食同一日粮后,低风险动物机体唾液分泌量更多、饲料产酸潜力较小、瘤胃酸移除速率更快[14,18,24-25],其主要机制如图1所示。
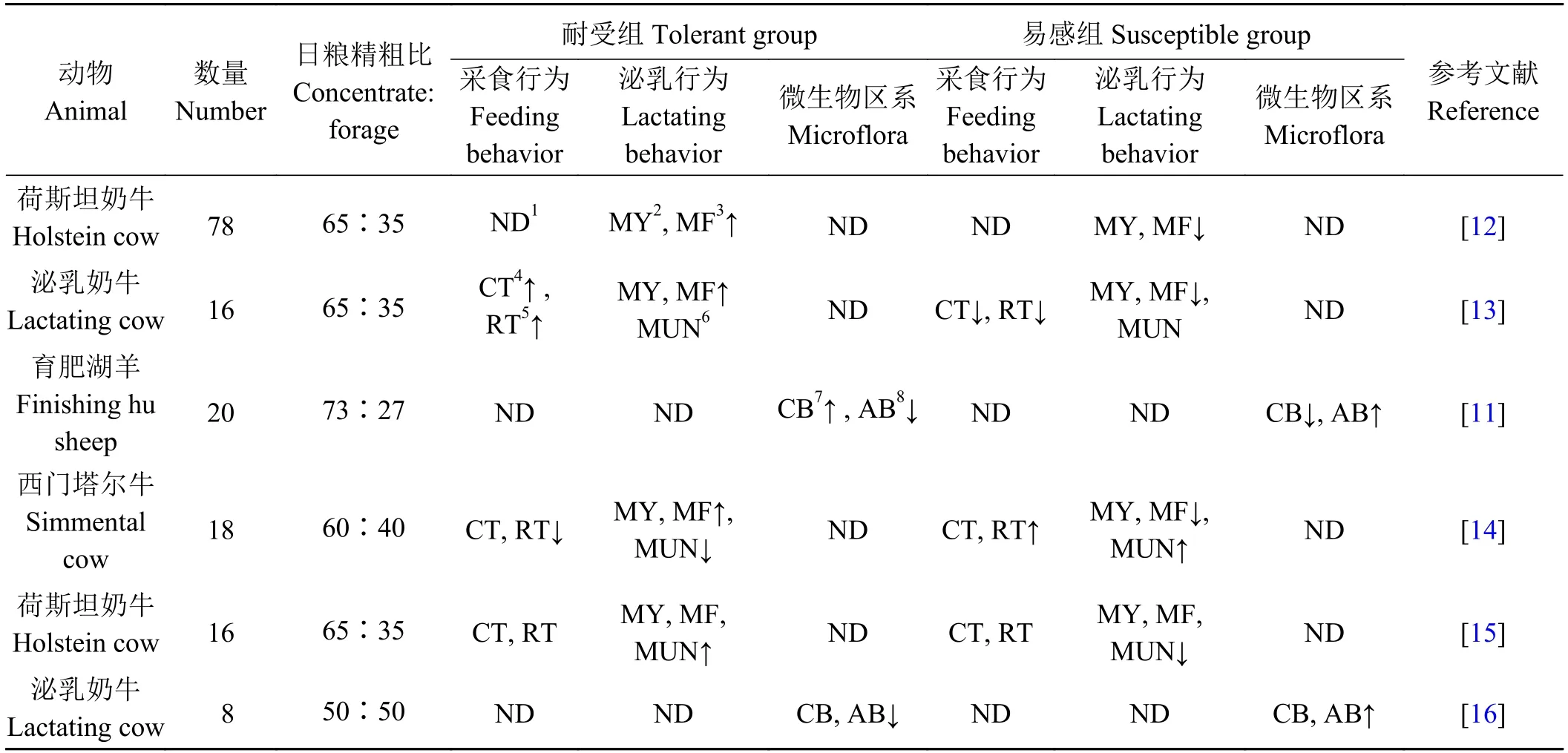
表 1 SARA易感性差异对反刍动物采食行为、泌乳行为和微生物区系的影响Table 1 Effect of SARA susceptibility differences on feeding behavior, lactation behavior, and microflora of ruminants
1.1 咀嚼行为
咀嚼行为与SARA密切相关[14],咀嚼可以促进动物机体分泌唾液,唾液分泌量是阐释酸中毒发生差异的关键因素[16,26]。研究发现,唾液中含有碳酸氢盐和磷酸盐,能有效中和反刍动物因采食易发酵日粮后瘤胃中产生的大量有机酸,约37%的质子可以通过唾液中和[23]。这表明咀嚼行为能影响动物患SARA的风险。Khiaosa-ard等[16]选用西门塔尔育肥肉牛为研究对象,饲喂精粗比为60∶40的日粮,结果表明易感组奶牛采食每千克日粮所用的咀嚼时间 (50.5 min·kg-1)比耐受组更长 (39.5 min·kg-1)。同时,在Gao等[12]的研究中给奶牛饲喂65%精料和35%粗饲料的日粮,研究表明,耐受组奶牛总咀嚼时间为768 min·d-1,而易感组奶牛总咀嚼时间为830 min·d-1。奶牛对瘤胃pH的降低具有适应性反应,SARA易感性奶牛瘤胃内pH较低,此时奶牛会通过增加咀嚼时间来增加唾液分泌或增加来自瘤胃的微粒和液体运动来缓解瘤胃pH的降低[27-29]。通常情况下,瘤胃pH保持在正常生理范围内,如果摄入过量易发酵碳水化合物,大量挥发性脂肪酸(VFA)及乳酸在瘤胃聚集,机体的调节能力无法再有效维持瘤胃pH平衡,增加SARA的患病风险[30]。
1.2 挑食行为
反刍动物饲养管理过程中,由于动物对日粮成分的喜食程度不同,从而导致机体产生挑食行为。对TMR的过度挑食会增加易发酵碳水化合物过量摄入而减少物理有效中性洗涤纤维(peNDF)摄入,导致瘤胃中VFA大量产生并累积,同时咀嚼行为减少,不能及时中和瘤胃中产生的过多有机酸,增加动物患SARA的风险[31]。Devries等[32]发现,当奶牛泌乳早期饲喂精粗比为55∶45日粮时,它们的挑食行为与瘤胃pH有关:奶牛挑食中等和短粒径饲料越多,其最高、最低和平均瘤胃pH就越小。还有研究发现,SARA耐受型和易感型奶牛都喜食中、短粒径饲料,但易感奶牛挑食程度更严重(挑食指数 = 105 vs. 102; P = 0.05)。此外,易感奶牛有拒绝采食长粒径饲料的行为,而耐受奶牛没有这一行为 (挑食指数 = 87.6 vs. 97.9; P = 0.05)[13]。先前大量研究表明,即使饲喂全混合日粮,动物也会选择性地采食喜爱的日粮成分[33-35],当瘤胃pH较低时,动物通常会通过采食一定长粒径饲料来满足其对peNDF的需求[36-37]。过度挑食中、短粒径饲料会增加动物对易发酵碳水化合物的摄入,减少peNDF的采食,急剧增加瘤胃中酸的产生[37],从而提高患SARA的风险。以上研究表明,挑食行为是导致SARA变异性的因素之一。
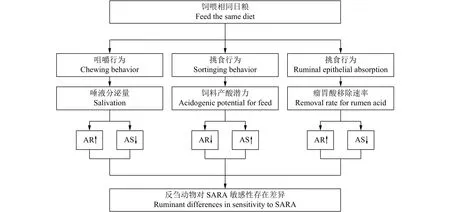
图 1 同一日粮条件下引发SARA敏感性差异的因素及其主要途径[13, 23-25]Figure 1 Factors causing differences in SARA sensitivity and main pathways under the same diet conditions[13, 23-25]AR: 代表耐受型动物;AS: 代表易感型动物;↑表示显著增加;↓表示显著降低。AR: tolerant animal; AS: susceptible animal; ↑: increase significantly; ↓ : decrease significantly.
1.3 瘤胃上皮吸收功能
瘤胃是反刍动物前胃系统中最大的组成部分,瘤胃产生的有机酸能够为机体提供65%~75%能量[19],而瘤胃中产生的中短链脂肪酸主要通过瘤胃上皮吸收来移除[38],可以移除瘤胃中约53%的有机酸[23]。因此,瘤胃上皮的吸收能力对维持瘤胃内环境的稳定至关重要。瘤胃上皮为多层鳞片状结构[39],从黏膜层到浆膜层依次为颗粒层、角质层、基底层和棘突层。研究表明,SARA会导致动物瘤胃上皮角质化不全,细胞间紧密连接程度降低,细胞间通透性增加,在瘤胃内产生大量内毒素,对机体造成炎症反应,最终影响动物生产性能[40-41]。尽管管理条件及饲喂日粮组成都保持相同,但不同SARA易感性动物瘤胃上皮对VFA的吸收能力却存在很大差异[18]。Gregory等[18]通过给成年绵羊灌注葡萄糖诱导SARA,结果发现耐受组与易感组绵羊相比,前者吸收乙酸和丁酸更多,其他VFA含量之间变化很小,总VFA含量耐受组数值上要低于耐受组,说明耐受组对VFA有着更强的吸收能力。另外有研究表明,瘤胃pH的下降常常会伴随着瘤胃上皮一些相关基因的改变[42-43],如瘤胃上皮炎症、H+转运、VFA吸收及代谢相关基因会随着pH的改变而发生相应的变化。张瑞阳等[44]通过体外发酵技术,以装有瘤胃瘘管的荷斯坦奶牛(n =4)为研究对象,对动物进行间歇性SARA诱导试验,结果表明,饲喂高精料日粮奶牛的瘤胃乳头中炎症相关基因(IL-1β,IL-2,IL-6和IL-8)的mRNA表达更高。Yan等[45]增加山羊饲喂精料的比例(10%vs. 35%),结果发现随着日粮精料的增加,氢离子转运载体(DRA、PAT1及AE2)、Na+/H+交换载体(NHE1、NHE2及NHE3)及一元羧酸转运载体(MCT1和MCT4)的mRNA表达量升高,有助于瘤胃酸的移除和VFA的吸收。以上研究表明,瘤胃上皮对瘤胃酸吸收功能的强弱会影响动物患SARA风险大小。但目前关于不同SARA易感性反刍动物之间H+转移及VFA吸收相关基因表达差异的研究鲜有报道,在瘤胃上皮中的表达位置尚不明确,各基因表达产物是否存在转运特异性等[46],因此关于反刍动物瘤胃上皮吸收功能需要更进一步的研究。
2 SARA标志物研究进展
2.1 脂多糖
动物采食过量可发酵碳水化合物后使瘤胃内pH急剧下降,瘤胃微生物区系发生明显改变,纤维素分解菌对pH较敏感,随着瘤胃pH的降低纤维素分解菌数量下降,大量革兰氏阴性菌死亡崩解,内毒素被释放出来导致瘤胃中以游离脂多糖(LPS)为主的内毒素物质含量增加[47-50]。Khafipour等[51]用紫花苜蓿(Medicago sativa)颗粒饲料对8头泌乳期荷斯坦奶牛进行6周SARA诱导试验,结果显示瘤胃内游离LPS浓度从第1周的42 122 EU·mL-1增加至第 6周的 145 593 EU·mL-1,这表明 SARA与LPS之间存在密切的联系,随着诱导时间的增加瘤胃内游离LPS含量增加。Stefanska等[52]以13个牧场共305头高产奶牛为研究对象,探究SARA对奶牛瘤胃中游离LPS的影响,结果发现与正常奶牛群相比,患SARA奶牛群瘤胃游离LPS浓度较高(43 000 EU·mL-1vs. 32 225 EU·mL-1)。该结果与Gozho等[53]研究结果相一致。此外,由于患SARA动物个体瘤胃内毒素含量较高,会引发黏膜发炎、损伤,瘤胃上皮通透性增加,致使血液中毒素可能也会增加[54-55]。综上大量研究表明,反刍动物过量采食易发酵日粮导致有机酸聚集,引起反刍动物瘤胃内微生物群落的改变,纤维分解菌在较低pH情况下大量死亡并释放出LPS,增加动物患SARA的风险,这表明瘤胃中游离LPS的含量可以反映瘤胃中微生物区系的状况及动物患SARA风险大小。
2.2 奇数碳和支链脂肪酸
奇数碳和支链脂肪酸(odd-and branched-chain fatty acids, OBCFA) 主要来源于脱离瘤胃细菌的膜脂质,其内源合成量十分有限,主要存在于反刍动物乳脂和脂肪组织中[56]。不同瘤胃细菌OBCFA组成不同,当动物患SARA时瘤胃微生物区系发生改变,造成瘤胃细菌OBCFA以及乳中OBCFA含量不同,可以将其用于瘤胃微生物种群组成、变化及其代谢产物的评估,同时可以作为判别反刍动物患SARA风险大小的标志物[56-57]。瘤胃的纤维分解菌(cellulolytic bacteria)富含奇数异构脂肪酸,淀粉分解菌支链脂肪酸含量较少,但直链奇数碳脂肪酸或者反式异构脂肪酸含量较高。研究发现,在瘤胃液中不同细菌的种群数量与OBCFA含量的相互关系是有差异的[58]。在刘可园[59]的研究中发现瘤胃十五烷酸(C15∶0)和总奇数碳脂肪酸与用于分析的各种细菌都存在相关关系,瘤胃C15∶0的含量与产琥珀酸丝状杆菌(Fibrobacter succinogenes)和白色瘤胃球菌(Ruminococcus albus)种群数量负相关,却与牛链球菌(Streptococcus bovis)的种群数量正相关,这说明瘤胃C15∶0和总奇数脂肪酸可以作为瘤胃细菌种群的一种标记物。此外,瘤胃异构脂肪酸与纤维分解菌的种群数量呈正相关,与淀粉分解菌的种群数量呈负相关,这说明瘤胃异构脂肪酸的含量也具有预测瘤胃细菌数量的潜力[59-61]。Colman等[62]用富含小麦(Triticum aestivum)的高谷物日粮对奶牛进行5周的SARA诱导试验,在第6周发现奶牛乳脂中OBCFA与动物患病前变化很大。在第4周奶牛乳脂中C15∶0和C17∶0含量开始升高,第5周异构十四烷酸(iso C14∶0)含量显著降低 (P < 0.05),反式油酸 (C18∶1trans-10)含量显著升高(P < 0.05)。因此,可以将C18∶1trans-10、C15:0和C17:0作为瘤胃酸中毒的标记物。
2.3 瘤胃相关微生物数量
瘤胃中纤维分解菌对pH敏感,随着奶牛日粮精料比例增加,瘤胃中相应微生物构成、密度及多样性都会发生变化[63-65],因此推测可以利用瘤胃中主要纤维分解菌含量来判断发生SARA风险的大小。有研究表明,瘤胃内pH < 6.0时间超过330 min·d-1,纤维分解菌的增殖会受到抑制[66-67]。Nagaraja等[54]也发现,瘤胃中主要纤维分解菌,包括白色瘤胃球菌和黄化瘤胃球菌(Ruminococcus flavefaciens),产琥珀酸死状杆菌和溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)对低瘤胃pH环境是比较敏感的。Plaizier等[68]发现随着动物日粮精料比例的增加,瘤胃pH降低,同时白色瘤胃球菌、黄化瘤胃球菌、产琥珀酸死状杆菌和溶纤维丁酸弧菌的含量明显减少,这说明瘤胃pH降低会使主要纤维分解菌含量减少,相反也可以通过瘤胃中pH敏感细菌含量的变化来反映瘤胃中动态pH状况。Li等[15]通过给湖羊公羔饲喂相同日粮发现,瘤胃pH、VFA及纤维分解菌之间存在明显差异,与亚急性瘤胃酸中毒低风险组(LSR)相比,亚急性瘤胃酸中毒高风险(HSR)的羔羊表现出较低的瘤胃pH(P = 0.013)和乙酸盐与丙酸盐的(乙丙比)比率(P =0.018),且具有较高的乳酸浓度(P = 0.035)和丙酸的比例(P = 0.033)。在LSR组中,羔羊瘤胃中拟杆菌、纤维杆菌和变形菌门的相对丰度高于HSR组(P < 0.05)。此外,高精料日粮诱导的SARA会导致瘤胃中淀粉分解菌含量增加[69-70]。在Fernando等[71]的研究中把高粗粮转换成高精料日粮后,与淀粉分解有关的反刍兽新月单胞菌(Selenomonas ruminantium)、牛链球菌(Streptococcus bovis)和普雷沃氏菌(Prevotella brevis)数量增加。还有研究表明,当反刍动物患SARA时瘤胃内乳酸产生菌和乳酸利用菌会增加,而原虫数量会相应减少[72]。动物对高谷物日粮敏感性的差异是一个值得关注的问题,因为在大规模养殖生产中动物日粮通常是针对群体动物配制,有可能导致易感型个体经历SARA,导致部分个体生产性能降低,而对其余个体无显著影响。因此,有必要找到简易判别反刍动物畜群SARA的标志物,以衡量动物个体患SARA风险大小,并对SARA进行早期预防,这对实现动物最大生产效率是极具重要意义的。
3 结论与展望
反刍动物饲喂同一高精料日粮,由于动物咀嚼行为、挑食行为及瘤胃上皮吸收能力的差异而导致个体患SARA的风险不同。动物采食过量易发酵碳水化合物会导致瘤胃内的细菌数量和OBCFA发生改变,瘤胃内主要纤维分解菌含量(如白色瘤胃球菌、黄化瘤胃球菌、产琥珀酸死状杆菌和溶纤维丁酸弧 菌)、淀粉分解菌和乳酸菌含量、内毒素及瘤胃中奇数碳和支链脂肪酸(包括C18∶1 trans-10、C15∶0和C17∶0)可作为判别动物患SARA风险大小的生物标志物。但目前关于判断SARA的生物标志物的研究还很少,且研究方法也不太成熟,对SARA生物标志物的研究还需要进一步探索。随着宏基因组学和代谢组学研究方法的不断成熟,可以考虑在以后SARA生物标志物的研究中引入这些技术,通过宏基因组学进一步探索反刍动物消化道中还未被发现的微生物,通过代谢组学以动物体内某些小分子代谢产物为研究对象,根据其发生的变化以及能对机体产生的影响来寻找能判别动物患SARA的生物标志物,这对进一步认知生物标志物具有重要的科学意义。

