误诊为肺炎的冠脉支架植入术后早期PCIS 1例
李 杰,王 昕,马 红
(青岛市市立医院保健与国际病房,青岛266000)
心脏损伤后综合征(Postcardiac injury syndrome,PCIS)是指心脏受到各种损伤后出现的以心包、胸膜和肺实质炎症为主要表现的一组综合征。绝大多数的病例都是发生在重要的心脏手术和心肌梗死后,并被称为心包切开术后综合征(PPS)和心肌梗死后综合征(PMIS)。虽然晚期的PCIS在心脏手术或心肌梗死后得到了良好的认识,但在心脏介入治疗后的早期PCIS病例却少有报道,因此比较容易延误诊断和治疗。现报道1例。
1 病例简介
患者,女,81岁,因“发作性胸闷、胸痛6年,加重5天”于2017年6月于当地医院就诊。既往高血压病史多年。入院行冠状动脉造影(CAG)显示冠状动脉多支病变且钙化严重,建议行冠状动脉搭桥术,患者拒绝。后就诊于我院,心脏超声示室间隔基底段厚、左室舒张功能减低(轻度)、主动脉瓣轻度钙化并返流(轻度)。2017年7月16日行经皮冠状动脉介入治疗(PCI),术中于右冠植入3枚支架,遗留回旋支病变未处理。术后给予双联抗血小板聚集、调脂、降压、改善心肌能量代谢等治疗,但患者仍有胸痛不适,于2017年8月7日第2次入院行PCI,处理回旋支。术前心脏超声基本同前,未见明显心包积液。
手术当日(2017年 8月 9日):12:40患者行PCI(时间:12:40),术中于回旋支植入 1 枚支架,支架贴壁良好,前向血流TIMI3级,未见造影剂外渗等异常情况。术后3 h患者感胸痛明显,呈持续性,与呼吸及体位变换有关,复查心电图(ECG)较前无明显变化。心脏超声(时间:17:45),左室节段运动异常,心包积液(少量),左室后壁心包腔内液性暗区深约2 cm。急查血常规、CRP、心肌酶、BNP无异常。胸部CT(图1)提示:双下肺野散在片絮影,考虑炎性病变可能大(术后新出现)。
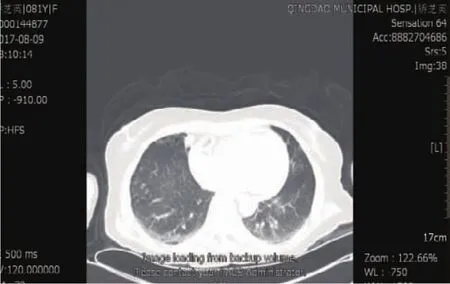
图1 胸部CT提示双下肺野散在片絮影
术后第1日(2017年8月10日):患者胸痛持续加重,以后背部及双侧颈部为主,与呼吸及体位变换有关。查体双侧颈静脉怒张。复查ECG、心肌酶无异常。冠状动脉CTA提示:胸主动脉粥样硬化。复查胸部CT示:双肺纤维片絮影,双下肺著,合并肺水肿不除外。心脏超声:心包积液(少量),舒张末深度:左室后壁6.6 mm,左室下壁8.8 mm,右房顶9.2 mm。下午患者体温升高(最高38.9℃),考虑肺炎可能性大,对症予吗啡止痛,并予静脉抗生素治疗。
术后第2日(2017年8月11日):患者胸背部疼痛减轻,无咳嗽、咳痰,体温仍偏高,出现声音嘶哑。血象(WBC:12.11×109/L,NEU%:72%)、CRP 均升高。ECG(图 2):I、II、aVF、V2-V6 导联 ST 段抬高0.1~0.2 mV,呈弓背向下型,aVR导联ST段压低0.15 mV,诊断急性心包炎。

图2 ECG(8.11):I、II、aVF、V2-V6 导联 ST 段抬高,呈弓背向下型,aVR导联ST段压低
术后第4日(2017年8月13日):心脏超声:心包积液(少量);舒张末深度:左室后壁5 mm,左室侧壁3 mm,右房顶8 mm,余同前。
术后第5日(2017年8月14日):胸腔超声:胸腔积液(双侧),右侧最大液深约1.2 cm,左侧最大液深约2.6 cm(术后新出现)。
后续几日患者逐渐出现喘憋、BNP升高,予利尿等对症治疗后症状缓解。复查ECG(图3)各导联ST段回落至基线。术后第12日复查心脏超声:心包积液(少量);舒张末深度:左室后壁4 mm,左室侧壁3 mm,右房顶3 mm。复查胸腔超声较前无明显变化。患者无胸痛、胸闷不适,病情稳定予出院。出院后1个月随访患者未再出现胸闷、胸痛症状,恢复良好。
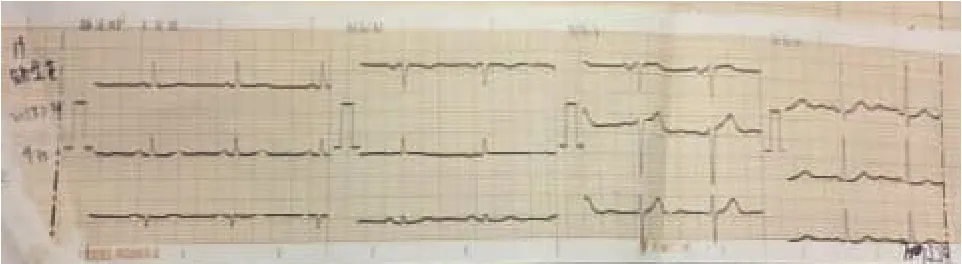
图3 ECG(8.21):各导联ST段基本恢复至基线
2 讨论
PCIS发病机制至今不明。较多的观点支持免疫反应可能在PCIS的发生发展中起重要作用。这种PCIS的自身免疫发病机制的理论受到心肌损伤后抗心肌细胞抗体水平升高的支持[1]。研究发现心脏损伤程度并非与PCIS的发生直接相关,这一点也支持免疫原性的发病机制[2]。另外,个体的易感性也与PCIS的发生有关[3]。还有一种假说认为[4]心脏损伤、心脏穿孔导致血液渗入心包间隙可导致PCIS的发生,因此介入术后的PCIS常继发于心脏穿孔后。但是,亦有报道PCIS可以发生在心脏无明显损伤的介入治疗后[5]。本例患者PCI术后当日便出现剧烈胸痛,术后PCIS的潜伏期较短似乎与免疫机制不相符,因为免疫反应通常需要2~3周的时间[6]。另外一种解释也可能是半月前第1次PCI后患者机体便处于一种高免疫反应状态,第2次手术触发了此免疫反应的发生,从而导致了第2次PCI术后早期PCIS的发生。
介入相关的PCIS起病时常伴随胸痛、呼吸困难、发热等症状,因此鉴别诊断需排除手术并发症,如血/气胸、肺部感染等,还需排除急性心肌梗死(acute myocardial infarction,AMI)、动脉夹层、肺栓塞等疾病。该病例中,患者的主要特点为持续剧烈的胸背部疼痛,且疼痛与呼吸及体位变换有关,发热,炎性指标升高,CT提示双肺散在片絮影,故极易误诊为肺炎合并胸膜炎。但随着病程的进展,新出现的广泛导联ST段弓背向下型抬高、aVR导联ST段压低;无剧烈咳嗽的情况下出现声音嘶哑;双侧颈静脉怒张等均符合急性心包炎的表现。同时患者氧饱和度、D-二聚体、冠脉CTA均无异常,故可基本排除血/气胸、动脉夹层、肺栓塞等疾病。
此外,患者胸痛后出现的广泛ST段抬高,还应与AMI相鉴别。AMI是冠状动脉急性完全闭塞,其供应区域心肌透壁性坏死,ECG变化常局限于定位导联。而急性心包炎存在广泛ST段弓背向下型抬高,其ST段移位多因炎症和心包渗液压迫心外膜心肌所致。该患者为冠脉血管多支病变,发生AMI的可能性极大。但CAG示支架贴壁好,无残余狭窄及内膜撕裂,且术后多次复查心肌酶均无异常,故可排除AMI。
PCIS目前无特殊治疗方法。症状轻微者,仅需一般对症处理。对于有心包积液和胸腔积液者,口服皮质类固醇激素有良好的治疗效果。该患者在未应用激素的情况下心包积液量明显减少,但胸水却无明显改善,心包和胸膜损伤之间的关系并不清楚。
目前随着心脏介入手术的日益增多,PCIS的出现也必将会随之增加,相关医务人员应充分掌握PCIS作为冠脉介入手术的少见并发症,有利于及早诊断及对症处理。

