总固体浓度对猪粪厌氧消化的影响及菌群结构分析
王乐乐 郑讯涛 张寓涵 刘晗晓 潘云霞
摘要:厌氧发酵是解决畜禽粪污染的重要途径。为降低猪粪对环境的污染,研究总固体(total solid,简称TS)浓度对固液分离后的猪粪厌氧消化性能的影响,并对适宜TS浓度猪粪发酵液的微生物菌群结构进行分析。结果表明,固液分离后的猪粪在TS浓度为7%、10%、13%、16%的湿发酵、半干发酵和干发酵中,挥发性脂肪酸(volatile fatty acid,简称VFAs)以乙酸和丙酸为主,并有少量丁酸和微量的甲酸。TS浓度为13%的猪粪,乙酸平均含量占VFAs平均含量的比例最高,达35.14%,累积TS产气量和日均产气量分别为 370.90 mL/g 和3.02 mL/g,高于其他各组。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)是TS浓度为13%的猪粪厌氧发酵优势细菌菌群,它们的相对丰度分别为29.5%、28.9%和25.5%;甲烷球菌目(Methanosarcinales)、甲烷鬃菌科(Methanosaetaceae)和甲烷丝菌属(Methanothrix)为它的优势古菌菌群。
关键词:TS浓度;猪粪;厌氧消化;甲烷;菌群结构
中图分类号: S216.4 文献标志码: A 文章编号:1002-1302(2019)05-0244-05
收稿日期:2018-01-02
基金项目:国家自然科学基金(编号:51306155);重庆市社会民生科技创新专项(编号:cstc2016shmszx80114);中央高校基本科研业务费重点项目(编号:XDJK2017B059)。
作者简介:王乐乐(1993—),男,甘肃平凉人,硕士研究生,主要从事可再生能源的开发和利用研究。E-mail:1628481822@qq.com。
通信作者:潘云霞,博士,副教授,主要从事有机废弃物资源化和能源化利用、水污染控制等领域的研究。Email:panyunxia1@163.com。
生猪养殖在畜牧产业中占有重要地位。在生猪养殖过程中会产生大量猪粪,如果不及时有效地处理,会造成严重的环境污染[1]。利用猪粪中丰富的有机物进行厌氧消化,可在实现猪粪减量化的同时生产沼气,是一种生态环保的粪污处理与再利用技术。猪粪中的高浓度氨氮对厌氧微生物有抑制作用,易导致厌氧消化启动困难[2],消除氨抑制是实现猪粪厌氧消化顺利进行的关键。为此,本研究利用氨氮多溶于猪粪粪尿的特点,采用固液分离的猪粪固体进行厌氧消化,液体单独处理,以期减小猪粪初始高浓度氨氮对厌氧消化的抑制作用。
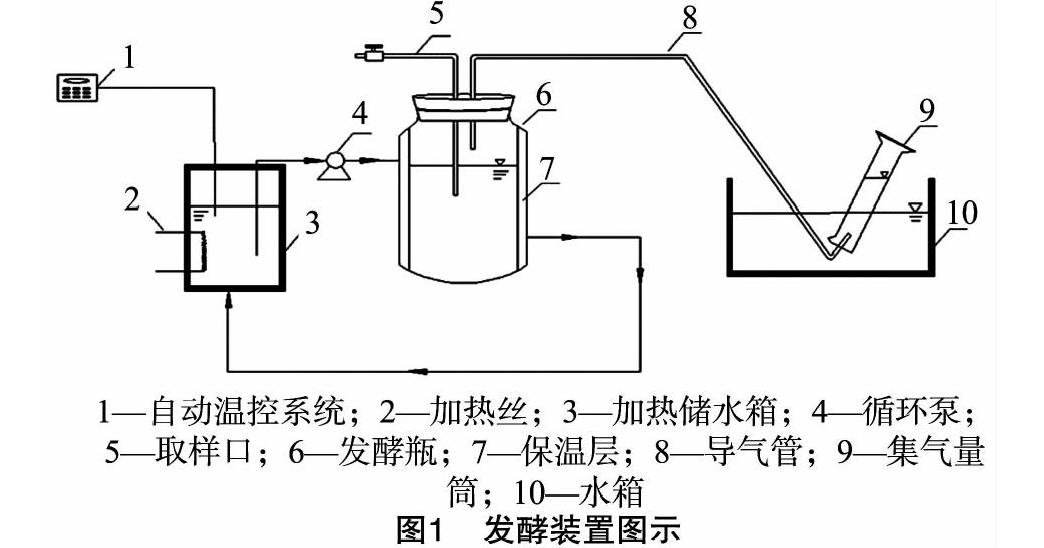
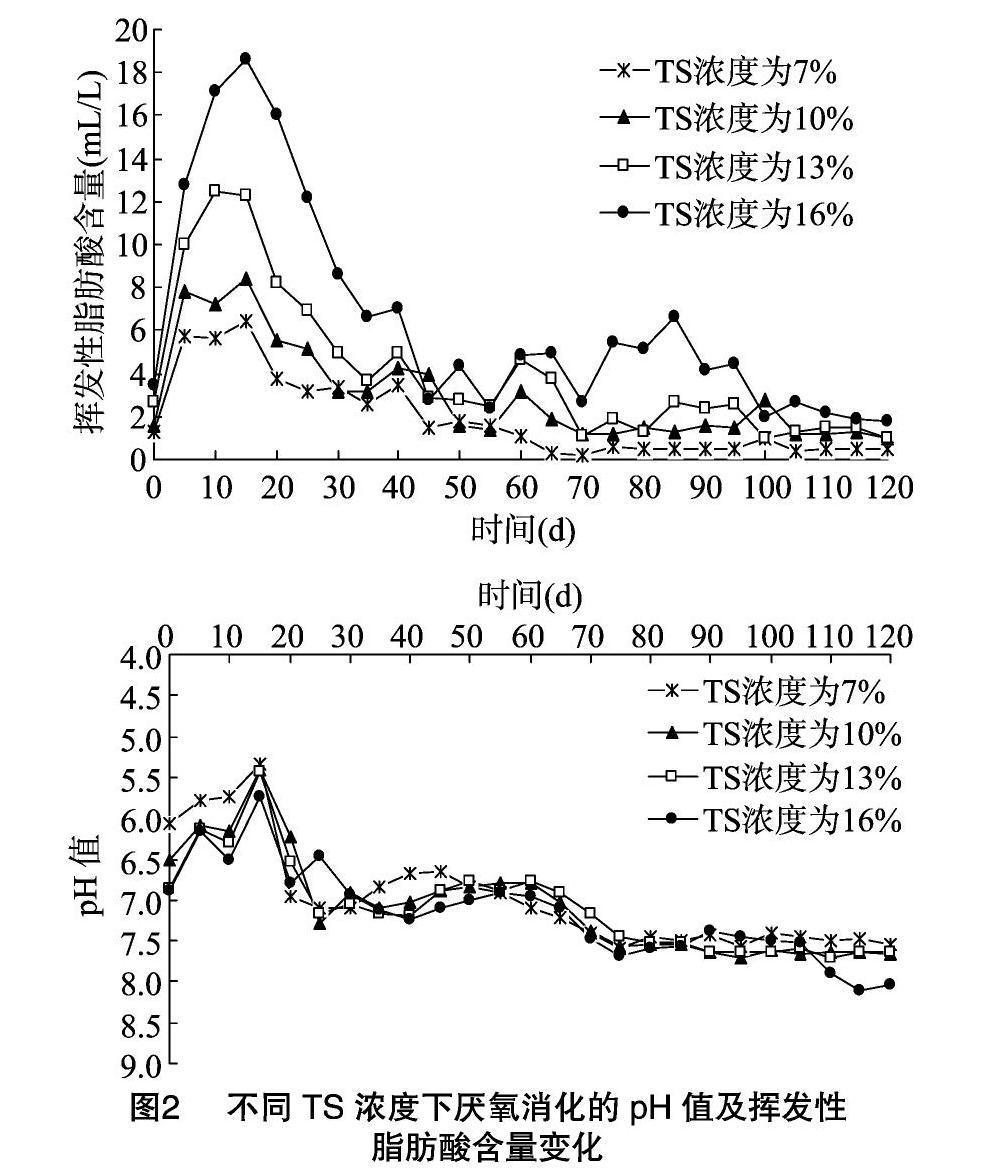
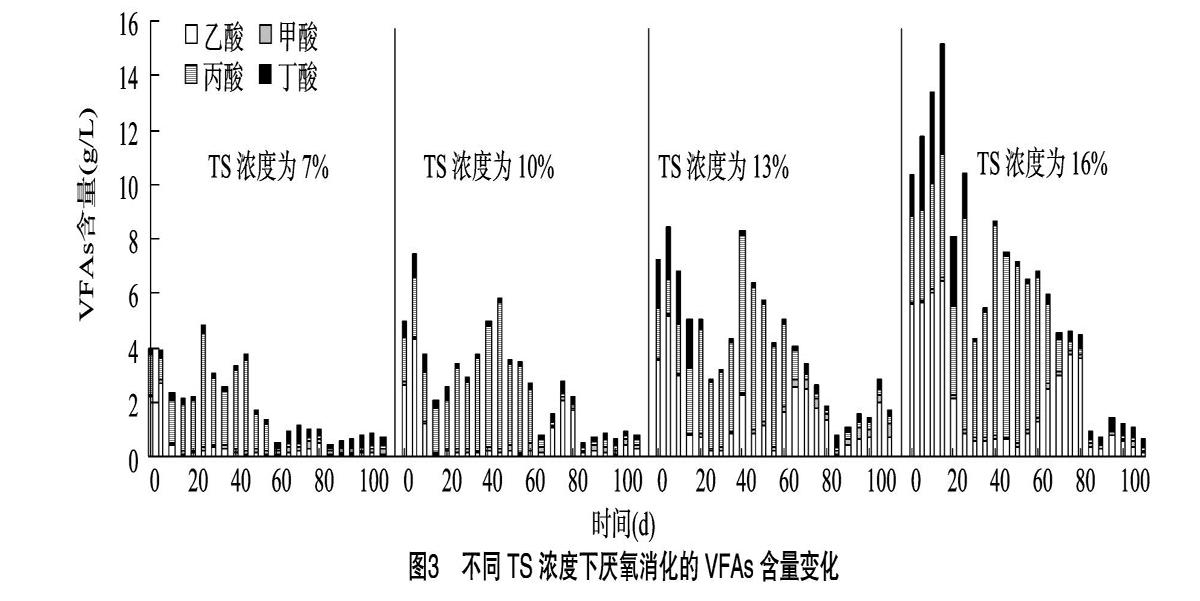
厌氧消化中物料的流变特性对微生物的传质以及沼气的生产起到重要作用,流变特性和总固体(total solid,简称TS)浓度相关[3],研究人员根据TS浓度不同,将厌氧消化分为3种类型,即湿发酵(TS浓度≤10%)、半干发酵(10% 1 材料与方法 1.1 试验装置 试验装置由笔者所在实验室自行设计(图1)。发酵罐容积为 2 500 mL,装液量为1 200 mL,顶部设有出气口及取样口,发酵罐温度通过外部水箱水加热后泵送到发酵罐夹层保持,保持恒温(35±1) ℃,集气袋收集气体,排水法测定产气量。 1.2 试验材料 试验用猪粪取自重庆市某生猪养殖场粪污,总固体浓度为25.79%,挥发性固体(volatile solid,简称VS)浓度为2344%,总有机碳(total organic carbon,简称TOC)含量为184.87 g/kg,总氮(total nitrogen,简称TN)含量为31.18 g/kg。接种沼液取自实验室发酵液,总固体浓度为9.85%,挥发性固体浓度为6.99%。 1.3 试验方法 试验于2017年3—6月在西南大学废弃物资源化利用实验室中进行。试验采用批次发酵,将猪粪TS浓度调节到7%、10%、13%和16%,加入200 g接种沼液,调节各组pH值为7.0。反应初始时,通入2 min氮气以保证厌氧环境。每日定时检测pH值、NH4+-N含量、VFAs含量及产气量,直至产气结束。 1.4 项目测定及方法 TS浓度用烘干法测定,VS浓度用马弗炉灼烧法测定;TOC含量的测定采用重铬酸钾-外加热法;TN含量采用凯氏定氮法测定[7];pH值用pH计(Sartorius-10型)测定;NH4+-N含量用纳式试剂光度法测定[8];甲酸、乙酸、丙酸、丁酸含量采用LC2010型高效液相色谱仪测定;总产气量采用排水法测定;甲烷含量采用GC9720型气相色谱仪进行分析测定;微生物优势细菌及古菌类群分析通过IIIumina MiSeq高通量测序,菌群16S rDNA的双V区(V3V4)PCR扩增引物信息为338F:ACTCCTACGGGAGGCAGCA,806R:GGACTACHVGGGTWTCTAAT。 2 结果与分析 2.1 TS浓度对猪粪厌氧消化过程的pH值和VFAs含量的影响 pH值是反映厌氧消化顺利进行的重要指标。本研究中湿发酵、半干发酵和干发酵3种类型的pH值均整体呈现先下降后升高的趋势(图2)。厌氧消化初期,各组pH值迅速下降,在15 d时降至最低值,为5.2左右;而挥发性脂肪酸含量在该时期整体增加,15 d左右达到峰值,随后VFAs含量逐渐降低,40 d后各组VFAs含量均降到7.0 mL/L及以下。推测这一时期猪粪中的有机物水解酸化产生大量VFAs且不能立即被产甲烷菌充分利用,进而造成VFAs积累。为避免酸化,在发酵后15 d,用NaOH对系统pH值进行调节(pH值为7)。发酵30 d后各发酵系统的pH值均稳定在6.5~8.1范圍内,且与VFAs总量的变化趋于一致。对于不同发酵类型,TS浓度对VAFs积累量的影响为TS16%>TS13%>TS10%>TS7%。 在3种类型发酵中,猪粪固体的厌氧消化整体以产乙酸和丙酸为主(图3),这同Fang等的研究结果[9]一致。当猪粪TS浓度由7%增加到13%时,乙酸平均含量在VFAs平均含量中的占比由19.58%增加到35.14%,但当TS浓度增加到16%时,乙酸平均含量在VFAs平均含量中的占比稍有降低(33.09%)。TS浓度为7%、10%、13%、16%条件下,丙酸平均含量在VFAs平均含量中的占比分别为59.47%、60.07%、47.67%、50.16%。在3种类型的猪粪厌氧消化中,丁酸含量较低,甲酸的含量极低,丙酸、丁酸含量均呈现先升高后降低 的变化趋势,而乙酸含量在5 d和80 d左右出现了2个高峰期。这是由于在厌氧消化初始阶段,猪粪中易降解有机物水解产生乙酸,所以出现第1个产乙酸的高峰;产甲烷微生物利用丙酸的速率低于利用乙酸和丁酸的速率[10],在发酵20~60 d 丙酸含量一直保持较高的水平,丙酸向乙酸的转化可通过产氢产乙酸途径和产甲酸产乙酸途径[11],图3中甲酸含量一直保持在极低水平,由此推测产乙酸过程可能是沿着产氢产乙酸途径进行的。由于丙酸的产氢产乙酸速率缓慢,所以60 d后,丙酸沿产氢产乙酸途径转化为乙酸后,丙酸含量降低,乙酸含量增加,出现第2个产乙酸高峰。TS浓度为13%和16%的猪粪,乙酸平均含量较7%和10%的发酵组分别提高了287.69%、449.94%和10838%、195.59%。厌氧消化中,大约有72%的甲烷来自于乙酸的转化[12],因此TS浓度为13%和16%的猪粪更有利于甲烷产量的提高。 2.2 不同TS浓度下猪粪厌氧消化的NH4+-N含量变化 NH4+-N既是微生物重要的氮源,也是影响厌氧消化过程稳定性的重要因素,过高的NH4+-N含量会对厌氧消化过程产生抑制作用[13]。由图4可知,NH4+-N含量随猪粪TS浓度的增加而增加,TS浓度为13%、16%的猪粪, NH4+-N 含量最高可达2 319.2、3 012.1 mg/L,明显高于其他组,由于NH4+-N是微生物可利用的氮源,2种TS浓度的猪粪,NH4+-N含量达到最大值后均开始波动下降,75 d后,NH4+-N含量分别稳定在1 500、2 000 mg/L左右。有研究表明,NH4+-N含量超过1 500 mg/L时,对厌氧消化产生抑制作用[14],但4种TS浓度的猪粪在厌氧消化中均没有产生氨抑制现象。 2.3 不同TS浓度下猪粪厌氧消化的产气特性 由图5可知,不同TS浓度的猪粪在厌氧消化20~35 d和60~80 d出现2次产气高峰,TS浓度为7%和16%的猪粪,在第1次产气高峰时,日产气量维持较高的水平,而TS浓度为13%的猪粪,在第2次产气高峰,日产气量明显高于其他各组。对整个发酵周期内各组的日产气量计算平均值得到,TS浓度为7%、10%、13%、16%的发酵组日平均产气量分别为2.43、2.41、3.02、2.78 mL/g。TS浓度为13%的发酵组日平均产气量最高,并且其日平均产气量较7%、10%、16%的发酵组提高了24.19%、26.23%、9.22%,累积TS产气量达到 370.90 mL/g,也远高于其他组(图6)。不同TS浓度的猪粪日甲烷产量均整体呈现先增加后降低的变化趋势。TS浓度为7%的猪粪日甲烷产量整体最低,TS浓度为13%的猪粪,厌氧消化80 d时甲烷产量达到峰值(395.85 mL/d),高于其他各组产甲烷峰值的含量;另外,通过图6发现,TS浓度为16%的猪粪在发酵后期依然保持较高的甲烷产量,这主要是因为干发酵中发酵液的黏度高,气-固-液传质过程受阻碍[15],虽然TS浓度为16%的猪粪在发酵后期依然保持较高的甲烷产量,但其厌氧消化迟滞期也较长。因此,从甲烷产量和经济性方面综合考虑,TS浓度为13%的半干发酵更有利于猪粪的发酵产气。为此,对发酵末期TS浓度为13%的猪粪发酵液进行菌群结构分析。 2.4 发酵液优势微生物类群分析 利用高通量测序技术对TS浓度为13%的猪粪发酵后期的细菌和古菌菌群进行分析,结果如图7所示。厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)类细菌为优势菌群,相对丰度分别达到29.5%、28.9%、25.5%和5.2%。其中厚壁菌门下的梭菌纲(Clostridia)及梭菌目(Clostridiales)类细菌在各分类单元中所占丰度分别达到27.7%和24.4%(图7-a)。厚壁菌门(Firmicutes)类细菌是降解纤维素、长链脂肪酸及其他有机物生成小分子物质的主要菌类[16-17],也是厌氧消化污泥、粪便、废水和餐厨垃圾等厌氧反应器中常见优势菌群,其門下的梭菌纲类细菌是具有较强纤维素降解能力的厌氧或兼性厌氧菌群,发酵系统中含有较多的梭菌能够促进和提升微生物对纤维素的降解速率[18]。拟杆菌门类细菌则是利用大分子碳水化合物进行降解产酸的主要菌群。本研究高通量测序结果表明,系统中的优势菌群(厚壁菌门和拟杆菌门细菌)在猪粪厌氧发酵水解、产酸过程中发挥着了重要的作用。这与Antwi等对废水厌氧发酵中的微生物群落结构分析结果[19]相一致。废水处理系统中参与丙酸型发酵的主要细菌是丙酸杆菌属(Propionibacterium)类[20]。本研究中,系统发酵产生较高含量的丙酸,但高通量测序结果中的丙酸杆菌目(Propionibacteriaceae)和丙酸杆菌属类细菌的相对丰度仅为0.2%和0.1%。这可能是菌群分析的样品来自发酵末期,参与丙酸型发酵的细菌已退为次要地位所致。 古菌是厌氧发酵产甲烷的重要类群。本研究对高通量测序结果中的古菌类群进行了分析,结果如图7-b所示。产甲烷相关的古菌类,如广古菌门(Euryarchaeota)中的甲烷微菌纲(Methanomicrobia)、热原体纲(Thermoplasmata)及甲烷杆菌 纲(Methanobacteria)所占丰度分别为29.6%、0.6%和0.5%。在目、科和属的分类水平上,甲烷球菌目(Methanosarcinales)、甲烷微菌目(Methanomicrobiales)和甲烷鬃菌科(Methanosaetaceae)及甲烷丝菌属(Methanothrix)、甲烷八叠球菌属(Methanosarcina)所占丰度分别达到20.8%、8.8%、17.2%及17.2%、3.6%。甲烷球菌可以H2、CO2和甲酸盐为底物产生CH4,甲烷鬃菌和甲烷微菌可利用H2或甲酸盐还原CO2生成CH4[21],甲烷丝菌利用乙酸为底物产生CH4和CO2,甲烷八叠球菌属可利用底物广泛,能以乙酸、甲醇、三甲胺和CO2等为底物形成CH4[22]。发酵系统中的甲烷球菌目(Methanosarcinales)、甲烷鬃菌科(Methanosaetaceae)和甲烷丝菌属(Methanothrix)为优势古菌菌群,它们能充分利用猪粪酸化水解产物产生CH4,这也是TS浓度为13%的猪粪厌氧发酵产生较高含量甲烷重要原因之一。 3 讨论 VFAs为产甲烷菌可利用的碳源,各有机酸的分布对厌氧发酵的顺利进行和产甲烷性能影响很大。本试验中,以猪粪固体进行厌氧消化,VFAs以乙酸和丙酸为主,并有少量丁酸和微量甲酸,这不同于赵杰红等对厨余垃圾的研究,赵杰红等在研究厨余垃圾厌氧消化水解酸化时发现,VFAs中以甲酸和乙酸为主,并有少量丙酸和丁酸产生,同时乳酸浓度一直较高[23];张波等对厨余废物进行厌氧消化发现,pH值为7时,VFAs以丁酸和乙酸为主,丙酸很少[24]。虽然本试验中丙酸浓度高,但系统并没有出现酸化现象,而且发酵后期,大量的丙酸向乙酸转化,这在TS浓度为16%的猪粪发酵中尤为明显。丙酸向乙酸的转化可通过产氢产乙酸途径和产甲酸产乙酸途径,试验中检测到极低的甲酸含量,推测丙酸向乙酸的转化可能是通过产氢产乙酸途径。pH值在5~7范围内时为丙酸型发酵,丙酸型发酵的主要细菌是丙酸杆菌属(Propionibacterium),但试验中丙酸杆菌属的相对丰度仅为 0.1%,这可能是发酵样品取自发酵末期,丙酸杆菌属菌群进入衰退期造成的。 4 结论 猪粪固体厌氧消化的湿发酵、半干发酵和干发酵都以产乙酸和丙酸为主,并有少量丁酸和微量的甲酸。TS浓度为13%的猪粪,乙酸平均含量占VFAs平均含量的比例最高,达35.14%,累积TS产气量和日均产气量分别为370.90 mL/g和 3.02 mL/g,高于其他各组。 TS浓度为13%的猪粪厌氧发酵液,优势细菌菌群为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),相对丰度分别为29.5%、28.9%和25.5%,甲烷球菌目(Methanosarcinales)、甲烷鬃菌科(Methanosaetaceae)和甲烷丝菌属(Methanothrix)为优势微生物古菌菌群。 参考文献: [1]周 晶,青 平. 规模化养殖对中国生猪粪便污染的影响研究[J]. 环境污染与防治,2017,39(8):920-924. [2]王 晋,李习伟,方新磊,等. 基于氨氮抑制效应的污泥厌氧产酸[J]. 环境工程学报,2017,11(5):3091-3098. [3]Liu Z Q,Lv J. The effect of total solids concentration and temperature on biogas production by anaerobic digestion[J]. Energy Sources,2016,38(23):3534-3541. [4]Abbassi-Guendouz A,Brockmann D,Trably E,et al. Total solids content drives high solid anaerobic digestion via mass transfer limitation[J]. Bioresource Technology,2012,111(3):55-61. [5]李志忠,姚兴泉,任海伟,等. 不同固体浓度青贮玉米秸秆与牛粪混合发酵产沼气性能研究[J]. 中国沼气,2017,35(1):29-34. [6]杜连柱,梁军锋,杨 鹏,等. 猪粪固体含量对厌氧消化产气性能影响及动力学分析[J]. 农业工程学报,2014,30(24):246-251. [7]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000:205-227. [8]封躍鹏,邱赫男,孙自杰. 纳氏试剂分光光度法测定水中氨氮研究进展[J]. 环境科学与技术,2016,39(增刊2):348-352. [9]Fang W,Zhang P Y,Gou X Y,et al. Volatile fatty acid production from spent mushroom compost:effect of total solid content[J]. International Biodeterioration & Biodegradation,2016,113:217-221. [10]侯宁宁. ASBR中挥发酸的产甲酸产乙酸发酵研究[D]. 福州:福州大学,2013. [11]Matsumoto M,Nishimura Y. Hydrogen production by fermentation using acetic acid and lactic acid[J]. Journal of Bioscience & Bioengineering,2007,103(3):236-241. [12]Li H L,Cao F F,Wang Y. The effect of different acetic acid accumulation on the methanogenic population and methane production in dry mesophilic anaerobic digestion[J]. Energy Sources,2016,38(12):1678-1684. [13]唐 波,李 蕾,何 琴,等. 总氨氮在餐厨垃圾厌氧消化系统中的积累及其抑制作用[J]. 环境科学学报,2016,36(1):210-216. [14]Ariunbaatar J,Perta E S D,Panico A,et al. Effect of ammoniacal nitrogen on one-stage and two-stage anaerobic digestion of food waste[J]. Waste Management,2015,38(1):388-398. [15]史宏偉,邹德勋,左剑恶,等. 梯度负荷下果蔬垃圾厌氧消化性能及微生物群落结构的研究[J]. 环境科学学报,2012,32(1):232-240. [16]Ye N F,Lü F,Shao L M,et al. Bacterial community dynamics and product distribution during pH -adjusted fermentation of vegetable wastes[J]. Journal of Applied Microbiology,2007,103(4):1055-1065. [17]张 蕾,梁军锋,崔文文,等. 规模化秸秆沼气发酵反应器中微生物群落特征[J]. 农业环境科学学报,2014,33(3):584-592. [18]Gao D W,Wang X L,Xing M. Dynamic variation of microbial metabolites and community involved in membrane fouling in A/O-MBR[J]. Journal of Membrane Science,2014,458(9):157-163. [19]Antwi P,Li J,Boadi P O,et al. Efficiency of an upflow anaerobic sludge blanket reactor treating potato starch processing wastewater and related process kinetics,functional microbial community and sludge morphology[J]. Bioresource Technology,2017,239:105-116. [20]Suwannakham S,Yang S T. Enhanced propionic acid fermentation by Propionibacterium acidipropionici mutant obtained by adaptation in a fibrous‐bed bioreactor[J]. Biotechnology & Bioengineering,2005,91(3):325-337. [21]Cho K,Shin S G,Kim W,et al. Microbial community shifts in a farm-scale anaerobic digester treating swine waste:correlations between bacteria communities associated with hydrogenotrophic methanogens and environmental conditions[J]. Science of the Total Environment,2017,601-602:167-176. [22]De V J,Hennebel T,Boon N,et al. Methanosarcina:the rediscovered methanogen for heavy duty biomethanation[J]. Bioresource Technology,2012,112(5):1-9. [23]赵杰红,张 波,蔡伟民. 温度对厨余垃圾两相厌氧消化中水解和酸化过程的影响[J]. 环境科学,2006,27(8):1682-1686. [24]张 波,史红钻,张丽丽,等. pH对厨余废物两相厌氧消化中水解和酸化过程的影响[J]. 环境科学学报,2005,25(5):665-669. 淡玄玄,李小敏. 改性亚麻对阳离子染料的吸附特性[J]. 江苏农业科学,2019,47(5):249-255.

