贝莱斯芽孢杆菌3A3-15电击转化条件优化
刘雪娇 贾田惠 高同国 郭晓军 李术娜
摘要:对贝莱斯芽孢杆菌电击转化条件进行优化,以期建立其高效转化体系。采用pIC333质粒电击转化贝莱斯芽孢杆菌3A3-15野生型菌株,考察细胞生长阶段、电压、电阻和质粒DNA加入量对转化效率的影响。当细胞培养物D600 nm为0.9,电压为1.75 kV,电阻为400 Ω,质粒DNA加入量为50 ng时,其转化率最高达7.92×104 CFU/μg。该研究为贝莱斯芽孢杆菌 3A3-15菌株的基因和分子水平操作奠定了基础。
关键词:贝莱斯芽孢杆菌;电击转化;pIC333;优化
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2019)05-0046-04
收稿日期:2017-12-15
基金项目:河北省自然科学基金(编号:C2015204031);河北省高等学校科学技术研究项目(编号:BJ2016029)。
作者简介:刘雪娇(1991—),女,河北廊坊人,硕士研究生,主要从事植物真菌病害及生物防治研究。E-mail:956760741@qq.com。
通信作者:高同国,博士,硕士生导师,主要从事植物真菌病害及生物防治研究。E-mail:gtgrxf@163.com。
贝莱斯芽孢杆菌(Bacillus velezensis)是一类重要的生防细菌[1],对大丽轮枝菌、灰葡萄孢菌、尖孢镰刀菌、疮痂链霉菌、立枯丝核菌等多种植物病原菌有明显抑菌作用[2]。随着现代分子生物技術的进步,利用基因工程手段对生防细菌改造以提高其生防效果成为当前研究的热点问题,但由于芽孢杆菌属于革兰氏阳性菌,其细胞壁厚而致密[3],其基因转化效率较低[4]。因此,建立并优化贝莱斯芽孢杆菌基因转化体系是对其进行分子操作的重要前提。
在大量的分子遗传研究方法中,转座子随机诱变技术因操作简便而备受关注,转座子及其衍生物作为插入突变原或分子标签已广泛应用于基因的分离和克隆中[5],特别是某些具有随机转化特性的转座子,已成为发现新基因、克隆功能基因、发掘已知基因的新功能以及研究蛋白功能的有效工具[6]。Tn10转座元件是目前在芽孢杆菌中应用广泛的转座子之一,已成功应用于芽孢杆菌突变体库的构建及基因功能的研究,mini-Tn10是目前应用比较成熟、广泛的Tn10转座子衍生物之一[7]。而转座质粒pIC333是针对芽孢杆菌构建出来的改良的mini-Tn10载体[8-9]。
目前外源基因导入宿主菌的主要手段有感受态法、原生质体转化法和电击转化法。其中,电击转化法由于操作简单、转化率相对较高而被广泛使用。该方法已在枯草芽孢杆菌、凝结芽孢杆菌、短芽孢杆菌等不同种芽孢杆菌上得到成功应用[10-12]。芽孢杆菌不同种属间,电转化条件对电转效率的影响较大,导致不同细菌电击转化效率不同。如细胞生长D600 nm值为0.7、pHY-P43质粒DNA加量为80 ng、恢复培养基山梨醇浓度为0.8 mol/L、电转缓冲液为SGM以及电场强度为21 kV/cm时枯草芽孢杆菌WB600转化率为8.0×106 CFU/μg [13],Tn5转座子导入短小芽孢杆菌DX01菌株时,当培养液D600 nm为0.96时,电压2.4 kV/cm,采用AEB电转缓冲液时电转效率最高587 CFU/μg[14]。目前电转化方法在枯草芽孢杆菌中研究较多,但很少有关于贝莱斯芽孢杆菌转化体系的研究。
前期工作中筛选得到1株对尖孢镰刀菌具有较强拮抗作用的贝莱斯芽孢杆菌3A3-15,为进一步开展其分子遗传学研究,对其影响电击效率的因素进行了摸索并对其电击转化体系进行了优化。
1 材料与方法
1.1 供试菌株、质粒及培养基 本试验于2016年12月在河北农业大学生命科学学院制药工程实验室进行。
贝莱斯芽孢杆菌3A3-15菌株为上述实验室分离、保存。
质粒pIC333由江苏师范大学刘伟杰老师提供,该质粒带有转座子mini-Tn 10,含有壮观霉素抗性基因、红霉素抗性基因和ColE1复制起点。
LB培养基(1 L):胰蛋白胨10 g,酵母提取物5 g,NaCl 5 g,pH 值为7.2~7.5。
生长培养基:LB+0.5 mol/L山梨醇。
复苏培养基:LB+0.5 mol/L山梨醇+0.38 mol/L甘露醇。
电击缓冲液:0.5 mol/L山梨醇+0.5 mol/L甘露醇+10%甘油。
1.2 贝莱斯芽孢杆菌3A3-15生长曲线
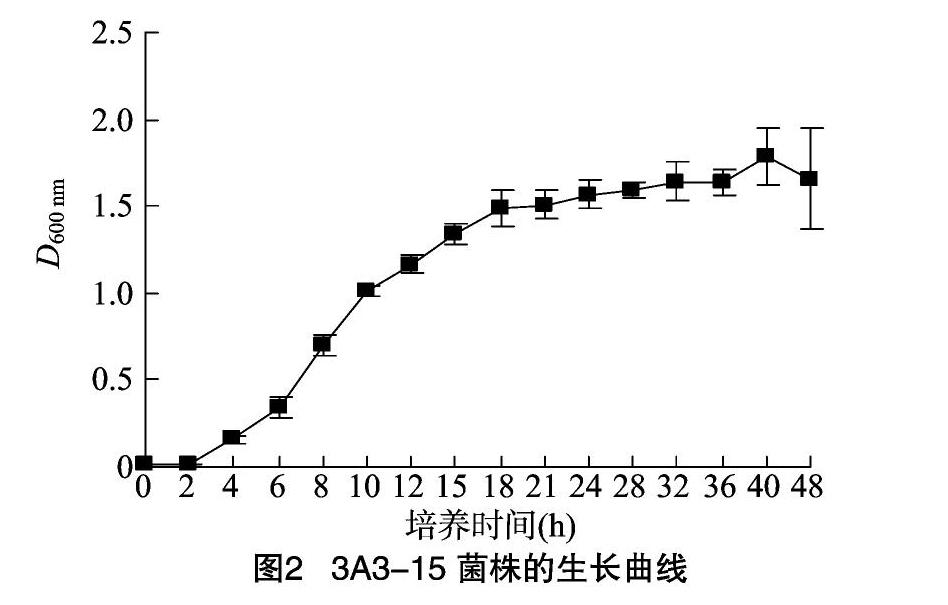
用竹签挑取活化好的贝莱斯芽孢杆菌3A3-15,接种到LB培养基中,37 ℃、180 r/min振荡培养12 h,再按1%的接种量接种到新鲜的生长培养基中,37 ℃、180 r/min振荡培养,定时取样,测定样品在600 nm波长下的吸光度,并绘制生长曲线。
1.3 质粒提取与感受态细胞制备
采用生工生物工程(上海)股份有限公司生产的SanPrep柱式质粒DNA小量抽提试剂盒提取质粒,采用1%琼脂糖凝胶电泳对提取结果进行检测,采用Thermo Scientific公司的Nanodrop 2000分光光度计测定其浓度及纯度。贝莱斯芽孢杆菌3A3-15菌株感受态细胞的制备参考文献[15-16]中的制备方法。取出冰箱中保存的3A3-15菌株,采用LB固体培养基进行活化。挑取单菌落接种于6 mL LB液体培养基,置于37 ℃、200 r/min摇床,过夜培养。取5.2 mL接入100 mL含0.5 mol/L山梨醇的LB液体培养基中,37 ℃、200 r/min 培养。将菌液冰浴10 min,然后4 ℃、5 000 r/min离心5 min收集菌体。用100 mL预冷的电转培养基重新悬浮菌体,4 ℃、5 000 r/min离心8 min弃上清,如此漂洗至少4次。将洗涤后的菌体吹悬于1 mL电转培养基中,每预冷的1.5 mL EP管分装100 μL,置于-70 ℃保存。
1.4 电击转化条件
在100 μL感受态细胞中加入质粒DNA,冰上孵育30 min后,加入预冷的电转杯(2 mm)中,电击1次。利用浙江宁波新芝生物科技股份有限公司生产的SCIENTZ-2C基因导入仪进行电击,电击完成后迅速取出杯子并立即加入900 μL RM,37 ℃、100 r/min复苏5 h后,吸取100 μL涂布在含有100 μg/mL壮观霉素和5 μg/mL红霉素的LB平板上。30 ℃培养48 h。记录菌落数,计算转化效率(转化1 μg質粒获得的菌落数)。试验重复3次。
1.5 细菌生长期对转化率的影响
为考察贝莱斯芽孢杆菌 3A3-15不同的生长状态对感受态的制备和后期转化的影响,培养细胞D600 nm值分别为03、0.5、0.7、0.9、1.1、1.3、1.5时,按照“1.3”节方法制备成不同生长时期的电转感受态,并于电压1.25 kV、电容25 μF、电阻400 Ω条件下,电击持续时间应在4.5~5.0 ms之间。电击转化方法参考“1.4”节,观察试验结果。
1.6 电压对转化率的影响
电场强度过高会造成细胞的大量死亡,电场强度过低则不能形成细胞穿孔[17]。本试验在上述研究的基础上,选择转化率最高的细胞生长期,研究电压为1.25、1.50、1.75、2.00、2.25、2.50 kV时对转化率的影响。其他条件如电容25 μF、电阻400 Ω等保持不变,按照上述“1.4”节方法进行电击转化,观察试验结果。
1.7 电阻对转化率的影响
对芽孢杆菌的电击转化电阻大多采用200 Ω和 400 Ω[18-19]。在上述细胞生长期和转化电压确定后,比较了电阻为200 Ω和400 Ω对贝莱斯芽孢杆菌 3A3-15菌株电击转化率的影响。按照上述“1.4”节方法进行电击转化,其中电容25 μF保持不变,转化后观察试验结果。
1.8 质粒加入量对转化的影响
电转化效率与外源DNA量在一定范围内成正比;但当加入的外源DNA的量过多或体积过大时,则会使转化效率下降[20]。试剂盒提取pIC333质粒后,根据前述已优化的其他电击条件,在电击转化中分别加入5、10、50、100、500 ng的质粒DNA,按照“1.4”节方法进行电击转化,计算转化率。
1.9 转化子分子验证
随机挑取转化子,于含有100 μg/mL壮观霉素的LB培养基中,37 ℃、180 r/min培养12h后,采用质粒提取试剂盒提取质粒,采用Tn10F:5′-GCATTAATGAATCGGCCAACG-3′和Tn10R:5′-GTGGGTAAACCGTGAATATCG-3′引物对含有的壮观霉素基因进行扩增,采用红霉素引物ermF:5′-ATG AACGAGAAAAATATAAAACAC-3′和ermR:5′-TTACTTA TTAAATAATTTATAGCTATT-3′对红霉素编码基因进行扩增,验证转化子。
壮观霉素基因PCR扩增程序:95 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 2 min 30 s,25个循环;72 ℃ 10 min;4 ℃保存。
红霉素基因PCR扩增程序:95 ℃ 5 min;94 ℃ 45 s,48 ℃ 45 s,72 ℃ 50 s,25 个循环;72 ℃ 10 min;4 ℃保存。
2 结果与分析
2.1 质粒提取结果
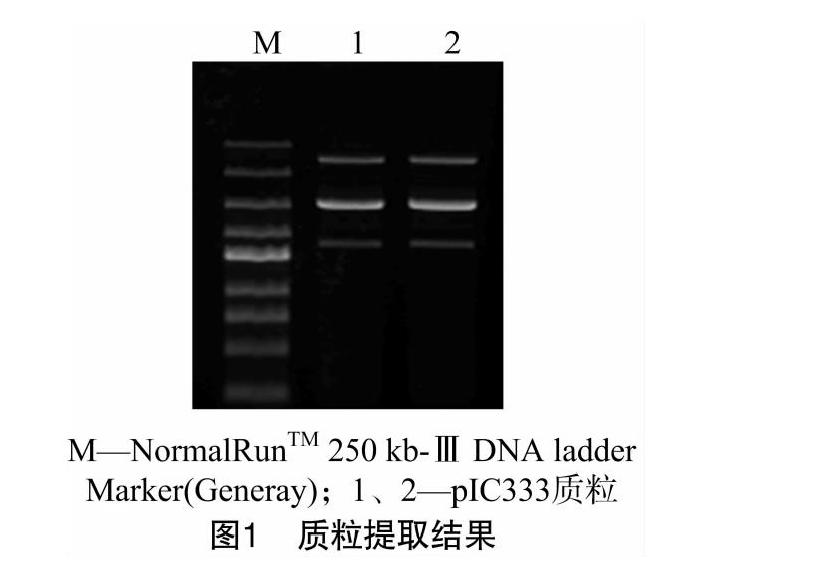
采用试剂盒提取质粒,1%琼脂糖凝胶电泳对质粒进行检测(图1)。质粒条带较清晰且无其他条带说明提取的质粒可直接用于后续的转化试验中。经nanodrop 2000分光光度计测定其浓度为34.1 ng/μL,其D260 nm/D280 nm=2.1,D260 nm/D230 nm=2.24,表明提取的质粒浓度及纯度满足电转化的需要。
2.2 细菌生长期对转化率的影响
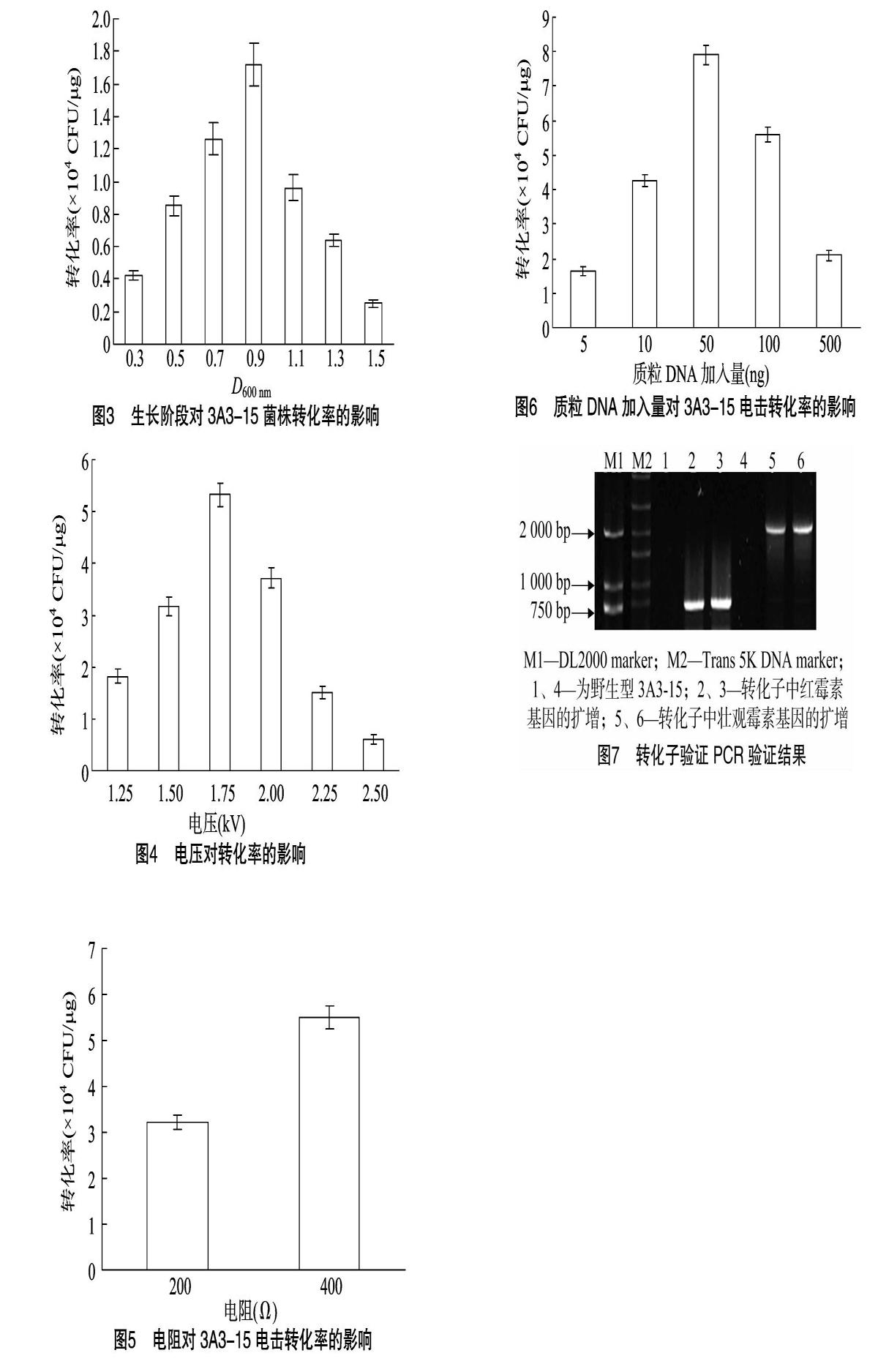
采用分光光度计测定3A3-15菌株的生长曲线,结果见图2。根据生长曲线,选取不同生长阶段的3A3-15培养物制备成电击感受态细胞,研究不同生长阶段的细胞制备的感受态对3A3-15转化效率的影响。如图3所示,在D600 nm=0.3~0.9时,3A3-15处于对数生长前期,转化率随细胞数量的增多逐渐增加。当D600 nm值为0.9时转化率最高,为172×104 CFU/μg,随后其转化率随培养时间延长有所降低。
2.3 电压对3A3-15菌株电转化效率的影响
电场强度是影响电击转化效率的重要参数[21]。根据上述结果,用D600 nm=0.9的3A3-15培养物做电击感受态, 研
究不同电压下3A3-15菌株电击转化效率,结果见图4。当电压为1.25~1.75 kV时,3A3-15菌株的转化率有明显的上升,电压为1.75 kV时,转化效率最高达到了5.33×104 CFU/μg;之后随着电压的增大,其转化率有所下降。
2.4 电阻对3A3-15菌株电转化效率的影响
在电压为1.75 kV条件下,测试电阻值在200 Ω和 400 Ω 时3A3-15菌株的电击转化效率,结果见图5,在电压为 1.75 kV、电阻值为200 Ω和400 Ω的条件下电击转化效率分别为3.23×104 CFU/μg和5.50×104 CFU/μg。故后续试验电击过程采用400 Ω电阻值。
2.5 质粒DNA加入量对3A3-15电转化效率的影响
在已优化的电击条件的基础上,研究pIC333质粒加入量对3A3-15菌株电击转化率的影响,结果(图6)表明,在一定的浓度范围内随着加入质粒DNA量的增加,其电击转化效率有所增加,当加入量为50 ng时,其转化率最高,为7.92×104 CFU/μg。当质粒DNA的加入量再增加时转化率反而降低。
2.6 贝莱斯芽孢杆菌3A3-15转化子检测
将pIC333质粒转化进入贝莱斯芽孢杆菌 3A3-15的感受态细胞中后,筛选得到了转化子3A3-15-PIC333,提取该转化子中的质粒,利用PCR扩增壮观霉素基因进行检测,结果如图7所示。利用Tn10F和Tn10R引物扩增其壮观霉素编码基因,没有转化的野生型3A3-15中没有目的条带,转化子中得到了大小约为2.1 kb的片段。上述PCR产物送华大基因进行测序,测序结果与壮观霉素基因序列一致。进一步利用引物ermF和ermR對其编码的红霉素基因进行扩增,野生型3A3-15中没有扩增到相关基因片段,在转化子中扩增得到大小约750 bp的片段,经测序、比对,其与红霉素基因序列一致。上述检测结果说明,PIC333质粒已经通过电击转化的方法转化进入了贝莱斯芽孢杆菌3A3-15中。
3 讨论与结论
电转化是一种简便高效的外源DNA转化的方法,因菌种不同其转化效率差别较大,相对于革兰氏阴性菌,革兰氏阳性菌的细胞壁较厚且致密,电击转化率较低[2]。而且芽孢杆菌不同的种属、质粒携带复制子不同来源,其电转化效率差别较大。王培培等比较了5个不同大小和携带不同复制子来源的质粒转化枯草芽孢杆菌NCD-2菌株的转化效率,发现其质粒大小与转化效率之间无线性关系,但不同复制子来源的质粒电转效率差别很大,质粒pHV1249的电转化效率为1.40×102 CFU/μg,而pNW33N的电转化效率为2.38×104 CFU/μg [10]。质粒pNW33N电转化凝结芽孢杆菌P4-102B的最高转化率为2.7×102 CFU/μg [11]。质粒pHT43电转化多黏类芽孢杆菌JSa-9感受态细胞和原生质体细胞,其转化率分别为0.36×103 CFU/μg和 1.0×103 CFU/μg [17]。本试验中质粒pIC333电转化贝莱斯芽孢杆菌 3A3-15感受态细胞的转化率为7.92×104 CFU/μg,满足基因操作的需要。
电场强度是影响电击效率的主要参数,提高电场强度可以增强外源基因进入菌体的概率,但会增加细菌细胞的死亡率,使得转化效率下降,因此转化效率要兼顾这2个方面。不同的菌株所需最适的转化电场强度有所不同。如Lu等研究了质粒pHT43在2株枯草芽孢杆菌WB800和DB104中的转化率,发现在20~25 kV/cm的电场强度下,2株芽孢杆菌最优转化强度有所不同,分别在24 kV/cm和22 kV/cm时电击转化率最高[22],枯草芽孢杆菌NCD-2最适转化场强为 14 kV/cm [10]。迄今,除本研究外未发现有关贝莱斯芽孢杆菌优化电场强度的报道。
不同菌株电击转化的最佳生长阶段是不一致的。一般处于对数生长初期的菌株电击转化率高于中期和后期[16]。本试验中转化率最高时其D600 nm为0.9,处于对数生长初期。外源质粒DNA加入量对转化也有一定影响,加入量不足和太多都会影响转化效率。本试验中DNA最佳加入量为50ng,这与牛福星等发现pHCMC04质粒添加量为140 ng时其转化率最高的结果[23]以及Zhang等发现当质粒DNA含量在10 ng时pHT43转化Bacillus subtilis ZK的效率最高的结果[24]均有所不同,说明不同菌株间转化所需DNA浓度有所不同。
总之,本试验首次研究了pIC333电转化贝莱斯芽孢杆菌3A3-15的条件,发现当细胞培养物浓度D600 nm为0.9、电压为1.75 kV,电阻为400 Ω、质粒DNA加入量为50 ng时,其转化率最高,达7.92×104 CFU/μg,本研究结果为贝莱斯芽孢杆菌的电击转化提供了方法,为其基因转移和分子生物学操作奠定了基础。
参考文献:
[1]Gao Z F,Zhang B J,Liu H P,et al. Identification of endophytic Bacillus velezensis ZSY-1 strain and antifungal activity of its volatile compounds against Alternaria solani and Botrytis cinerea[J]. Biological Control,2017,105:27-39.
[2]刘莲娜,孙伟明,郭 巍,等. 一株新的拮抗细菌SL19及其抑菌活性物质[J]. 微生物学通报,2011,38(8):1199-1206.
[3]Turgeon N,Laflamme C,Ho J,et al. Elaboration of an electroporation protocol for Bacillus cereus ATCC 14579[J]. Journal of Microbiological Methods,2006,67(3):543-548.
[4]Roh J Y,Liu Q,Choi J Y,et al. Construction of a recombinant Bacillus velezensis strain as an integrated control agent against plant diseases and insect pests[J]. Journal of Microbiology and Biotechnology,2009,19(10):1223-1229.
[5]张 卉,王小珂,马世俊. 转座元件mariner[J]. 遗传,2004,26(5):756-762.
[6]Rubin E J,Akerley B J,Novik V N,et al. In vivo transposition of mariner-based elements in enteric bacteria and mycobacteria[J]. Proceedings of the National Academy of Sciences,1999,96(4):1645-1650.
[7]马 欣,高学文. 转座子随机突变芽孢杆菌的研究进展[J]. 中国生物防治学报,2015,31(3):394-403.
[8]Petit M A,Bruand C,Janniere L,et al. Tn10-derived transposons active in Bacillus subtilis[J]. Journal of Bacteriology,1990,172(12):6736-6740.
[9]Steinmetz M,Richter R. Easy cloning of mini-Tn10 insertions from the Bacillus subtilis chromosome[J]. Journal of Bacteriology,1994,176(6):1761-1763.
[10]王培培,郭庆港,李社增,等. 枯草芽孢杆菌NCD-2菌株的高效电击转化[J]. 中国生物防治学报,2011,27(3):368-372.
[11]赵春云,杨 颂,欧阳立明,等. 高渗提高凝结芽孢杆菌P4-102B菌株的电击转化效率[J]. 微生物学通报,2016,43(6):1388-1394.
[12]彭清忠,彭清静,张惟材,等. 短芽孢杆菌的转化方法[J]. 吉首大学学报(自然科学版),2004,25(4):35-38.
[13]张 爽,薛正莲,陈 环,等. 一种电击转化枯草芽孢杆菌方法的优化[J]. 重庆理工大学学报(自然科学),2014,28(8):60-63,80.
[14]胡晓璐,沈新迁,傅科鹤,等. 短小芽孢杆菌(Bacillus pumilus)DX01转座突变株的构建及转化体系的优化[J]. 上海交通大学学报(农业科学版),2011,29(1):68-74.
[15]Matsuno Y,Ano T,Shoda M. High-efficiency transformation of Bacillus subtilis NB22,an antifungal antibiotic iturin producer,by electroporation[J]. Journal of Fermentation and Bioengineering,1992,73(4):261-264.
[16]Xue G P,Johnson J S,Dalrymple B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis[J]. Journal of Microbiological Methods,1999,34(3):183-191.
[17]高 玲,邓 阳,陆兆新,等. 多黏类芽孢杆菌JSa-9电转化方法的优化[J]. 食品科学,2014,35(11):89-94.
[18]Peng D,Luo Y,Guo S,et al. Elaboration of an electroporation protocol for large plasmids and wild-type strains of Bacillus thuringiensis[J]. Journal of Applied Microbiology,2009,106(6):1849-1858.
[19]Romero D,Perez-Garcia A,Veening J W,et al. Transformation of undomesticated strains of Bacillus subtilis by protoplast electroporation[J]. Journal of Microbiological Methods,2006,66(3):556-559.
[20]Rittich B,panová A. Electrotransformation of bacteria by plasmid DNAs:statistical evaluation of a model quantitatively describing the relationship between the number of electrotransformants and DNA concentration[J]. Bioelectrochemistry and Bioenergetics,1996,40(2):233-238.
[21]McDonald I R,Riley P W,Sharp R J,et al. Factors affecting the electroporation of Bacillus subtilis[J]. Journal of Applied Microbiology,1995,79(2):213-218.
[22]Lu Y P,Zhang C,Lv F X,et al. Study on the electro-transformation conditions of improving transformation efficiency for Bacillus subtilis[J]. Letters in Applied Microbiology,2012,55(1):9-14.
[23]牛福星,于晶晶,湯宏赤,等. 枯草芽孢杆菌突变株IA857高效转化方法的研究[J]. 广西科学,2014(2):119-123.
[24]Zhang Z,Ding Z T,Shu D,et al. Development of an efficient electroporation method for iturin A-producing Bacillus subtilis ZK[J]. International Journal of Molecular Sciences,2015,16(4):7334-7351.汤 英,董金龙,王嫒华,等. 一次性施用草酰胺对水稻产量、氮肥利用率、氨挥发和氮素渗漏损失的影响[J]. 江苏农业科学,2019,47(5):50-55,74.

