抑郁与慢性疼痛共病动物模型的研究进展*
国 笑,王 瑜,李少源,焦 玥,荣培晶
(中国中医科学院针灸研究所 北京 100700)
抑郁与疼痛是严重困扰人类的两大类疾病,在临床上抑郁和慢性疼痛常常相伴随发生[1]。有报道显示,高达50%的慢性疼痛患者可表现出抑郁,而60%的抑郁症患者伴有慢性疼痛症状[2]。抑郁和慢性疼痛存在着复杂的相互促进关系[3]。慢性疼痛患者的抑郁症患病率是普通人群的数倍,同时抑郁症也显著增加了患慢性疼痛的风险[4]。在治疗方面,抑郁与慢性疼痛共病较此二者中任何一种疾病单发而言,其治疗难度更大,并伴随着更严重的残疾、健康相关生活质量受损、更高的死亡率,造成了巨大的社会和经济负担[5]。
我国现存的古代文献中虽无针对抑郁与疼痛共病的专论,但对其认识却历史悠久。《素问·阴阳应象大论》中提出:“气伤痛”。金·张子和在《儒门事亲》中说:“诸痛皆因于气”。气血在经络中的正常运行,有赖于气的推动,气机阻滞,则经络不通,不通则痛。气郁、气滞都可以导致疼痛[6,7]。《灵枢·本神》说:“忧愁者,气闭塞而不行”。《古今医统大全·郁症门》中提到“郁为七情不舒,遂成郁结,既郁之久,变病多端”。中医学将抑郁症归属于“郁症”,抑郁症始于肝失条达,疏泄失常,其基本病机是气机阻滞,因此气机郁滞是抑郁和疼痛共病的中医病机。另外,抑郁症患者阳气不振,气机抑遏,脏腑气化失常[8],津液在人体内无法正常地升降输布,导致脏腑经络、肢体关节缺乏津液濡养而出现“不荣则痛”[9,10]。从中医病因病机的角度去分析,可见抑郁与疼痛也是互相影响、紧密联系的。尽管如此,但我们对抑郁与疼痛共病的认识还比较模糊,对其具体的发生机制仍无从得知。
动物模型是医学实验研究的一种重要载体,针对特定疾病建立的动物模型是研究发病机制与验证治疗有效性的前提和基础[11]。目前,抑郁与慢性疼痛共病引发了社会的高度关注,研究者们已开展动物实验研究,寻找抑郁与慢性疼痛共同的发病机制并以此作为潜在治疗靶点,为临床上探索抑郁与慢性疼痛共病的有效治疗方法提供理论基础。然而,抑郁与慢性疼痛共病的生物学机制至今还未阐明,其制约因素之一便是动物模型的选择。故本文就目前常用且得到广泛认同的抑郁症与慢性疼痛共病的动物模型进行分析总结,以期为今后的抑郁与慢性疼痛共病研究提供参考。
1 疼痛模型诱导抑郁与慢性疼痛共病
1.1 神经病理性疼痛模型诱导抑郁与慢性疼痛共病
1.1.1 坐骨神经慢性压迫性损伤(Chronic Constriction Injury of the Sciatic Nerve,CCI)模型
在一项评估度洛西汀和氟西汀的抗抑郁和/或抗伤害作用的实验中,研究者选用CCI 作为神经病理性疼痛模型,通过强迫游泳实验(Forced Swimming Test,FST)的不动时间的增加表明CCI模型能够诱导出抑郁样行为,选择性5-羟色胺(5-hydroxytryptamin,5-HT)和去甲肾上腺素再摄取抑制剂度洛西汀能改善CCI模型诱导的抑郁和疼痛样行为,提示抑郁与慢性疼痛共病的机制可能与单胺类神经递质5-HT和去甲肾上腺素的水平变化有关[12]。在另一项研究酚类单体白藜芦醇对小鼠疼痛和抑郁样行为影响的实验中,小鼠CCI模型表现为热痛觉、机械性痛觉过敏和行为绝望(FST中延长的不动时间),实验结果证明,慢性白藜芦醇对神经病理性疼痛模型小鼠的热痛觉过敏和抑郁样行为具有治疗作用,单胺类机制参与白藜芦醇对神经病理性疼痛小鼠的镇痛和抗抑郁作用[13]。Nascimento 等探索肿瘤坏死因子α(Tumor Necrosis Factor alpha,TNFα)参与抑郁和慢性疼痛共病的生理和病理机制,选用CCI 模型,用von Frey 实验评价机械性痛觉,用悬尾试验(Tail Suspension Test,TST)和FST 评定抑郁样行为,实验结果表明CCI模型是研究抑郁和疼痛共病机制的良好模型,CCI 模型小鼠的坐骨神经、前额叶皮质(Prefrontal cortex,PFC)和海马组织中TNF-α水平升高提示抑郁和慢性疼痛共病机制与外周炎症影响中枢神经系统(Central Nervous System,CNS)有关[14]。Xi Jiang等在von Frey、TST、FST 的基础上增加了Hargreaves 实验来评价热痛觉,实验结果表明反式虾青素的抗抑郁及疼痛行为与5-HT系统和炎症有关[15]。
1.1.2 部分坐骨神经结扎(Partial Sciatic Nerve Ligation,PSNL)模型
Brüning等通过观察有机硒化合物对PSNL模型小鼠在von Frey 实验中的阈值和FST 中的不动时间的影响,发现有机硒化合物能有效减轻PSNL 所致小鼠的机械性痛觉障碍和抑郁样行为,并且这些作用与抗炎机制有关[16]。Bura 等发现PSNL 模型的糖水消耗量减少,表明了PSNL模型的快感缺失,而接受sigma-1受体拮抗剂S1RA的PSNL模型的糖水消耗量与假手术组基本相同,说明S1RA改善了PSNL模型的情绪性表现[17]。
1.1.3 脊髓神经结扎(Spared Nerve Ligation,SNL)模型
Xiaofan Hu等采用左侧L5 SNL大鼠模型,SNL组大鼠的持续较低的糖水消耗量与明显的FST不动时间证明SNL 能诱导出抑郁样行为,实验同时还观察到了模型大鼠海马内白细胞介素(Interleukin,IL)-1β和TNFα的表达上调[18]。Geehoon Chung等采用右侧L5 SNL大鼠模型同样诱导出抑郁样行为,实验表明模型内侧前额叶皮质的边缘前区的代谢性谷氨酸受体5表达明显上调[19]。Burke 等探究母爱剥夺(Maternal Deprivation,MD)对大鼠周围神经损伤(L5-L6 SNL)前后伤害性反应的影响,即早期应激对啮齿动物神经病理性疼痛行为的影响,结果显示雌性大鼠出现了热痛觉过敏和机械性痛觉异常,表明相比于雄性大鼠,雌性大鼠在周围神经损伤后表现出更强的伤害性反应,这种反应与神经炎症介质的改变有关[20]。
1.1.4 备用神经损伤(Spared Nerve Injury,SNI)模型
Wenjun Zhou 等采用小鼠神经病理性疼痛SNI 模型,SNI 模型导致单侧机械性异位症,减少了社会交往,并在不改变运动活动的情况下增加了FST 中的不动时间。这些结果表明SNI引起的与疼痛共存的抑郁样行为[21]。Wen-Shan Gui 等同样使用SNI 模型,但实验结论为机械性异位症是神经病理性疼痛的一种行为表现,与神经损伤大鼠的短时记忆障碍和抑郁行为无关,神经病理性疼痛不是认知和情绪障碍发生所必需的,坐骨神经损伤后IL-1β的过度分泌可能是神经病理性疼痛、记忆障碍、抑郁发生的共同机制[22]。Norman等采用小鼠SNI 模型,以验证神经损伤通过脑内炎症诱发抑郁的假设。与假手术组相比,SNI 可引起机械性痛觉过敏,并诱导抑郁样行为。周围神经损伤导致脑内细胞因子表达增加,而细胞因子高表达促进抑郁样行为的发展[23]。
1.1.5 创伤性脊髓损伤(Spinal Cord Injury,SCI)模型
Xiaoming Li 为了诱发SCI 模型,在成年雄性C57 BL/6 小鼠T8-T10 处进行椎板切除术,暴露硬脑膜,然后在麻醉下轻度压迫脊髓15 s。实验者观察到SCI 模型选择性地降低海马脑源性神经营养因子(Brain derived neurotrophic factor,BDNF)的表达,过度激活下丘脑-垂体-肾上腺轴,并导致抑郁症状的发生,乙酰胺ZBD-2 可能通过抑制胶质细胞的激活和恢复与突触可塑性相关的信号系统来改善慢性SCI疼痛引起的抑郁样行为[24]。Pere Boadas-Vaello等采用孟加拉玫瑰光敏染料对BALB/c小鼠进行光化学损伤,作为脊髓损伤模型的一种补充或替代方法,光化学损伤使小鼠脊髓损伤进入慢性期。1-2 min 光损伤导致痛觉过敏持续至伤后4 周,5-10 min 光损伤导致痛觉过敏持续至慢性期(伤后8 周)。与假手术组小鼠相比,暴露于光化学损伤的SCI模型小鼠在慢性期表现出更多的绝望行为,说明小鼠抑郁和焦虑样行为水平在SCI 的诱导下有所增加[25]。
1.1.6 慢性广泛性疼痛(Chronic Widespread Pain,CWP)模型
Yuting Liu等采用大鼠双侧机械性痛觉过敏模型,重复肌肉注射酸性盐水,从而建立CWP模型。研究评估这种酸致疼痛模型中是否同时存在焦虑和抑郁样行为,以模拟临床上CWP综合征患者。研究者采用旷场试验(Open Field Test,OFT)和高架十字迷宫(Elevated Plus Maze Test,EPMT)评价大鼠的焦虑样行为,FST、糖水偏好实验(Sucrose Preference Test,SPT)评价小鼠的抑郁样行为。研究结果表明重复肌肉注射酸性盐水可引起双侧长时间机械性痛觉过敏。CWP 模型大鼠在EPMT 和OFT 中表现出焦虑样行为,在FST 中表现出绝望情绪(长时间不动),以及SPT 中表现出降低的糖水消耗量,这些实验结果表明CWP模型大鼠表现出发展焦虑和抑郁样行为的倾向[26]。
1.2 炎症性疼痛模型诱导抑郁与慢性疼痛共病
1.2.1 完全弗氏佐剂(Complete Freunds Adjuvant,CFA)注射模型
在右胫骨关节内注射CFA诱发Wistar大鼠炎性关节炎,产生机械性痛觉异常和热痛觉过敏,与假手术组相比,注射CFA 的炎症效果至少持续21天。FST结果表示,在第7天和第14天发现模型大鼠的持续性伤害性感受引起了抑郁样行为。实验表明脑内吲哚胺2,3-双加氧酶(1indoleamine 2,3-dioxygenase 1,IDO1)介导的疼痛和抑郁共病的调节机制[4]。在一项探讨氯胺酮对足底注射CFA 建立的大鼠抑郁和炎性疼痛共病模型影响的研究中,研究者发现注射CFA可引起一种持久的机械性痛觉异常和一种暂时性的热痛觉过敏,炎症性疼痛引起的抑郁样行为在注射CFA后7天开始出现,至少持续到14天。单剂量氯胺酮(20 mg·kg-1)可减轻机械性痛阈,减少FST中的不动时间,增加糖水消耗量,降低海马IL-6、IL-1水平,从而减轻机械性痛觉障碍及相关的抑郁样行为[27]。Vanja Duric对大鼠的后爪注射福尔马林或CFA 建立急性或慢性炎症疼痛模型,研究发现持续性疼痛可诱导海马的应激性损伤调节效应,这可能是抑郁和慢性疼痛共病的基础[28]。
1.2.2 硬脑膜致炎剂灌注模型
Mingjie Zhang 等在硬脑膜上反复注入致炎剂(Inflammatory Soup,IS)已达到脑膜伤害性刺激,从而建立经典的慢性偏头痛大鼠模型。作为目前应用最广泛的模型之一,它模拟了偏头痛的神经源性炎症的病理生理过程。实验结果表明慢性偏头痛大鼠多数表现出抑郁和焦虑样行为,并且PFC 的5-HT 和多巴胺水平均显著降低[29]。
2 抑郁模型诱导抑郁与慢性疼痛共病
慢性不可预知性温和应激(Chronic Unpredictable Mild Stimulation,CUMS)模型。
Mingjie Zhang 等观察了CUMS 模型对大鼠三叉神经血管伤害性感受的影响,实验结论为CUMS 模型诱导的抑郁可加重三叉神经血管伤害性感受,使模型大鼠对疼痛更加敏感[30]。
3 复合模型模拟抑郁与慢性疼痛共病
3.1 嗅球切除(Olfactory Bulbectomised,OB)结合SNL模型
实验者对大鼠进行L5 和L6 的SNL 和双侧的OB。实验结果表明米诺环素急性给药对小胶质细胞的抑制作用不会改变OB诱导的抑郁样行为,但可以抑制SNL诱导的神经病理性疼痛相关行为的发展。米诺环素慢性给药可调节小胶质细胞的激活和炎症介质在CNS的表达,减轻OB和SNL所诱导的抑郁样行为和神经病理性疼痛行为[2]。Burke 等也采用OB 结合SNL 模型大鼠,与假手术大鼠相比,OB 大鼠抑郁模型表现为机械性痛觉和冷痛觉过敏,但无热痛觉过敏。实验表明杏仁核是调节情绪和疼痛的关键脑区[31]。Burke 另外一项的实验探讨阿米替林慢性给药对OB 抑郁模型大鼠神经病理性疼痛相关行为及相关神经炎症过程的影响,他发现L5-L6 SNL 后引起的神经病理性疼痛在假手术组和OB组均可引起机械性痛觉、冷性痛觉、热痛觉过敏,两实验存在相互矛盾的地方。实验结果表明阿米替林可抑制OB-SNL 大鼠PFC 的IL-10 和趋化因子5的表达,增强TNF-α的表达[3]。
3.2 CCI结合CUMS模型
Lidia Bravo 等采用CCI 和CUMS 模型相结合的方法,对模型的感觉和情绪成分进行评估。结果表明慢性疼痛并未加重CUMS 大鼠的抑郁样行为,前扣带皮质可能参与抑郁和慢性疼痛共病。此外,抑郁还可增强某些特定的感觉疼痛的感知能力,如冷痛觉,但对机械阈值没有影响。研究者还指出与对照组相比,单独的CCI 模型在2 周内没有诱导出抑郁样行为,这与慢性疼痛可以导致抑郁和焦虑样行为的发展,即所谓的“继发性疼痛影响”的观点相矛盾[32]。
3.3 慢性强迫游泳(Chronic Forced Swim Stress,CFSS)结合SNI模型
在一项研究CFSS 应激引起的神经病理性疼痛的加重是否由杏仁核中央核(Central Nucleus of the Amygdala,CEA)所介导的实验中,研究者发现慢性CFSS 应激会导致大鼠抑郁样行为和加重SNI 引起的机械性痛觉,而这种痛觉过敏可能是由于CFSS 增强SNI引起的CEA中GluN2B-NMDA受体的功能上调[33]。
3.4 CUMS结合皮下注射福尔马林模型
在一项探讨丘脑外侧缰核(Lateral Habenular Nucleus,LHb)在大鼠抑郁-疼痛共病中的作用的研究中,在CUMS 大鼠后爪皮下注射福尔马林导致自发疼痛后,评估CUMS模型大鼠的疼痛行为。结果表明,模型组大鼠对疼痛的敏感性高于对照组;与正常大鼠相比,模型组大鼠LHb神经元的放电活动明显增强[34]。
3.5 CUMS结合CFA以及皮下注射福尔马林模型
在一项探讨抑郁症对大鼠诱发疼痛行为(热刺激痛觉和痛觉过敏)和自发疼痛行为(福尔马林痛)的影响的实验中,与非CUMS 模型大鼠相比,CUMS 结合CFA诱导的抑郁与慢性疼痛共病模型大鼠对伤害性热刺激表现出更强的耐受性,CUMS 结合福尔马林痛大鼠的自发伤害性行为明显增强。结果表明抑郁症对诱发疼痛行为和自发疼痛行为产生不同的影响,前者减轻,后者加重[35]。
4 讨论
目前,最常用的诱导抑郁与慢性疼痛共病的疼痛动物模型主要为神经病理性疼痛模型和炎症性疼痛模型[36]。绝大部分的神经病理性疼痛模型都是在坐骨神经以及坐骨神经的相关神经上进行操作,方式为神经压迫或切断。这类模型主要包括坐骨神经主干周围的三个或四个松散结扎(坐骨神经慢性压迫,CCI)、坐骨神经的紧密结扎(部分坐骨神经结扎,PSNL)或L5 和L6 脊髓神经的结扎(脊神经结扎,SNL)。备用神经损伤(SNI)是另一种常用的坐骨神经损伤模型,在坐骨神经远端切断前,将坐骨神经的周围三个末端分支(腓肠神经、腓总神经和胫神经)中的两个紧紧地结扎。这类模型的共同特点是诱发机械性痛觉和热痛觉变化,以及抑郁和焦虑样行为。本文所提到的评价疼痛模型是否诱导抑郁及焦虑样行为的实验中,常用到的评价机械性痛觉、热痛觉、冷痛觉的方法分别是von Frey、Hargreaves、丙酮滴漏试验,评估啮齿类动物焦虑样行为的方法是EPMT 和OFT,以及评估啮齿类动物抑郁样行为方法是FST、TST、SPT。本文所涉及的实验使用动物模型研究抑郁与慢性疼痛的共病机制,结果表明共病机制主要包括单胺类神经递质5-HT、去甲肾上腺素、多巴胺的变化,外周炎症影响CNS炎症,谷氨酸受体及神经营养因子的变化,下丘脑-垂体-肾上腺轴的过度激活。另外抑郁与慢性疼痛共病所涉及的脑区主要包括海马、PFC、杏仁核、前扣带皮质。
大多数实验证明神经病理性疼痛和炎症性疼痛在一定时间内可诱导抑郁样行为,但诱导的时间不尽相同,另外少数实验对诱导抑郁样行为的观点持否定态度。不一致的原因可能是实验结果受到不同的动物种类、品系、模型种类、造模的时间、实验环境等因素的影响。另外,在实践中我们发现,部分神经病理性疼痛模型和炎症性疼痛模型产生的疼痛或炎症作用都具有时效性,在一定的有效时间内可以产生疼痛样行为并诱导抑郁样行为的出现,超过有效时间动物会产生自愈反应从而导致作用消失,达到暂时性而非永久性的疾病状态与水平,并不能完全地模拟临床上抑郁与慢性疼痛共病患者的真实状态,这可能是神经病理性疼痛和炎症性疼痛模型需要深入探讨的问题,保持长时间的疼痛或炎症作用可能需要持续性的刺激和刺激强度的增大。
本文的研究范围局限于周围神经损伤方面,而中枢神经损伤、三叉神经痛、糖尿病神经疾病、化学诱导的神经疾病、疱疹后神经痛、内脏疼痛等也可能会诱导抑郁样行为,并作为研究抑郁与慢性疼痛共病的潜在模型。未来,我们将对上述所提到的多种疼痛模型进行研究,以为抑郁与慢性疼痛共病的实验研究提供更多参考[37]。
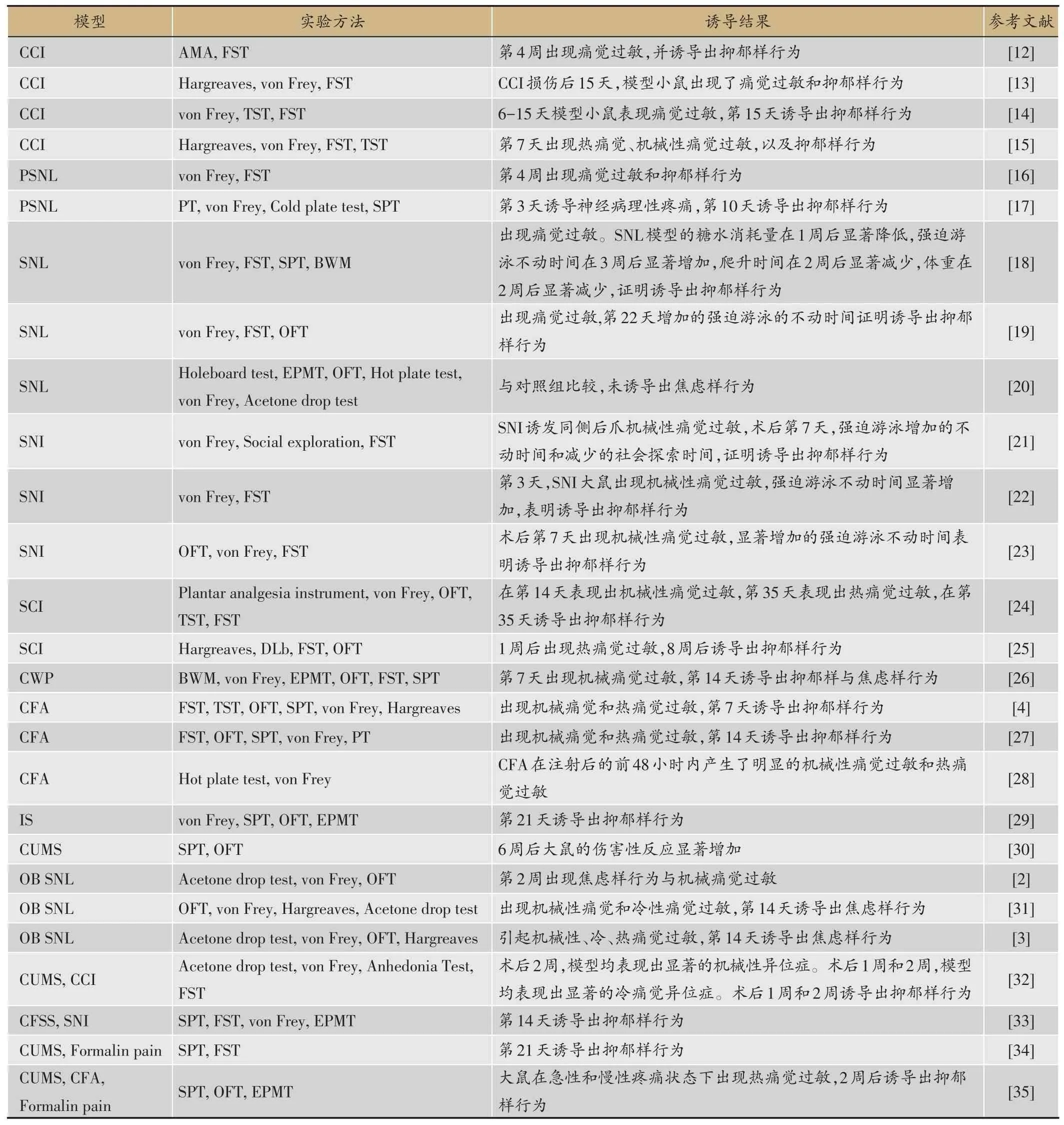
表1 本文中涉及抑郁和慢性疼痛共病动物模型统计

