肝细胞癌共面和非共面容积旋转调强放疗与螺旋断层放疗的剂量学研究
闫冰,吴爱东,张洪波,刘磊,薛旭东,沈琦
中国科学技术大学附属第一医院(安徽省立医院)放疗科,安徽合肥230001
前言
原发性肝癌目前在我国常见恶性肿瘤中发病率居第4位,死亡率排名第3,严重威胁广大居民的健康,而原发性肝细胞癌占原发性肝癌的70%~85%,是最主要的发病类型。肝癌的放射治疗近年来得到广泛运用,如晚期不可手术肝癌、肝癌肝移植前治疗、中央型肝癌切缘距肿瘤≤1 cm的窄切缘术后治疗、TACE治疗后复发、肝癌合并门静脉癌栓等,因疗效确切,放射治疗在国家卫生计生委原发性肝癌诊疗规范(2017年版)中得到推荐[1]。目前,固定野适形调强放射治疗(IMRT)技术因具有正常组织剂量低、肿瘤局部剂量高的特点,已经被越来越多的应用于肝细胞癌的治疗,与固定野IMRT相比,旋转调强技术在多种肿瘤放射治疗中体现出更佳的剂量学优势[2-4]。目前作为最先前的旋转调强技术代表的螺旋断层放疗(HT)和容积旋转调强放疗(VMAT)在复杂靶区的放疗计划设计上各有一定优势。本研究通过比较10例肝细胞癌患者HT、共面VMAT以及非共面VMAT3组放疗计划的剂量学差异,为肝细胞癌患者放疗技术选择提供依据。
1 材料与方法
1.1 临床资料
回顾性分析2016~2017年在安徽省立医院放疗科接受治疗的10例肝细胞癌患者,所有患者经病理确诊或临床诊断为原发性肝细胞癌且限于单个病灶,无腹水及远处转移。其中男性6例,女性4例,年龄47~63岁,中位年龄53岁。所有患者签署放疗知情同意书,经图像引导在线校正摆位误差后行调强放射治疗。
1.2 体位固定和CT扫描
所有患者均取仰卧位,双手交叉抱肘放于额头之上,并采用负压真空垫固定。确认固定无误后在平静呼吸状态下行增强螺旋CT扫描,扫描范围从气管分叉至髂前上棘水平,扫描层厚7.5 mm,扫描的CT图像经2.5 mm重建后依照DICOM协议传输至ADAC Pinncale 9.10治疗计划系统。
1.3 靶区及危及器官勾画
临床医生根据增强CT影像勾画大体肿瘤体积(Gross Tumor Volume,GTV),并在GTV基础上外扩0.5 cm形成临床靶体积(Clinical Target Volume,CTV)。由于在定位及治疗时均未使用呼吸门控以及腹部加压装置,因此计划靶区(Planning Target Volume,PTV)的勾画在考虑呼吸运动的基础上,根据CTV头脚方向外放1.0~1.5 cm,前后及左右方向外放0.5 cm。危及器官包括正常肝脏、肾脏、胃和脊髓。正常肝脏定义为全肝减去PTV的体积,计划评估时仅评价正常肝脏的受照剂量与体积。
1.4 治疗计划设计
分别为10例患者设计非共面VMAT(Nocoplanar VMAT,NC-VMAT)、共面 VMAT(Coplanar VMAT,C-VMAT)及HT3组治疗计划。患者的靶区及危及器官均在Pinnacle计划系统上完成勾画,由上级主管医生审核后传输至Tomotherapy治疗计划系统行HT计划设计,C-VMAT和NC-VMAT治疗计划均在Pinnacle治疗计划系统上设计完成。①C-VMAT治疗计划:双弧照射时机架角分别按照顺时针自181°旋转至179°,以及按照逆时针自179°旋转至181°,治疗床角度均为0°,准直器分别旋转10°和350°,以避免MLC叶片间漏射至患者同一身体部位。优化参数方面,两照射弧均设置每4°为一个控制点,最大允许投照时间为150 s。②NC-VMAT治疗计划:为防止治疗时机架与治疗床发生碰撞,设定第1个治疗弧顺时针自181°旋转至50°,治疗床25°,准直器0°;第2个治疗弧逆时针旋转自320°旋转至40°,治疗床90°,准直器0°;第3个治疗弧顺时针自181°旋转至179°,治疗床角度0°,准直器10°。其余射野及优化参数与共面VMAT计划保持一致。③HT计划:螺距设置为0.287,调制因子2.4~2.8,铅门宽度根据靶区在头脚方向上的长度设置为1.0~2.5 cm。上述3组计划给予PTV处方剂量60 Gy/30次,要求处方剂量至少覆盖95%的计划靶体积。
1.5 剂量学评估
靶区评估参数为PTV的Dmax、Dmin、Dmean、均匀性指数(HI)[5]及适形度指数(CI)[6]。其中 HI定义为式中D2表示2%的靶区体积接受的最小剂量,D98表示98%的靶区体积接受的最小剂量,HI越接近于1,表示均匀性越好。CI定义为式中,TVPV为处方剂量线所包绕的靶区体积,VPTV为靶区体积,VTV为处方剂量线所包绕的总体积,CI值越接近1,表示适形度越好。危及器官评估参数为脊髓最大剂量Dmax,胃平均剂量Dmean和V30,肾脏的平均剂量Dmean和V20以及正常肝脏的平均剂量Dmean、V5、V10、V20、V30、V40和V50,以及3组计划的治疗时间。
1.6 统计学分析
采用SPSS 16.0软件进行统计学处理,数据用均数±标准差表示,3组治疗计划间行两两配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 靶区剂量参数比较
10例患者的3组放疗计划的剂量分布及计划参数均能达到临床处方剂量要求,其中1例患者的剂量分布及剂量体积直方图如图1和图2所示。3组治疗计划在靶区剂量参数方面,与VMAT相比,HT计划靶区的Dmax、Dmean、D2及HI均优于 VMAT计划(P<0.05),但两种计划间在Dmix、D98以及CI方面差异无统计学意义。与NC-VMAT计划相比,HT计划靶区的Dmax、Dmix、Dmean、D2、D98和HI均优于NC-VMAT计划,而CI方面差异同样无统计学意义。C-VMAT与NC-VMAT相比,两者仅在D98参数上具有统计学意义(P<0.05),其余参数均差异不大,详见表1。

图1 3种计划剂量分布比较Fig.1 Com parison of isodose distributions among 3 different plans
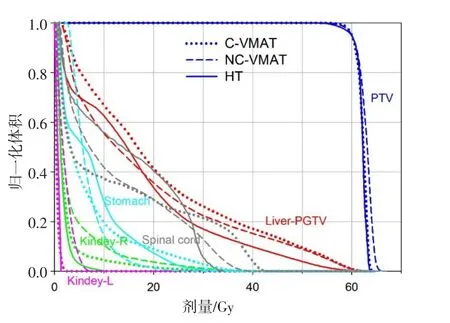
图2 3组计划的剂量体积直方图比较Fig.2 Dose-volume histogram of 3 different p lans
2.2 危及器官剂量学参数比较
3组治疗计划中胃Dmean、胃V30、左肾V20、右肾V20差异均不大;左肾Dmean、右肾Dmean及脊髓Dmax,3组之间仅NC-VMAT与C-VMAT计划相比具有统计学意义,具体见表2。在肝脏保护方面,3组计划肝脏平均剂量,NCVMAT优于C-VMAT,但与HT相比差异无统计学意义。肝脏低剂量区参数如肝脏V5、V10,HT与C-VMAT相比无统计学意义,但HT计划的肝脏高剂量区参数V40和V50明显优于C-VMAT(P<0.05)。HT与NC-VMAT相比,NC-VMAT的肝脏低剂量区参数肝脏V5和V10优于HT,差异具有统计学意义,而高剂量区参数肝脏V40和V50差异无统计学意义,具体见表3。
表1 3种计划肿瘤靶区的剂量学指标(n=10,±s)Tab.1 Com parison of target dosim etric parameters among 3 different plans(n=10,M ean±SD)

表1 3种计划肿瘤靶区的剂量学指标(n=10,±s)Tab.1 Com parison of target dosim etric parameters among 3 different plans(n=10,M ean±SD)
#表示HT与C-VMAT相比;*表示HT与NC-VMAT相比;&表示C-VMAT与NC-VMAT相比。表中D值单位为Gy
参数HT C-VMAT NC-VMAT P值#P值*P值&Dmax Dm in D98 Dmean D2 H I CI 64.97±1.33 52.93±3.11 61.70±0.34 59.10±0.57 63.37±0.59 0.07±0.02 1.16±0.06 66.06±1.42 50.91±4.02 62.60±4.20 59.01±0.49 64.67±0.85 0.09±0.02 1.15±0.05 66.08±1.23 49.31±3.18 62.69±0.47 58.68±0.46 64.75±0.87 0.10±0.02 1.15±0.05 0.04 0.82 0.00 0.56 0.00 0.00 0.54 0.03 0.01 0.00 0.03 0.00 0.00 0.54 0.98 0.12 0.60 0.02 0.25 0.25 0.86
2.3 治疗时间比较
HT治疗时间最长[(418±123)s],与C-VMAT[(171±52)s]及NC-VMAT[(179±32)s]相比具有统计学意义(P<0.05),而两种VMAT技术之间治疗时间无差异(P>0.05)。
3 讨论
对于不能手术切除的肝细胞癌,放射治疗联合其它治疗能够使患者得到明显获益。曾昭冲报道不能手术切除的大体积肝癌,经动脉栓塞化疗(TACE)后联合放疗,与单纯TACE相比明显提高了患者的生存率[7]。Guo 等[8]、陈德连等[9]也有类似报道,Kim等[10]也报道不能行手术治疗的部分肝细胞癌患者在接受放疗后有再行手术切除的机会。为了提高肝细胞癌患者生存率,肿瘤剂量的提高尤为关键[11],但提高肿瘤剂量的同时也导致正常组织并发症特别是放射性肝病(RILD)发生率的提升,因此对于肝细胞癌选择合适的放疗技术尤其关键。
表2 3组计划危及器官的剂量学比较(n=10,±s)Tab.2 Com parison of dosim etric param eters of organs-at-risk am ong 3 different p lans(n=10,M ean±SD)
表2 3组计划危及器官的剂量学比较(n=10,±s)Tab.2 Com parison of dosim etric param eters of organs-at-risk am ong 3 different p lans(n=10,M ean±SD)
#表示HT与C-VMAT相比;*表示HT与NC-VMAT相比;&表示C-VMAT与NC-VMAT相比。表中D值单位为Gy,V值单位为%
images/BZ_20_213_426_372_500.pngimages/BZ_20_372_426_543_500.pngimages/BZ_20_543_426_715_500.pngimages/BZ_20_715_426_904_500.pngimages/BZ_20_904_426_998_500.pngimages/BZ_20_998_426_1093_500.png P值&脊髓Dmax胃V30胃Dmean左肾V20左肾Dmean右肾V20右肾Dmean 35.90±8.77 7.35±8.09 14.13±6.45 2.89±6.14 3.09±3.90 4.75±7.53 4.12±4.19 35.82±8.51 8.49±7.05 12.40±6.00 4.12±6.20 3.21±4.27 6.06±7.20 4.59±4.13 31.93±10.21 6.89±8.25 11.46±5.50 1.13±3.40 4.13±4.07 4.03±6.84 5.71±4.75 0.97 0.43 0.06 0.42 0.82 0.43 0.44 0.06 0.78 0.05 0.40 0.10 0.78 0.08 0.02 0.06 0.16 0.15 0.03 0.33 0.03
表3 3组计划正常肝脏的剂量学比较(n=10,±s)Tab.3 Com parison of dosimetric parameters of normal liver tissues am ong 3 different p lans(n=10,M ean±SD)
表3 3组计划正常肝脏的剂量学比较(n=10,±s)Tab.3 Com parison of dosimetric parameters of normal liver tissues am ong 3 different p lans(n=10,M ean±SD)
#表示HT与C-VMAT相比;*表示HT与NC-VMAT相比;&表示C-VMAT与NC-VMAT相比。表中D值单位为Gy,V值单位为%
参数HT C-VMAT NC-VMAT P值#P值*P值&V5 V10 V20 V30 V40 V50 Dmean 64.84±13.72 53.81±10.87 28.62±7.12 16.03±7.50 9.98±6.46 5.39±4.17 15.50±3.76 63.86±15.17 52.34±12.88 31.37±8.36 18.59±7.48 12.00±6.62 6.70±5.33 16.27±4.21 59.65±14.18 44.41±10.71 27.30±8.67 17.34±7.56 11.58±6.30 6.55±4.62 14.93±3.99 0.57 0.51 0.12 0.06 0.04 0.04 0.18 0.00 0.00 0.37 0.14 0.08 0.09 0.22 0.01 0.00 0.00 0.33 0.41 0.72 0.00
HT采用无均整块设计,剂量率高达到880 MU/min,采用二元气动MLC并且机架360°连续旋转,因此具有非常高强度的剂量调制能力,可实现靶区剂量高度均匀和周围正常组织高剂量区的保护。Zhao等[12]分析HT、IMRT和3D-CRT在肝癌放射治疗中的治疗效果,结果显示HT在靶区剂量优化和OAR保护上具有优势。Yoon等[13]报道HT在未增加不良反应的同时,提高了肝癌治疗的临床疗效,延长患者生存时间。
非共面技术在肿瘤的放射治疗中已有广泛应用,与共面技术相比,非共面具有改善靶区剂量分布及降低危及器官剂量的特点。胡睿等[14]研究表明非共面IMRT计划能够在改善晚期肺癌靶区剂量分布的同时降低肺的受量。Panet-Raymond等[15]将非共面IMRT及NC-VMAT应用于脑胶质瘤,并通过对比发现非共面技术可以有效降低肿瘤靶区对侧垂体前叶、对侧视网膜及对侧颞叶的等效均匀剂量。对于肝细胞癌的放疗,也有学者认为采用非共面技术可以有效减少肝脏的低剂量区体积,改善患者的肝损伤[16]。
本研究结果显示,3种治疗计划均能够满足临床需求。HT计划的靶区Dmax、Dmean、D2及HI均优于C-VMAT和NC-VMAT,而NC-VMAT与C-VMAT计划的靶区剂量参数方面差异不大,表明HT具有强大的剂量调制能力,可以明显改善靶区剂量分布。3种治疗计划的靶区CI差异不显著,表明3种治疗计划均能使处方剂量线紧紧围绕靶区,都能产生较好的靶区适形度。RILD是肝癌放疗首要考虑的因素,虽然RILD与肝功能、乙型肝炎病毒携带状态、肝硬化程度及等多因素有关[17],但可以通过选择合适的放疗技术降低正常肝组织照射剂量,从而减少RILD的发生率。本文3组治疗计划中,与HT、C-VMAT相比,NC-VMAT技术能够明显减少正常肝脏低剂量区的体积,这是由于NC-VMAT采用非共面半弧照射,而C-VMAT及HT则是360°全弧共面照射,因此NC-VMAT计划中卷入照射野内的正常肝脏体积最小。有学者认为正常肝脏低剂量体积的增加所产生的临床意义尚不明确[18],而也有学者认为肝癌放疗应保留一部分正常肝脏组织不受放射,利用这部分肝脏组织的再生能力可减少RILD的发生。C-VMAT和NC-VMAT的肝脏高剂量区体积方面差异不大,但由于HT具有更大的剂量跌落梯度,因此HT计划高剂量区包绕肝脏的体积最小。Chen等[19]、Yamada等[20]研究发现在肝脏不同的高剂量区参数中,肝脏的V30是避免引发RILD的一个重要参数。本研究中HT与C-VMAT、NC-VMAT相比,V30体积分别减少了2.5%及1.3%(P=0.06和0.14),表明HT能够减少RILD的发生率,对肝癌的放射治疗起到积极作用。3种计划的肝脏Dmean差别不大,但NC-VMAT明显优于C-VMAT,表明与共面技术相比,在靶区剂量分布差异不大的情况之下,非共面技术能够减少正常肝脏的平均剂量。
综上所述,VMAT和HT技术治疗肝癌均能满足处方剂量要求,且对周围正常组织保护均在剂量要求范围内。HT技术能带来更高的靶区均匀性,而且对靶区周围OAR起到更好的保护作用,特别是能够明显降低正常肝脏组织的V30体积,但HT治疗时间长于VMAT,因此,在临床应用中可以根据患者情况优先选用HT或NC-VMAT技术行肝细胞癌的放射治疗。

