去甲基川陈皮素对前列腺癌细胞PC3和DU145的抗癌活性研究
谷悦


摘要 [目的]研究去甲基川陈皮素(5-demethylnobiletin,5DN)对前列腺癌细胞活性的影响。[方法]通过MTT法检测5DN对PC3和DU145细胞的毒性。运用DAPI细胞核染色、实时荧光定量PCR、蛋白免疫印迹法、细胞划痕试验探究5DN对前列腺癌细胞凋亡、迁移的影响。[结果]5DN对PC3和DU145细胞增殖有明显的抑制作用,IC50分别为49.33、54.14 μmol/L。5DN处理后在2个细胞系中抑制细胞凋亡基因(Bcl-2、AKT1、AKT2)的mRNA的转录水平显著降低,促进凋亡基因(caspase-3、Bax)的转录水平显著升高。DU145中促进凋亡基因PTEN的mRNA的转录水平显著升高,促凋亡蛋白caspase 9的表达量显著升高。同时,5DN能有效抑制PC3细胞的迁移。[结论] 5DN能促進前列腺癌细胞的凋亡并抑制它的增殖和迁移。
关键词 去甲基川陈皮素;前列腺癌细胞;抗癌活性
中图分类号 R285文献标识码 A
文章编号 0517-6611(2019)13-0166-05
doi:10.3969/j.issn.0517-6611.2019.13.051
开放科学(资源服务)标识码(OSID):
Study on Anticancer Activity of 5demethylnobiletin against Prostate Cancer Cells PC3 and DU145
Abstract [Objective] The aim was to study the effect of 5demethylnobiletin (5DN) on the activity of prostate cancer cells. [Method] The toxicity of 5DN to PC3 and DU145 cells was detected by MTT assay.DAPI nucleic acid staining, RTqPCR, Western blotting, Wound healing assay were used to investigate the effects of 5DN on apoptosis, proliferation and migration of prostate cancer cells. [Result] 5DN significantly inhibited the proliferation of PC3 and DU145 cells with IC50 of 49.33 and 54.14 μmol/L, respectively. After 5DN treatment, the transcriptional levels of genes that inhibit apoptosis, such as Bcl2, AKT1, and AKT2, were significantly decreased, and the transcriptional levels of apoptosispromoting genes such as caspase3 and Bax were significantly increased in two cell lines. In DU145, the transcription level of PTEN mRNA was significantly increased, and the expression level of caspase 9 protein was significantly increased. At the same time, 5DN could effectively inhibit the migration of PC3 cells. [Conclusion] 5DN can induce the apoptosis of prostate cancer cells and inhibit its proliferation and migration.
Key words 5demethylnobiletin;Prostate cancer;Anticancer activity
基金项目 国家自然科学基金项目(31772260)。
作者简介 谷悦(1993—),女,重庆人,硕士研究生,研究方向:果品营养与质量安全。
收稿日期 2019-02-22
前列腺癌是中老年男性泌尿生殖系统最常见的恶性肿瘤之一[1],发病率在全球呈逐年升高的趋势[2]。虽然我国前列腺癌的发病率低于西方国家,但前列腺癌发展速度迅猛、致死率高,随着我国人口的老龄化前列腺癌患病的人数将不断增多[3]。目前,前列腺癌的治疗方法主要有手术治疗、放疗、化疗、内分泌治疗等[4]。但传统的治疗方法效果不理想,复发率高,还会产生肿瘤耐药性,影响化疗效果[5]。因此,寻找副作用小、药效好的抗肿瘤化合物显得更加必要。
多甲氧基黄酮(polymethoxylated flavones,PMFs)是柑橘属植物特有的,一类高度甲氧基化的黄酮类化合物(flavanoids)[6]。研究表明,PMFs具有一系列生物活性,包括预防糖尿病[7]、心脑血管疾病[8],抗氧化[9]、抗炎和抗癌作用[10]。在已经鉴定的70多种PMFs中[11],去甲基多甲氧基黄酮作为PMFs的一个独特的亚类,具有很强的抗癌活性,包括肺癌[12]、结肠癌[13]和乳腺癌[14]。去甲基川陈皮素(5-demethylnobiletin,5DN)是柑橘类水果中含量最丰富的去甲基多甲氧基黄酮。研究表明,5DN能促进肺癌细胞中聚合微管蛋白的形成,通过JNK活化导致肺癌细胞G2/M期阻滞,从而有效抑制肺癌细胞的增殖[15]。膳食5DN能抑制香烟致癌物NNK诱导的小鼠肺肿瘤发生[16]。但是,5DN对人前列腺癌细胞的活性影响还鲜见报道。
该研究以人源前列腺癌细胞系PC3和DU145为细胞模型,研究5DN对前列腺癌细胞的增殖、凋亡、迁移的影响,寻找一种天然化合物为前列腺癌的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 研究对象。去甲基川陈皮素(5DN)(纯度≥98%)来自Li等[17]对柑橘大红袍的PMFs分离纯化研究。
1.1.2 试验细胞系。人源前列腺癌细胞PC3和DU145系来自重庆文理学院创新靶向药物国际研究院。
1.1.3 试剂。胎牛血清(FBS)购于美国Sigma Aldrich公司;青霉素-链霉素购于美国Gibco公司;DMEM和F-12K培养基购于美国Gibco公司;MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽)溶液、DMSO(二甲基亚砜)溶液、DAPI(40,60-二脒基-2-苯基吲哚)细胞核染色液、结晶紫染色液,均购自美国Sigma-Aldrich公司;合成引物购于中国华大基因公司;caspase 9和β-actin 蛋白抗体购自美国Cell Signaling Technology公司;BCA试剂盒购于中国碧云天公司;PVDF膜购于美国Merck Millipore公司;试验使用的所有其他化学品均来自美国Sigma-Aldrich公司。
1.1.4 仪器。双色红外激光成像系统(Odyssey CLx),美国LI-COR公司;酶标仪(Cytation 5),美国Bio TeK公司;小型垂直电泳槽(Mini-PROTEAN Tetra),美国Bio-Rad公司;倒置荧光显微镜(ix73),日本Olympus公司;细胞培养箱(BB15),美国Thermo Electron公司;PCR仪(S1000),美国Bio-Rad公司;超纯水系统(Milli-Q Advantage A10),美国Millipore公司;实时荧光定量PCR仪(LightCycler96),瑞士Roche公司。
1.2 方法
1.2.1 细胞培养。PC3和DU145人前列腺癌细胞系细胞分别培养在含10%(V/V)、胎牛血清、1%青霉素-链霉素(V/V)、DMEM和F-12K培养基中,在37 ℃、5%CO2的培养箱中连续培养备用。
1.2.2 细胞毒性试验(MTT)。采用MTT法检测5DN对人源性前列腺癌PC3和DU145细胞的体外抗增殖活性。将PC3和DU145细胞以4×103个细胞/孔的密度接种在96孔微量培养板中孵育24 h,当孔中细胞贴壁密度在70%~80%时,加入不同浓度(0~150 μmol/L)的5DN处理细胞,设置空白对照,平行设置6个复孔。培养48 h后,向每个孔中加入20 μL MTT(5 mg/mL)溶液,在37 ℃、5% CO2下继续培养4 h后,吸弃上清液,每个孔中加入150 μL DMSO溶液,摇床振荡10 min,使结晶体完全溶解。最后通过酶标仪在 λ562nm处读数,计算细胞存活率,并采用Logit法计算细胞50%抑制浓度(IC50)。细胞存活率表示为:细胞存活率= OD检测/OD对照×100%。
1.2.3 DAPI细胞核染色。PC3和DU145细胞(1×104个/孔)分别接种于24孔板中,置37 ℃、5% CO2培养箱中培养24 h,当贴壁细胞密度达到70%~80%,加入不同浓度的5DN(0、50、75 μmol/L)处理细胞,继续在培养箱中培养48 h。然后弃去上清液,用PBS洗涤2次,并用4%多聚甲醛固定15 min。用PBS洗涤固定的细胞,并用DAPI(100 ng/mL)染色15 min。最后,除去DAPI溶液,用PBS洗涤细胞2次。 通过荧光显微镜观察拍照,最大吸收波长为364 nm,最大发射波长为454 nm。
1.2.4 细胞划痕试验。 PC3细胞(5×104个/孔)接种于6孔板中,置37 ℃、5% CO2培养箱中培养24 h,当贴壁细胞密度达到90%,第2天换低浓度血清培养基,使用1 mL枪头垂直对准6孔板的下端中央部位,向上轻推形成划痕,划十字。用PBS清洗掉悬浮的细胞后加入5DN(75 μmol/L)处理细胞,设置空白对照组,平行设置3个复孔。倒置荧光显微镜,0 h拍照,放入培养箱继续培养72 h后再拍照。用软件ImageJ 计算分析迁移面积。迁移面积=72 h的细胞面积-0 h的细胞面积。
1.2.5 实时荧光定量PCR。 PC3和DU145细胞经不同浓度5DN处理后,收获细胞,采用试剂盒提取细胞中的总RNA,检测RNA的浓度和纯度。逆转录合成cDNA,反转录产物置于-20 ℃保存备用。将制备好的cDNA进行PCR扩增,设计引物序列(表1),反应条件:95 ℃ 1 min,95 ℃ 20 s,45 个循环; 60 ℃ 60 s。β-actin基因作为内参。完成后采用PCR仪自带软件qbase plus 进行分析。
1.2.6 蛋白免疫印迹法。 PC3和DU145细胞经不同浓度5DN处理后,收获细胞,使用BCA试剂盒测定浓度。制备SDS-PAGE分离胶,将配好的PAGE胶放入电泳槽中,加入适量电泳缓冲液,通过SDS-PAGE凝胶电泳分离等量的蛋白样品(120 V、90 min)。电泳后在4 ℃下100 V转120 min进行转膜。室温下,将膜在含5%脱脂奶粉PBS溶液中封闭1 h,并在4 ℃下孵育一抗(caspase 9 1∶1 000,β-actin 1∶1 000)过夜。在室温下孵育二抗1 h。各抗体均用TBST溶液洗涤3次,6 min/次。然后将膜置于双色红外激光成像系统中检测。使用ImageJ读取相关条带灰度值。
1.3 统计分析 采用SPSS 19.0进行差异显著性分析(P<0.05),采用GraphPad Prism 5绘图。
2 結果与分析
2.1 5DN对PC3和DU145 的细胞毒性
采用MTT法检测5DN对人源性前列腺癌PC3和DU145细胞的体外抗增殖活性。用一定浓度范围的5DN(0~150 μmol/L)处理PC3和DU145细胞48 h后,PC3和DU145细胞的IC50分别为4933、54.14 μmol/L(图1),PC3细胞对5DN可能更敏感。结果显示,5DN对PC3和DU145细胞增殖有明显的抑制作用。PC3和DU145细胞在一定的浓度范围内都存在计量依赖性(图1),PC3细胞的计量依赖性较明显。
2.2 5DN诱导PC3和DU145 产生凋亡小体
为了研究5DN对癌细胞的抑制增殖活性是否与细胞的凋亡有关,采用DAPI细胞核酸染色液对经过不同浓度5DN(0、50、75 μmol/L)处理48 h的PC3和DU145细胞进行染色。结果如图2所示,DU145细胞在75 μmol/L 5DN 后出现了核收缩,染色质浓缩并形成凋亡小体(红色箭头);PC3细胞在50和75 μmol/L都出现了凋亡小体,75 μmol/L处理组凋亡小体明显增多。说明5DN对PC3和DU145的细胞毒性可能与凋亡相关。
2.3 5DN诱导PC3和DU145细胞的凋亡
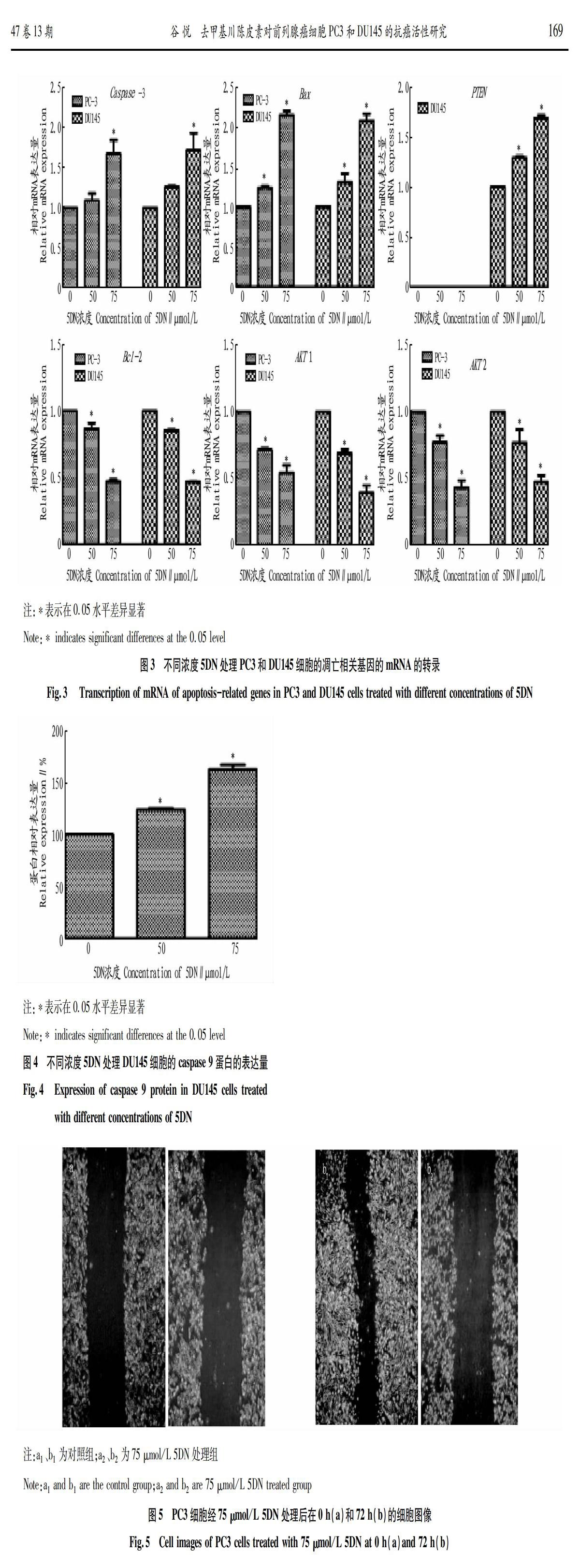
为了研究5DN引起PC3和DU145细胞凋亡的机制,对与凋亡相关的一些重要基因的mRNA的转录水平和蛋白表达量进行了研究。PC3和DU145细胞经5DN处理后,75 μmol/L 5DN处理组的caspase-3的mRNA的转录水平显著增加,Bax 的mRNA的转录水平随着5DN的浓度增加显著升高,75 μmol/L处理组的mRNA的转录水平为对照的2倍(图3)。由于PC3细胞PTEN基因缺失,检测不到PTEN基因的mRNA转录。但是在DU145细胞中PTEN基因的转录水平随着5DN的浓度增加显著升高(图3)。在2个细胞系中抑制细胞凋亡的基因如Bcl-2、AKT1、AKT2 的mRNA的转录水平随着5DN的浓度增加都显著降低(图3)。DU145经5DN处理后caspase 9蛋白的表达量随着5DN的浓度增加显著升高(图4)。结果表明5DN可能通过线粒体信号转导途径诱导细胞的凋亡。
2.4 5DN抑制PC3细胞的迁移
通过细胞划痕试验研究5DN对PC3细胞迁移的影响。 72 h后75 μmol/L 5DN处理组的迁移率为7.82%,对照组细胞迁移率为52.58%。 5DN处理组与对照组细胞相比,迁移率减少44.76%。同时对促进细胞迁移基因c-Myc的mRNA的转录水平进行了研究。结果表明,随着5DN浓度的增加,c-Myc的mRNA的转录水平显著降低。进一步说明,5DN能够抑制PC3细胞的迁移(图5~6)。
3 结论与讨论
由于PMFs独特的多甲氧基结构,很多PMFs类物质对前列腺癌细胞都存在一定的抗癌活性[18]。据文献报道,橘皮素通过靶向PI3K/Akt/mTOR信号通路诱导PC3细胞上皮-间质转化的重编程,从而抑制前列腺癌细胞的增殖[19-20]。川陈皮素通过AKT通路抑制前列腺癌PC-3和DU-145细胞的活性[21]。
该研究通过细胞毒性检测发现5DN对人源前列腺癌PC3和DU145细胞的活性具有显著的抑制作用,这种抑制作用可能与细胞的凋亡相关。细胞凋亡是基因控制的细胞自主性死亡过程,许多抗肿瘤药物都通过启动细胞凋亡机制来杀死肿瘤细胞[22]。其中线粒体信号转导途径诱导细胞凋亡极为重要。线粒体介导的凋亡中包括很多与细胞凋亡相关的基因如caspase家族基因和Bcl-2家族基因[23]。该研究显示5DN能抑制抗凋亡基因Bcl-2、AKT1、AKT2 的mRNA的转录,促进凋亡基因caspase-3、PTEN和Bax的转录。caspase-9作为一种促凋亡因子,是线粒体介导的细胞凋亡中的关键生物标志物,也是caspase家族中引起细胞凋亡的最关键成分之一[24]。DU145细胞经5DN处理后能上调caspase 9蛋白的表达。综上所述,表明5DN可能通过线粒体信号转导途径诱导细胞的凋亡。癌细胞的转移通常是由于癌细胞具有很强的迁移能力。试验发现,5DN能有效抑制前列腺癌细胞的迁移。该研究虽然发现5DN能诱导前列腺癌细胞的凋亡,但是其具体的作用信号通路尚不明确,还有待进一步研究。
该研究首次研究了5DN对前列腺癌细胞的抗癌活性,发现5DN通过促进前列腺癌细胞的凋亡和抑制它的增殖和迁移,抑制PC3和DU145细胞的活性。上述体外试验结果为5DN的体内抗肿瘤活性研究以及进一步应用于临床治疗奠定了试验基础,也为寻找有效治疗前列腺癌的药物提供了新思路。
参考文献
[1] TANEJA S S.Urological oncology:Prostate cancer[J].Journal of urology,2014,191(3):656.
[2] GILES G G.Prostate cancer[M]//QUAH S R.International encyclopedia of public health.2nd edition.Oxford:Academic Press,2017:51-59.
[3] ZHANG K,BANGMA C H,ROOBOL M J.Prostate cancer screening in Europe and Asia[J].Asian J Urol,2017,4(2):86-95.
[4] LOU D Y,FONG L.Neoadjuvant therapy for localized prostate cancer:Examining mechanism of action and efficacy within the tumor[J].Urologic oncology,2016,34(4):182-192.
[5] FARHAT A,JIANG D,CUI D,et al.An integrative model of prostate cancer interaction with the bone microenvironment[J].Mathematical biosciences,2017,294:1-14.
[6] ZHANG H,XI W P,ZHOU Z Q,et al.Bioactivities and structure of polymethoxylated flavones in citrus[J].Journal of food agriculture & environment,2013,11(2):237-242.
[7] 张元梅,周志钦.柑橘生物活性物质及其心血管疾病防治作用研究进展[J].中药材,2011,34(11):1799-1804.
[8] 靖丽,周志钦.柑橘果实生物活性物质与糖尿病防治研究进展[J].果树学报,2011,28(2):313-320.
[9] ZOU Z,XI W P,HU Y,et al.Antioxidant activity of Citrus fruits[J].Food chemistry,2016,196:885-896.
[10] MANTHEY J A,GUTHRIE N,GROHMANN K.Biological properties of
citrus flavonoids pertaining to cancer and inflammation[J].Current medicinal chemistry,2001,8(2):135-153.
[11] ZHANG J Y,LI N,CHE Y Y,et al.Characterization of seventy polymethoxylated flavonoids(PMFs)in the leaves of Murraya paniculata by online highperformance liquid chromatography coupled to photodiode array detection and electrospray tandem mass spectrometry[J].Journal of pharmaceutical and biomedical analysis,2011,56(5):950-961.
[12] XIAO H,YANG C S,LI S M,et al.Monodemethylated polymethoxyflavones from sweet orange(Citrus sinensis)peel inhibit growth of human lung cancer cells by apoptosis[J].Molecular nutrition & food research,2009,53(3):398-406.
[13] QIU P S,DONG P,GUAN H S,et al.Inhibitory effects of 5hydroxy polymethoxyflavones on colon cancer cells[J].Molecular nutrition & food research,2010,542(S1):244-252.
[14] SERGEEV I N,HO C,LI S,et al.Apoptosisinducing activity of hydroxylated polymethoxyflavones and polymethoxyflavones from orange peel in human breast cancer cells[J].Molecular nutrition & food research,2007,51(12):1478-1484.
[15] CHEN Y K,WANG H C,HO C T,et al.5Demethylnobiletin promotes the formation of polymerized tubulin,leads to G2/M phase arrest and induces autophagy via JNK activation in human lung cancer cells[J].Journal of nutritional biochemistry,2015,26(5):484-504.
[16] SONG M Y,WU X,CHAROENSINPHON N,et al.Dietary 5demethylnobiletin inhibits cigarette carcinogen NNKinduced lung tumorigenesis in mice[J].Food & function,2017,8(3):954-963.
[17] LI Z Q,ZHAO Z Y,ZHOU Z Q.Simultaneous separation and purification of five polymethoxylated flavones from "Dahongpao" tangerine(Citrus tangerina Tanaka)using macroporous adsorptive resins combined with prepHPLC[J].Molecules,2018,23:1-17.
[18] GAO Z,GAO W,ZENG S L,et al.Chemical structures,bioactivities and molecular mechanisms of citrus polymethoxyflavones[J].Journal of functional foods,2018,40:498-509.
[19] ZHU W B,XIAO N,LIU X J.Dietary flavonoid tangeretin induces reprogramming of epithelial to mesenchymal transition in prostate cancer cells by targeting the PI3K/Akt/mTOR signaling pathway[J].Oncology letters,2018,15(1):433-440.
[20] CHANG L,GRAHAM P H,NI J,et al.Targeting PI3K/Akt/mTOR signaling pathway in the treatment of prostate cancer radioresistance[J].Critical reviews in oncology hematology,2015,96(3):507-517.
[21] CHEN J C,CREED A,CHEN A Y,et al.Nobiletin suppresses cell viability through AKT Pathways in PC3 and DU145 prostate cancer cells[J].BMC pharmacology & toxicology,2014,15:1-10.
[22] 张永亮,陈修煦,来茂德.化疗药物诱导的肿瘤细胞凋亡和相关因子的调控[J].国外医学(遺传学分册),2002,25(3):121-126.
[23] 王德成,高洪.细胞凋亡信号转导途径及调控的研究进展[J].动物医学进展,2003,24(6):4-7.
[24] 赵岩,孙健,吴影,等.结直肠癌中Survivin、Caspase 9和Ki-67表达的相关性及临床意义[J].临床与实验病理学杂志,2017,33(4):435-438.

