利用全自动凯氏定氮仪测定大豆粗蛋白含量的条件研究
游思亮 王青
摘要 [目的]研究多种因素对大豆粗蛋白含量测定的影响,以期获得最优化的试验条件。[方法]利用全自动凯氏定氮仪比较不同称样量、催化剂比例、硫酸用量、消化时间、消化温度条件下测定的大豆粗蛋白含量。[结果]当只改变某一种试验条件的水平时,大豆粗蛋白含量测定结果之间差异较大,有的甚至达到极显著水平。针对大豆样本,较优化的试验条件是称样量0.5 g、催化剂用量比例K2SO4/CuSO4·5H2O为6/0.2(g/g)、硫酸用量为8 mL、消化时间105 min、消化温度420 ℃。仪器测定硫酸铵的回收率为100.26%,符合定量的要求。[结论]该研究为其他相关研究提供方法借鉴。
关键词 全自动凯氏定氮仪;大豆;粗蛋白含量
中图分类号 TS207.3文献标识码 A
文章编号 0517-6611(2019)14-0213-03
doi:10.3969/j.issn.0517-6611.2019.14.063
开放科学(资源服务)标识码(OSID):
Abstract [Objective]The research aimed to study the effects of various factors on the determination of soybean crude protein content in order to obtain optimal experimental conditions.[Method]Soybean crude protein content was measured by using automatic kjeldahl analyzer under different conditions, which include sample amount, ratio of catalyst, sulfuric acid amount, digesting time and digesting temperature. [Result]When only the level of a certain test condition was changed, the difference between the determination results of the soybean crude protein content was large, and some even reached a very significant level.For the soybean samples, the optimized experimental conditions were 0.5 g soybean sample, the ratio of catalyst to K2SO4/CuSO4·5H2O was 6 g/0.2 g, the amount of sulfuric acid was 8 mL, the digestion time was 105 min, and the digestion temperature was 420 ℃.The recovery of (NH4)2SO4 by using automatic kjeldahl analyzer was 100.26%, which was suitable for quantitative analysis.[Conclusion]This study provides a methodological reference for other related research.
Key words Automatic kjeldahl analyzer;Soybean;Crude protein content
作者简介 游思亮(1984—),男,湖北武汉人,实验师,硕士,从事作物遗传分析与生理生化检测研究。
收稿日期 2019-01-16
大豆作为我国重要的粮食作物,已有5 000多年的栽培历史,其种子含有丰富的植物蛋白。同时,大豆的蛋白质含量作为衡量大豆品质好坏的一项重要指标被重点关注。目前,测定大豆蛋白质含量的方法是国标方法GB/T 5511—2008中推荐的凯氏定氮法[1]。
凯氏定氮法自1833年被丹麦化学家凯道尔创立以来,因为其结果准确、成本低廉、操作相对简单等特点,被当作测定不同类型样本蛋白质含量的黄金标准[2],随后更是发展出了常量、微量、半微量凯氏定氮法以及自动定氮法。凯氏定氮法的原理是将催化剂和浓硫酸同时加入样品中,加热消化,样品中的有机氮与硫酸反应生成硫酸铵;然后加入过量的碱,并蒸馏使硫酸铵转化为氨气,氨气被硼酸吸收反应生成硼酸铵;随后用标准滴定盐酸溶液滴定,由于硼酸中有甲基红和溴甲酚绿指示剂,通过指示剂颜色变化可判断滴定终点,最后根据滴定盐酸溶液的消耗量计算样品中的含氮量,再乘以样品对应的蛋白质系数,得到样品的粗蛋白含量[3-5]。大豆及大豆制品中氮换算成蛋白质系数,国内多数标准采用6.25[6]。从凯氏定氮法的原理可知,这种方法实际上测的是样品中蛋白质和非蛋白质含氮物(如核酸、生物碱、含氮类脂等),也就是粗蛋白含量[7]。而且,凯氏定氮法测定样品总氮含量时有一定的局限性,这种方法无法测定土壤中N-O或N-N键结合的氮化合物,如硝态氮、亚硝态氮、硝基、亚硝基、偶氮化合物[8]等,还需要做进一步改进。
全自动凯氏定氮仪可同时消化多個样品,且自动完成后续的蒸馏、滴定步骤,减少了人为操作导致的试验误差,目前被研究者广泛使用[9]。也正因为测定步骤不需要人为参与,因此,对于使用全自动凯氏定氮仪的用户来说,影响试验结果最关键的步骤是样品的消化。有学者讨论了一些影响消化的因素,但是不够全面[10]。笔者从多个方面详细比较了各因素对大豆粗蛋白含量的影响,以期获得最优化的试验条件,为即将开展的研究打下基础,也为相关研究者提供方法借鉴。
1 材料与方法
1.1 试验材料
1.1.1 仪器。Kjeltec8400全自动凯氏定氮仪(FOSS)、DT220消化仪(FOSS)、CT410旋风磨(FOSS)、BS214D分析天平(Sartorius)、Milli-Q超纯水机(Millipore)。
1.1.2 试剂。浓硫酸(AR);40%氢氧化钠(AR);1%硼酸(AR);指示剂0.1%甲基红和0.1%溴甲酚绿均用无水乙醇配制,每1 L硼酸溶液中加入7 mL甲基红和10 mL溴甲酚绿;滴定盐酸溶液(标定浓度为0.102 1 mol/L);配试剂所用的水均为去离子水。测定所用250 mL消化管均在试验前用超声波清洗仪清洗,然后用自来水和纯水冲洗并烘干。
1.1.3 试材。试验材料为遗传转化常用大豆品种杰克,由南京农业大学国家大豆改良中心提供。
1.2 试验设计
该研究根据蛋白质测定国家标准方法GB/T 5511—2008,利用Kjeltec8400全自动凯氏定氮仪测定大豆种子中的粗蛋白含量。根据仪器推荐方法,取破碎后混匀的大豆粉,研究样品量、催化剂比例、浓硫酸用量、消化时间、消化温度对大豆粗蛋白含量的影响。每次试验设置其中一项为变量,分别研究每个因素对测试结果的影响。设置样品量处理分别为0.25、0.50、0.75、1.00、1.50 g;催化剂(K2SO4/CuSO4·5H2O)比例处理分别为6/0.05、6/0.1、6/0.2、6/0.5、6/1.0(g/g);浓硫酸用量处理分别为6、8、10、12、15 mL;消化时间处理为60、75、90、105、120 min;消化温度处理为330、360、390、420、440 ℃(消化仪最高设置温度)、250 ℃+420 ℃(0.5 h+1 h)。每个处理设置3次重复,且每个测定批次都做3个空白对照(加催化剂和硫酸,不加样品)。
1.3 回收率的测定方法
将纯度>99.5%的硫酸铵在102 ℃烘4 h,准确称取0.15 g(精确至小数点后第4位)放入消化管,按照仪器设定程序测定硫酸铵的回收率,重复6次,以空的消化管作为空白对照,重复3次。
实际含氮量=(V-V0)×N×14.007×100/样品重量×100%;回收率=实际含氮量/21.09×100%,式中,V为滴定所用盐酸体积,V0为空白对照所用盐酸体积,N为滴定盐酸的当量浓度(精确至小数点后第4位),样品重量单位为mg。
2 结果与分析
2.1 称样量对大豆粗蛋白含量的影响
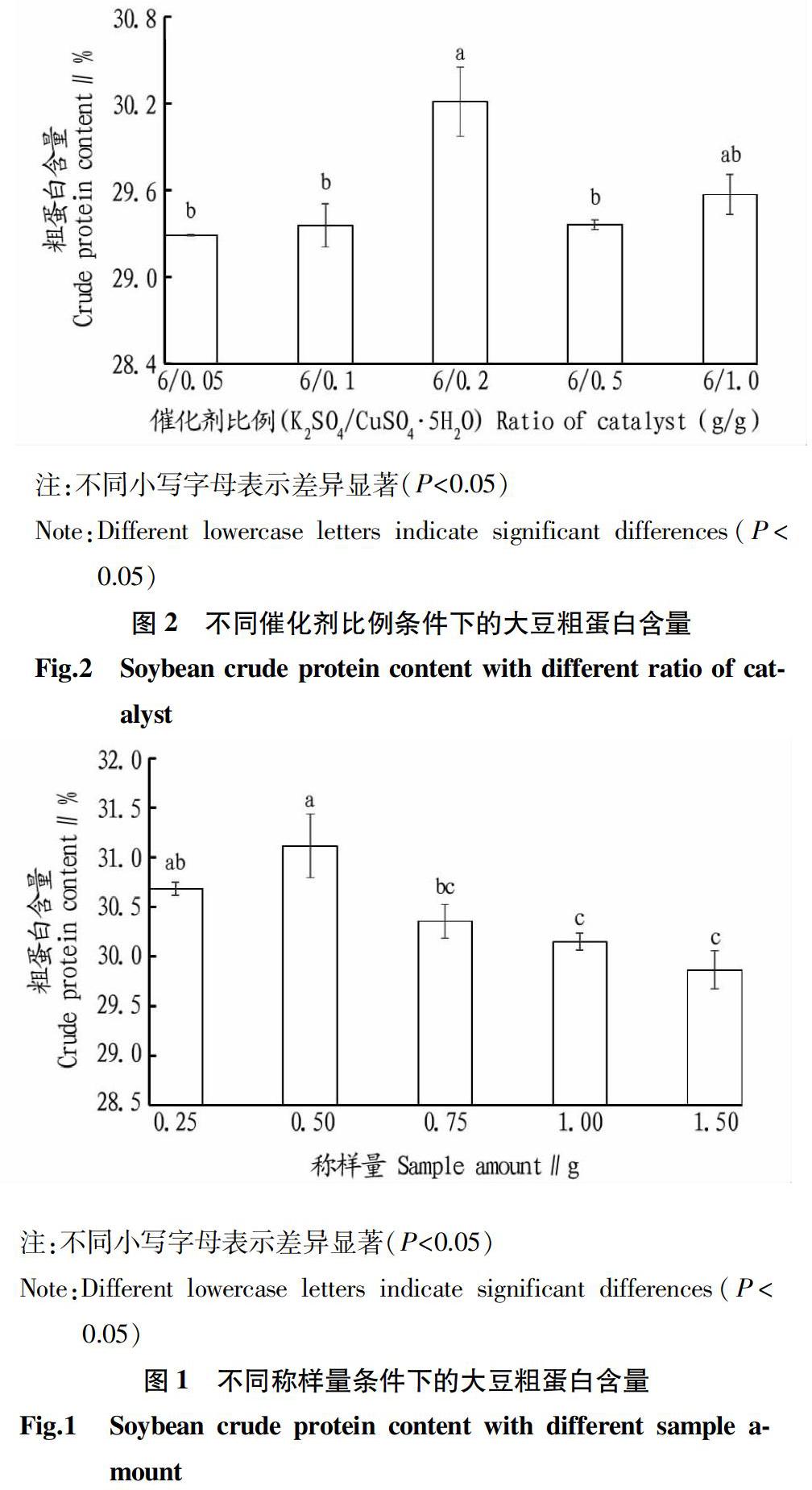
大豆属于粗蛋白含量比较高的样品,对于这类样品,需要适当控制样品总量,仪器要求的样品总含氮量不能超过200 mg,但是样品量太少会放大测试过程中的人为操作以及仪器误差,使测定结果不准。在K2SO4/CuSO4·5H2O为6 g/0.2 g、浓硫酸用量为10 mL、消化时间为90 min、消化温度为420 ℃时,不同称样量条件下测得的结果如图1所示。称样量为0.5 g时结果最大,且与称样量0.75 g结果差异显著,随着称样量增大,测量结果下降。这一点从试验情况可以验证,当称样量≤0.75 g时,消化液呈现清澈蓝绿色或者绿色;当称样量≥1.0 g时,消化液呈现浑浊的黑色,浑浊的黑色表明样品消化不完全。所以,对于大豆这种蛋白质含量比较高的样品,应该控制称样量不能超过0.75 g,以0.50 g左右为宜。
2.2 催化剂比例对大豆粗蛋白含量的影响
硫酸钾和硫酸铜作为催化剂在化学反应过程中有着不同的作用。硫酸钾可提高浓硫酸的沸点,促进有机物分解,硫酸铜可加快反应速度,并作为碱性反应指示剂。如果催化剂加入量太少,样品消化时间会延长,如果催化剂加入太多,样品消化不完全,会使结果偏低。在称样量为0.5 g、浓硫酸用量为10 mL、消化时间为90 min、消化温度为420 ℃时,不同的催化剂比例条件下测得的结果如图2所示。当催化剂比例K2SO4/CuSO4·5H2O为6 g/0.2 g时,测量结果最大,除了与6 g/1.0 g处理组结果差异不显著,与其他处理组均差异显著,所以,应该选择加入催化剂比例K2SO4/CuSO4·5H2O为6 g/0.2 g。
2.3 浓硫酸用量对大豆粗蛋白含量的影响
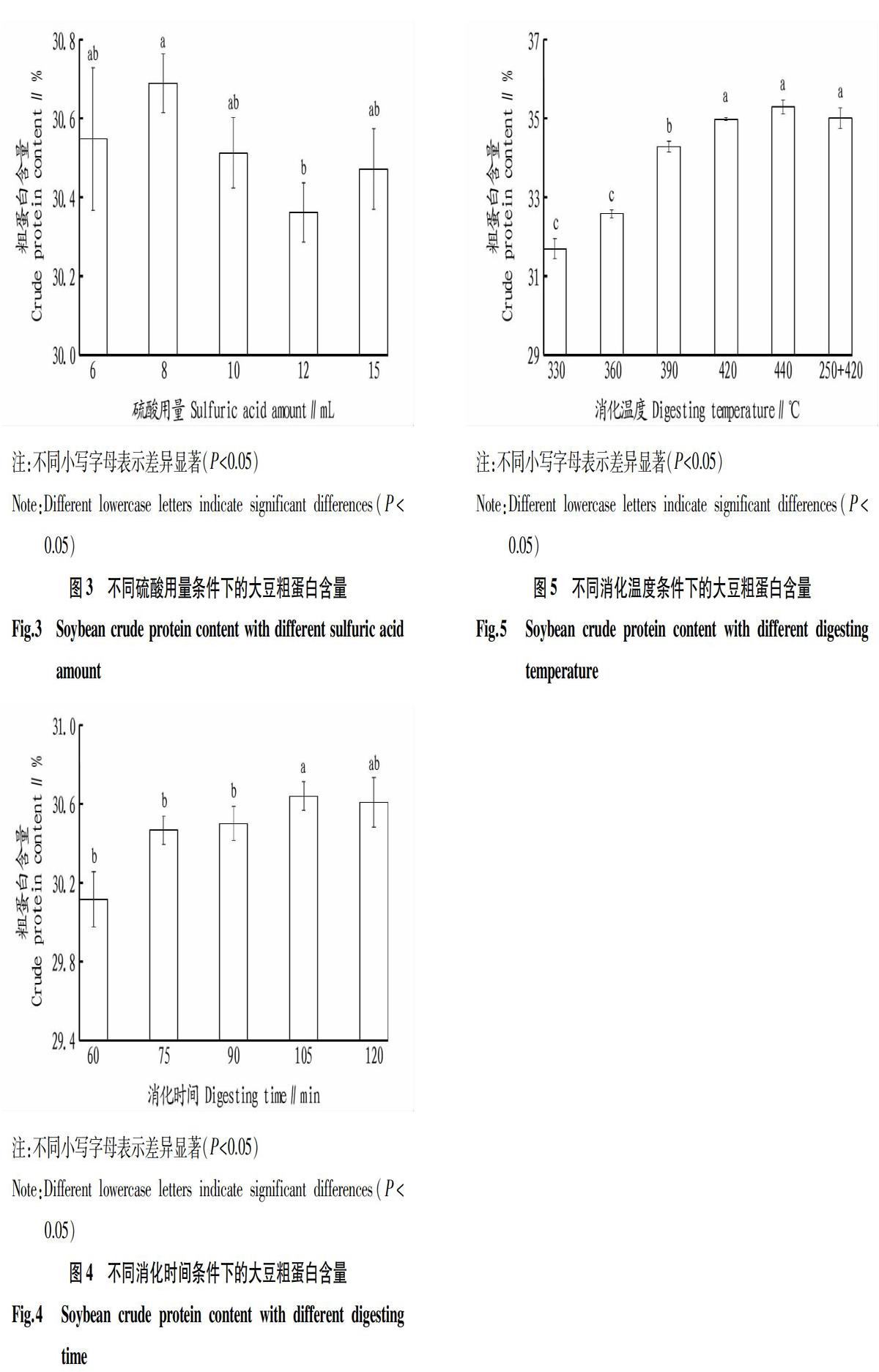
消化用的浓硫酸对纯度和浓度要求较高,应该使用分析纯及以上规格的浓硫酸。消化时如果浓硫酸用量过少,会导致样品无法完全分解,使得测试结果偏低,如果用量过多,会导致试剂浪费并产生环境污染。同时,浓硫酸的使用量需要根据样品的类型进行调整,对于高脂或高碳水化合物的样品,需要适当加大浓硫酸用量。目前常用的硫酸钾和浓硫酸添加比例有2种,一种是1 g样品中加入7 g硫酸钾和12 mL硫酸,另一种是1 g样品中加入10 g硫酸钾和20 mL硫酸[11]。 在称样量为0.5 g、K2SO4/CuSO4·5H2O为6 g/0.2 g、消化时间为90 min、消化温度为420 ℃时,不同浓硫酸使用量条件下测得的结果如图3所示。当硫酸用量在8 mL时,测量结果最大,显著高于12 mL处理组,与其他处理组差异不显著,所以,应选择8 mL硫酸用量比较合适。
2.4 消化时间对大豆粗蛋白含量的影响
消化时间太短会使得样品无法充分消化分解,试验结果偏低,消化时间太长则影响试验效率,一般消化时间以消化液变成蓝绿色清澈透明的液體之后,继续消化30 min为宜。在称样量为0.5 g、K2SO4/CuSO4·5H2O为6 g/0.2 g、浓硫酸用量为8 mL、消化温度为420 ℃时,不同消化时间条件下,测得的结果如图4所示。随着消化时间的延长,测定结果上升,在105 min时结果最大,105 min消化时间的结果除与120 min差异不显著外,与其他处理组结果差异显著,所以消化时间选定105 min比较合理。
2.5 消化温度对大豆粗蛋白含量的影响
较高的消化温度能保证样品被快速消化,但是在消化前段,由于蛋白质尚未转化成铵盐,温度过高会使含氮物质挥发,致使检测结果偏低。因此,消化前段温度应控制在250~300 ℃,后段可将温度控制在360~410 ℃[12]。在称样量为0.5 g、K2SO4/CuSO4·5H2O为6 g/0.2 g、浓硫酸用量为8 mL、消化时间为105 min时,不同消化温度条件下,测得的结果如图5所示,当消化温度高于420 ℃,测定结果之间差异不显著,而且低温加高温与直接高温处理组之间结果差异不明显,所以,实际操作过程中可以直接高温消化。390 ℃的处理组与420 ℃处理组差异达到显著水平,与440 ℃处理组差异达到极显著水平。而且随着消化温度继续降低,测定结果也随之降低,390 ℃与360 ℃处理组测定结果差异显著。综合以上结果,消化温度对大豆粗蛋白测定结果的影响巨大,对于大豆样品,应该选择≥420 ℃的消化温度。另外,由于消化仪的最高设置温度为440 ℃,为了仪器安全考虑,可以选择稍低一点的420 ℃作为消化温度。
2.6 仪器的准确性和稳定性验证试验
通过测定已知含氮量硫酸铵的回收率来评价凯氏定氮仪的准确性和稳定性,纯度≥99.5%的硫酸铵理论含氮量为21.09%。6次测定结果的回收率分别为99.26%、100.01%、100.58%、100.62%、100.60%、100.48%,仪器对硫酸铵的回收率平均值是100.26%,RSD为0.54%,符合回收率99.5%~100.5%的定量要求,说明仪器准确性和稳定性良好。
3 结论与讨论
利用Kjeltec8400全自动凯氏定氮仪来测定大豆种子粗蛋白含量,较为优化的消化条件为称样量0.5 g、催化剂比例K2SO4/CuSO4·5H2O为6 g/0.2 g、硫酸用量8 mL、消化时间105 min、消化温度420 ℃。
虽然凯氏定氮法有诸多优点,但不可否认它也有缺点,如检测时间长、所用试剂有很强的腐蚀性、测定的氮是总有机氮而不是蛋白质氮等。近年来,近红外光谱法作为一种新兴的蛋白质测定技术,由于其测定时间短、不用消耗任何化学试剂、试验过程无污染、样品基本不用预处理、结果准确性几乎可媲美传统凯氏定氮法等优点,正在越来越多的领域得到应用[13-17],在某些应用领域甚至有可能取代传统方法,有很好的应用前景。
参考文献
[1] 中华人民共和国卫生部.谷物和豆类 氮含量测定和粗蛋白质含量计算 凯氏法:GB/T 5511—2008[S].北京:中国标准出版社,2008.
[2] LYNCH J M,BARBANO D M.Kjeldahl nitrogen analysis as a reference method for protein determination in dairy products[J].J AOAC Int,1999,82(6):1389-1398.
[3] MICHALOWSKI T,ASUERO A G,WYBRANIEC S.The titration in the Kjeldahl method of nitrogen determination:Base or acid as titrant[J].J Chem Educ,2013,90(2):191-197.
[4] SEZPLAZA P,MICHALOWSKI T,NAVAS M J,et al.An overview of the Kjeldahl method of nitrogen determination.Part I.Early history,chemistry of the procedure,and titrimetric finish[J].Crit Rev Anal Chem,2013,43(4):178-223.
[5] SEZPLAZA P,NAVAS M J,WYBRAINIEC S,et al.An overview of the Kjeldahl method on nitrogen determination.Part II.Sampling preparation,working scale,instrumental finish,and quality control[J].Crit Rev Anal Chem,2013,43(4):224-272.
[6] 國家市场监督管理总局.饲料中粗蛋白的测定 凯氏定氮法:GB/T 6432—2018[S].北京:中国标准出版社,2018.
[7] 丁卫新.全自动定氮仪在小麦粗蛋白检验中的应用与研究[J].粮食加工,2012,37(4):24-26.
[8] KUBOTA T,OSHIDA T,YANAI K,et al.Improvement of the conditions for the determination of total nitrogen in fish meal in Kjeldahl method and its comparison with Dumas method[J].Bunseki Kagaku,2011,60(1):67-74.
[9] 史玮,孙莹,徐振斌.凯氏定氮法测定粮食蛋白质含量方法研究[J].粮食科技与经济,2013,38(5):31-32.
[10] 徐新娟,黄中文,王伟,等.全自动凯氏定氮仪测定大豆蛋白质方法的研究[J].黑龙江农业科学,2016(2):108-110,121.
[11] 马丹.凯氏定氮法测定食品中蛋白质含量[J].计量与测试技术,2008(6):57-58.
[12] 罗小芬.浅谈凯氏定氮法测定蛋白质准确度的操作技巧及关键点[J].现代食品,2017(19):99-100.
[13] DABKIEWICZ V E,DE MELLO PEREIRA ABRANTES S,CASSELLA R J.Development of a nondestructive method for determining protein nitrogen in a yellow fever vaccine by near infrared spectroscopy and multivariate calibration[J].Spectrochimica acta part A:Molecular and biomolecular spectroscopy,2018,201:170-177.
[14] INGLE P D,CHRISTIAN R,PUROHIT P,et al.Determination of protein content by NIR spectroscopy in protein powder mix products[J].J AOAC Int,2016,99(2):360-363.
[15] MOURYA V,KUMAR V,RANI A,et al.Nearinfrared reflectance spectroscopy for protein content in soybean flour and screening of germplasm across different countries[J].Agricultural research,2016,5(1):29-34.
[16] 温冰消,刘卫国,李虹桥,等.基于近红外法的鲜食大豆品质快速分析技术[J].分子植物育种,2018,16(12):4062-4067.
[17] 赵影,王文和,滕娇琴,等.两种仪器测定国产大豆粗蛋白含量的比较[J].粮食储藏,2018,47(4):37-39,44.

