新疆药桑叶醇提物3种活性初步研究
李炳钦,杨玲,*,汪河滨,陈龙,阿力腾阿依
(1.塔里木大学生命科学学院,塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300;2.北京化工大学生命科学与技术学院,北京市生物加工过程重点实验室,北京 100029)
新疆药桑在植物分类学上属桑科,桑属,黑桑种(Morus nigra L.)[1]。原产于伊朗,十六世纪引入新疆栽培。由于新疆光热资源丰富,环境恶劣,造成其成为及其罕见的22 倍体桑品种资源[2-3]。现广泛栽培于和田、阿克苏和喀什地区。药桑作为维吾尔族传统药材,具有多种功效,广泛用于消炎、补血和镇静[4]。现代药理学研究发现药桑中成分具有抗氧化、降血糖、降血脂、抗肿瘤等多种药理活性[5-7],引起国内外学者的广泛关注。
药桑叶作为药桑产物,每年产量巨大。有研究表明[6-8],药桑叶中营养物质和活性成分含量丰富,相比桑叶(Morus alba L.),药桑叶在总多糖、总黄酮和总生物碱等含量上优于桑叶,可利用价值较高。药桑中总黄酮、总生物碱在抗氧化、降血糖等方面发挥着重要作用[6]。然而目前在对药桑叶生物活性的研究不够全面深入彻底,对药桑叶综合利用开发缺少理论支持。因此,本试验通过研究药桑叶醇提物各萃取部位生物活性,为后续以生物活性为引导进行化合物分离提供活性依据,最终为综合开发利用药桑叶提供理论依据。
1 材料与方法
1.1 材料与试剂
药桑叶:2016年7月采自新疆和田地区,经塔里木大学邱爱军副教授鉴定为药桑(Morus nigra L.)植物叶片。药桑叶片阴干,碾碎备用。
1,1-二苯基-2-芳基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、4-硝基苯基-ɑ-D 吡喃葡萄糖苷(4-Nitrophenyl β-D-glucopyranoside,PNPG)、α-葡萄糖苷酶(40 U/mg~80 U/mg):美国 Sigma 公司;噻唑蓝(thiazoyl blue tetrazolium bromide ,MTT)溶液:赛诺普生物;DMSO 完全培养基:上海康稳生物科技有限公司;胎牛血清:上海哈灵生物科技有限公司;磷酸缓冲盐溶液(phosphate buffer saline,PBS)、RMPI-1640 培养基:Gibco 公司;阿卡波糖片:拜耳医药有限公司;维生素C:北京博鳌托大科技有限公司;石油醚、乙酸乙酯、正丁醇和95%乙醇等均为分析纯。
1.2 仪器与设备
ER-5205 旋转蒸发器:上海亚荣生化厂;S54 紫外可见分光光度计:上海棱光技术有限公司;CP224C 电子分析天平:奥豪斯仪器(上海)有限公司;Infinite M200 Pro 多功能酶标仪:北京世贸远东科学仪器有限公司;TDL-5-A 离心机:上海安亭科学仪器厂;DZF-6050 真空干燥箱:上海博迅实业有限公司。
1.3 方法
1.3.1 生物活性成分提取
取5 kg 阴干药桑叶,碾碎,以80%乙醇浸泡72 h,过滤,重复3 次,收集滤液,减压浓缩得到1.1 kg 流浸膏。将流浸膏分散至5 L 蒸馏水中,依次用石油醚、乙酸乙酯、正丁醇按照体积比(1 ∶1)进行萃取,重复3次,并浓缩至干,分别得到石油醚相、乙酸乙酯相、正丁醇相和水相。
1.3.2 抗肿瘤活性
采用MTT 测试法[9-10],测定样品对Hela 肿瘤细胞的抑制活性。
1.3.2.1 细胞培养
Hela 细胞株,用含10%胎牛血清RPIM-1640 培养基培养,选取对数生长期细胞进行试验。
1.3.2.2 试验分组
试验组:将一定量乙酸乙酯相,正丁醇相和水相样品加入到RPIM-1640 培养液,配置成0.005、0.010、0.050 mg/mL 和0.100 mg/mL 4 个浓度,取一定量样品溶液作用于HeLa 细胞,每组设4 个复孔。
阴性对照组:取等量RPIM-1640 培养液,作用于HeLa 细胞,设 4 个复孔。
空白对照组:取等量无菌水,作用于Hela 细胞,设4 个复孔。
1.3.2.3 MTT 法检测
取对数生长期细胞,调整细胞浓度为1.5×104/mL,接种于96 孔板,每孔加入细胞悬液0.2 mL。培养16 h后,吸出培养液,加入样品溶液0.2 mL。4 h 后每孔加入5 g/L MTT 溶液 10μL,继续培养4 h,每孔加入二甲基亚砜 100 μL,37 ℃振荡 5 min,用酶标仪在 570 nm 波长处测定其OD 值,按下述公式计算细胞抑制率。

1.3.3 抗氧化活性
通过测定DPPH 自由基清除能力[11-12],研究各萃取相体外抗氧化活性。
1.3.3.1 DPPH 自由基溶液的配置
准确称取DPPH 0.019 7 g,加入至250 mL 的容量瓶中,用体积分数为95%的乙醇定容,所得DPPH 溶液浓度即为0.2 mmol/L,静止30 min 后,避光保存。
1.3.3.2 样品液的配置
阳性组:取维生素C 适量,用体积分数为95%的乙醇配置浓度分别为 0.4、0.8、1.2、1.6、2.0 mg/mL 的样品溶液。
试验组:取石油醚相,乙酸乙酯相,正丁醇相,水相适量,用 95%的乙醇配置浓度分别为 0.4、0.8、1.2、1.6、2.0 mg/mL 的样品溶液。
1.3.3.3 测定方法
取样品溶液和DPPH 自由基溶液各2.0 mL 加入到试管内,混匀后,在恒温(28 ℃)条件下避光反应30 min,空白对照为体积分数为95%的乙醇,在517 nm处测定吸光度。每个样品做3 次平行样。DPPH 自由基清除率计算公式如下:

式中A1为样品溶液与DPPH 溶液反应后的吸光度值;A2为样品溶液与无水乙醇代替DPPH 溶液反应后的吸光度值;A0为无水乙醇与DPPH 反应后的吸光度值。
1.3.4 降血糖活性
通过测定体外α-葡萄糖苷酶抑制,评价各萃取相的降血糖活性。参照王贺等的测定方法[13-14],测定以对硝基苯-α-D 吡喃葡萄糖苷(PNPG)为底物的α-葡萄糖苷酶活性。
1.3.4.1 溶液的配制
底物溶液配制:准确称取PNPG 0.038 7g,用PBS缓冲液溶解并定容至100 mL,得2.5 mmol/L 的底物溶液。
α-葡萄糖苷酶溶液配制:准确量取0.1 mL α-葡萄糖苷酶溶液加至PBS 中,配制成0.72 U/mL 的溶液,避光保存。
样品溶液配制:取适量样品溶于一定量的PBS,配制成 0.2、0.4、0.6、0.8、1.0 mg/mL 的样品溶液。
阿卡波糖溶液配制:取适量阿卡波糖片剂溶于PBS,配制成 0.2、0.4、0.6、0.8、1.0 mg/mL 溶液。
1.3.4.2 反应体系
取 80 μL 的磷酸缓冲液,加入 16 μL 的待测样品,再加入16 μL 的α-葡萄糖苷酶,摇匀后置于37 ℃的恒温水浴锅中,反应20 min,然后再加入16 μL 的底物,反应终止后加入 100 μL 的 Na2CO3终止液(c=1 mol/L)。在400 nm 处测定在酶作用下的释放出的对硝基苯的吸光度值,计算抑制率。酶抑制试验重复3 次。具体反应见表1,计算公式如下:

式中:AⅠ为空白组吸光度值;AⅡ为试验组吸光度值;AⅢ为背景组吸光度值。

表1 α-葡萄糖苷酶活性抑制体系Table 1 α-glucosidase activity inhibition system μL
2 结果与分析
2.1 抗肿瘤活性
各萃取相对Hela 细胞的抑制率见表2。
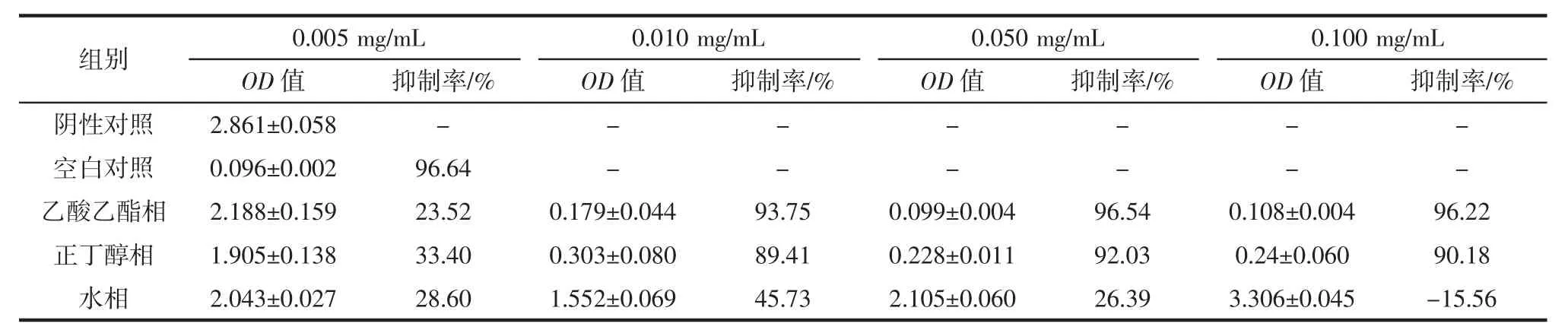
表2 各萃取相对Hela 细胞的抑制率Table 2 Inhibition of each part against Hela tumor cells
由表2数据可知,乙酸乙酯相和正丁醇相在样品浓度为0.005 mg/mL 时表现出对Hela 肿瘤细胞有一定的抑制作用。随着样品浓度增加,抑制效果也更加明显。当浓度达到0.010 mg/mL 时,乙酸乙酯相抑制率达到93.75%,正丁醇相抑制率达到89.41%,抑制效果显著。当乙酸乙酯相的浓度达到0.050 mg/mL 时,抑制率达到96.54%,这与空白对照组的抑制率接近。说明乙酸乙酯相中存在具有抑制Hela 肿瘤细胞增殖的优良化合物,从而说明乙酸乙酯相具有较高的开发利用价值。
水相数据表明,在浓度达到0.005 mg/mL 时,存在微弱抑制效果,但是当浓度达到0.010 mg/mL 时,抑制作用减弱,当达到0.050 mg/mL 时,抑制率达到-15.56%,说明水相中可能存在促进Hela 肿瘤细胞增殖的化学物质,这与王珊珊等[15]的研究发现有些药物可在一定程度上促进肿瘤细胞增殖这一现象存在一定程度上吻合。
此外,由于石油醚相在RPIM-1640 培养液中溶解性较差,未对其进行抗Hela 肿瘤细胞的活性试验
2.2 抗氧化活性
各相对DPPH 自由基的清除能力见图1。

图1 各相对DPPH 自由基的清除能力Fig.1 Scavenging effects of each part on DPPH
由图1可知,对各萃取相清除DPPH 自由基能力进行比较,乙酸乙酯相清除DPPH 自由基能力较强。在质量浓度0.4 mg/mL~2.0 mg/mL 范围内,各相对DPPH自由基的清除能力随浓度增加而增强。乙酸乙酯相和正丁醇相在低浓度时表现出良好的DPPH 自由基清除能力,然后随浓度增加清除率趋于平缓。石油醚相和水相对DPPH 自由基的清除能力相当。石油醚相和水相在0.4 mg/mL 时DPPH 自由基清除能力表现不明显,但随着浓度增加,清除自由基能力也增强,当二者浓度超过1.6 mg/mL 时,对DPPH 自由基的清除率趋于平缓。本试验的阳性对照组VC表现出强抗氧化能力,对DPPH 自由基的清除率在试验浓度范围内超过93%,为试验提供良好的对比,从而能够判断乙酸乙酯相较其他萃取相具有较强的抗氧化能力。
2.3 降血糖活性
各萃取相对α-葡萄糖苷酶的抑制作用见图2。
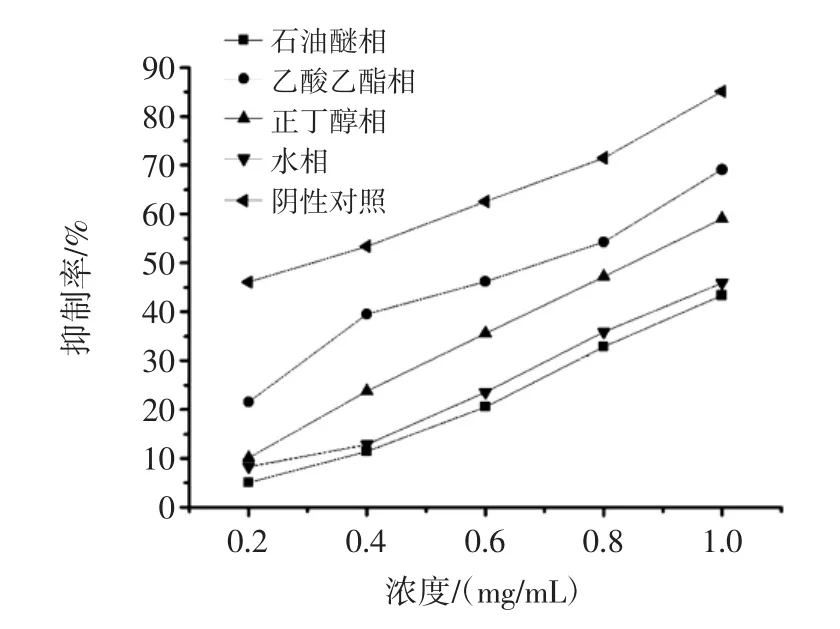
图2 各萃取相对α-葡萄糖苷酶的抑制作用Fig.2 Inhibition of α-glucosidase by each part
由图2数据可知,药桑叶乙醇提取物各萃取相对α-葡萄糖苷酶的抑制活性成剂量依赖性。抑制活性表现为同等浓度下,乙酸乙酯相体外抑制活性最强,正丁醇相优于石油醚相和水相。石油醚相和水相对α-葡萄糖苷酶体外抑制活性接近。对所测各萃取相数据进行线性拟合,得阿卡波糖、乙酸乙酯相和正丁醇相对α-葡萄糖苷酶的半抑制浓度,见表3。石油醚相和水相在试验浓度范围内对酶的抑制活性低于50%,对其二者的半抑制浓度不作分析。

表3 对α-葡萄糖苷酶的半抑制浓度Table 3 Half inhibiting concentration on α-glucosidase
3 结论
通过对药桑叶乙醇提取物各萃取相进行3 种活性试验,初步发现,乙酸乙酯相在3 种活性试验中均表现出较好的活性。说明乙酸乙酯相中具有潜在体外生物活性良好、含量相对较高的活性化学物质。
抗肿瘤试验的结果表明乙酸乙酯相中具有细胞毒性较好的化学物质。杨燕[16]通过对桑叶的研究发现桑叶乙酸乙酯相具有抗肿瘤活性,桑和药桑同属桑科桑属,故推测二者叶中可能存在类似抗肿瘤结构物质。同时,值得注意的是水相中可能存在促进Hela 肿瘤细胞增殖的物质。
药桑叶乙酸乙酯相和正丁醇相抗氧化活性较强,说明二者当中存在一些还原性较强的化学物质。张贵会等[17-19]对药桑叶中存在的黄酮类物质进行研究,并从中分离出若干黄酮及其苷类化合物,并对其抗氧化活性进行研究发现抗氧化活性良好。因此推测,药桑叶乙酸乙酯相和正丁醇可能相富含大量黄酮类化合物,此外,有研究发现[16,20],桑叶中含有茋类等一些具有抗氧化活性的化合物。桑叶(Morus alba L.)和药桑同属桑科桑属,进而推测药桑叶中亦可能含有茋类化合物。
根据试验结果,选定乙酸乙酯相进行化合物分离纯化鉴定,并进行后续活性试验,以期挖掘具有生物活性良好,具有开发潜力的前体化合物。
综上所述,药桑作为我国唯一的黑桑种资源[21],在维吾尔族传统医药中发挥巨大作用。药桑桑叶产量大,可开发利用价值高。在上述生物活性研究基础上,对药桑叶进一步深入研究,进而为综合开发利用药桑叶资源提了供理论依据和试验基础。

