Doxycycline诱导表达Msx2-GFP的鼠晶状体上皮Alpha-TN4细胞株的建立
张娇,于紫燕,赵江月
(中国医科大学附属第四医院眼科,中国医科大学眼科医院,辽宁省晶状体学重点实验室,沈阳 110005)
肌节同源盒基因同系物2(msh homobox 2,Msx2)作为肌节同源框基因家族的一员,其编码的转录抑制蛋白可调控细胞的存活与凋亡[1]。它多表达在间充质细胞与上皮细胞的交界处以及细胞增殖的区域,在体内控制着细胞的增殖和分化,与心血管、骨骼、眼耳鼻等组织发育密切相关,Msx2的表达异常或突变会对机体产生不良影响[2-3]。
在眼发育学研究领域,国外有研究[4]结果显示,在Msx2转基因鼠中发现小眼球畸形及视网膜发育缺陷。先前的研究[5]中也发现Msx2表达异常,通过抑制FoxE3基因并上调Prox1的表达来调控晶状体的发育。同时,敲除Msx2基因可通过激活Casp3/Casp8凋亡信号通路,引起晶状体组织中凋亡增加[6]。晶状体细胞凋亡是导致白内障发生的机制之一,因此,把Msx2作为靶因子导入晶状体上皮细胞,抑制细胞增殖和分化,触发凋亡,可能成为基因治疗晶状体及白内障相关疾病的一个突破性进展。
本研究利用基因开关调节系统(Tet-on),拟建立由doxycycline调控表达的Msx2诱导细胞株,探索其差异表达基因(differentially expressed genes,DEGs),为进一步的临床研究奠定基础。
1 材料与方法
1.1 实验材料
细胞:实验组选取doxycycline诱导表达Msx2的Alpha-TN4细胞株M8;空载体细胞株T9作为对照。
1.2 细胞培养及诱导
细胞株M8空载体T9在含胎牛血清的细胞培养液(dulbecco's modified eagle's medium,DMEM)过夜培养。经doxycycline(1 μg/mL)处理后,24 h后共聚焦荧光显微镜观察,并收集细胞。
1.3 蛋白提取及浓度测定
培养的细胞用预冷的PBS洗3遍,加入适量(200 μL/60 mm皿)裂解液,细胞刮收取蛋白至EP管每次超声15 s,重复5次,放置30 min,4 ℃离心12 000 r/min,15 min,取上清。考马斯亮蓝蛋白测定试剂盒(北京吉美生物有限公司)测定样本液蛋白浓度。
1.4 二维凝胶电泳
配制CyDye DIGE工作液(400 pmol/μL),根据蛋白定量结果,标本及1份混合内标各取50 μg加入1 μL浓度为400 pmol/μL的CyDye DIGE染料,避光。漩涡震荡,彻底混合,12 000g4 ℃离心10 min,收集底部标记混合物,在黑暗中冰上反应30 min。加入1 μL 10 mmol/L赖氨酸终止标记反应。充分混合,在黑暗中置于冰上10 min。每份样品加入同体积的补充液(7 mol/L尿素、2 mol/L硫脲、4%CHAPS、2%DTT、2% IPG Buffer),用再水化液(7 mol/L尿素、2 mol/L硫脲、18 mmol/L DTT、2% CHAPS、0.5% IPG Buffer)将样品体积补至340 μL,将18 cm IPG胶条(pH 3~pH 10,NL)置于胶条槽内,上样后在IPGphor固相pH梯度等电聚焦仪上行等电聚焦。整个过程避光。灌制12%SDS-PAGE胶,脱氧并保证胶面平齐。将IPG胶条置放在两低荧光玻璃板间的凝胶面上,用0.5%低融点琼脂糖溶液包埋。恒温20 ℃,行SDS-PAGE电泳(15 mA/胶,30 min;30 mA/胶,4 h)。整个过程避光,最后行考马斯亮蓝染色。
1.5 扫描及图像分析
电泳所得凝胶用MilliQ冲洗后用Typhoon 9400荧光扫描仪在不同激发光下扫描成像,所使用波长如 下:Cy2-488/520,Cy3-532/580,Cy5-633/679。所 得的蛋白质组图谱用DeCyder 2-D凝胶图像分析软件进行检测、自动分析,光斑体积的差异作为实验组与对照组蛋白表达水平变化的衡量指标,采用Mann WhitneyU-test进行统计学检验,P< 0.05为差异有统计学意义。
2 结果
2.1 建立由doxycycline诱导稳定表达Msx2的鼠晶状体上皮细胞株
经过扩增培养后,G418筛选出明显由doxycycline调控诱导表达Msx2-GFP的Alpha-TN4细胞株,为M8克隆。同时,以空载体细胞株T9作为阴性对照。细胞株M8在无doxycycline存在的条件下不表达Msx2-GFP,在加入doxycycline(1 μg/mL)10 h后,Msx2-GFP开始有微量表达,随着时间增加,Msx2-GFP的表达量随之增高。细胞株M8和T9在doxycycline(1 μg/mL)处理24 h后,以共聚焦显微镜检测可见细胞株M8有Msx2-GFP明显表达,见图1。

图1 Doxycycline处理24 h后诱导细胞株M8及T9 ×100Fig.1 Induction of M8 and T9 cell lines by a 24-h doxycycline treatment ×100
2.2 二维电泳分析M8及T9细胞株蛋白质
由诱导的细胞株M8和空载体T9阴性对照样品分别获得二维凝胶电泳图谱,每组样品重复3次。经图像分析分别在实验组M8检测到5 460个点,对照组T9检测到5 389个点。其中M8与T9之间差异点有31个,见图2。
图2 二维电泳分析晶状体上皮细胞蛋白质Fig.2 Two-dimensional gel electrophoresis of lens epithelial cell proteins
2.3 RNA微阵列分析和array结果的分析
对M8及T9 2组细胞进行了基因表达微阵列分析。通过SAS统计软件筛选DEGs。结果显示,在Alpha-TN4细胞系中存在712个多于2倍的表达变化的DEGs,其中454个基因被上调,258个基因被下调。在下调的基因中,Col3α1基因下调明显,见图3。对2组细胞进行实时PCR分析,检测到M8组mRNA的相对表达量为7.91±0.35,T9组mRNA的相对表达量为4.08±0.26。Col3α1表达量明显下降,此结果与上述结论保持一致。
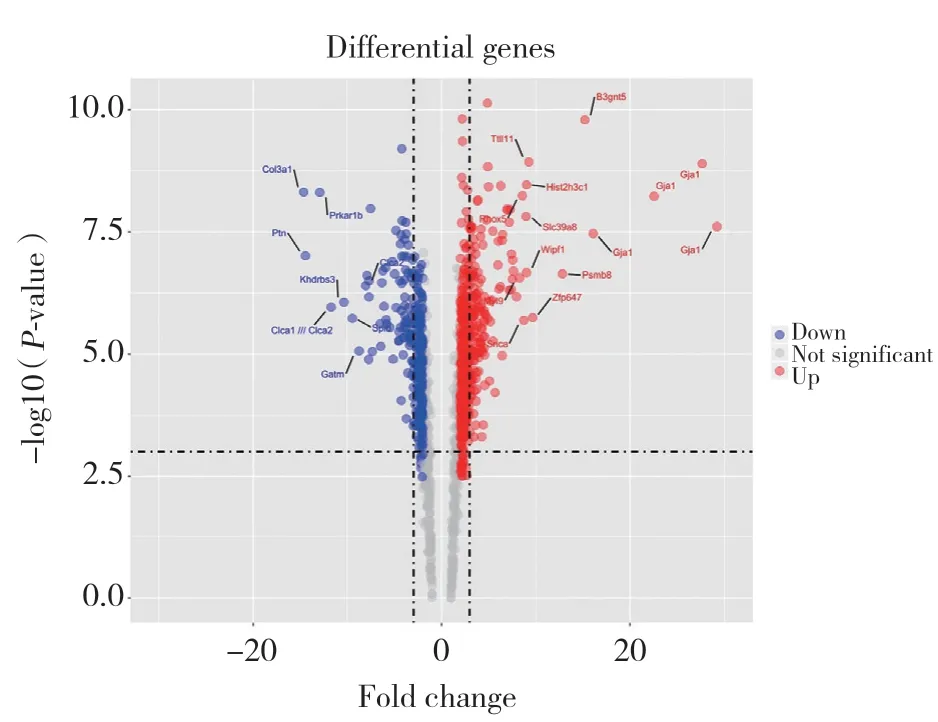
图3 M8及T9细胞株DEGsFig.3 Differentially expressed genes in M8 and T9 cells
3 讨论
Msx2是新近发现的参与调控细胞凋亡的关键蛋白。以往研究[7-8]多集中在Msx2对心血管、骨骼等组织发育的影响上,本研究利用基因开关调节系统(Tet-on),首次建立由doxycycline调控表达的Msx2诱导晶状体上皮细胞株。该系统利用改良的大肠杆菌E.coli的调节系统,靶基因的表达受四环素的衍生物doxycyclin精确调节,故具有低毒性、特异性、高敏感性,且不影响细胞内其他基因活性的特点[9]。在诱导细胞株中,Msx2受doxycycline的精确调节,使诱导细胞株建系成功。Msx2诱导细胞株的建立为研究Msx2功能提供了良好的细胞模型。
本研究采用比较蛋白质组学的理论和方法,对诱导细胞株M8和阴性对照细胞株T9蛋白质组进行分析和比较,检测差异明显的蛋白质。经过基因表达微阵列分析,分析出明显下调及上调的基因。并对其中在Msx2过表达细胞株M8中下调明显的Col3α1进行实时PCR分析验证,结果显示,过表达Msx2基因的晶状体上皮细胞与正常细胞相比,Col3α1的表达量明显下降,该结果与基因表达微阵列分析结果保持一致。
Col3α1作为一种Ⅲ型胶原,主要存在于细胞外基质中,尤其在人的血管内膜、肌肉等结缔组织中含量丰富[10]。在晶状体中,胶原纤维的异常增生会加速晶状体上皮细胞纤维化,加速细胞移行,从而导致晶状体浑浊。已知后发性白内障(posterior capsular opacification,PCO)的发生与晶状体囊膜的纤维化和基质的积聚和收缩有关[11]。其中晶状体囊膜由晶状体上皮细胞核纤维产生,富含Ⅳ型胶原蛋白,也含有Ⅰ型和Ⅲ型胶原及细胞外基质成分。研究发现正常情况下Ⅳ型胶原纤维均匀分布于晶状体囊全层,同时还存在Ⅰ型和Ⅲ型胶原,其中Ⅲ型胶原因具有特异性而使晶状体囊区别于眼球内其他基底膜组织[12-13]。而胶原纤维以及细胞外基质的异常沉积是PCO发生的重要病理机制[14]。本研究中Msx2过表达引起的Col3α1下调可能是晶状体上皮细胞发生凋亡的一个潜在机制,这一发现为PCO的基因治疗提供了新的研究思路。但Msx2与Col3α1之间是否存在直接联系,以及Col3α1如何影响Msx2,从而促发细胞凋亡,仍需进一步研究。

