表面外胚层敲除Mfn2基因对小鼠眼视网膜发育的影响
张帆,张娇,李函容,严肖啸,赵江月
(中国医科大学附属第四医院眼科,中国医科大学眼科医院,辽宁省晶状体学重点实验室,沈阳 110005)
线粒体融合蛋白2(mitofusin 2,Mfn2)是介导线粒体融合的蛋白质之一,是调节线粒体运动、呼吸活动等生理活动的关键分子。Mfn2基因的缺失有可能会引发mtDNA功能障碍,从而导致线粒体氧化磷酸化功能受到间接影响,从而中断呼吸链,促进更多细胞内活性氧出现,细胞凋亡由此发生。研究[1]发现,表面外胚层Mfn2功能的条件性丧失导致一系列先天性眼缺陷,包括眼球及晶状体体积减小,晶状体浑浊和角膜增厚。而眼组织的发育源于神经外胚叶、表皮外胚叶和中胚叶,发育过程复杂,存在各组织间的相互作用,如晶状体对视网膜发育的诱导[2]。由于这种诱导关系的存在,笔者猜测Mfn2基因对视网膜的发育同样存在影响。
各种原因引起的视网膜细胞凋亡是视网膜疾病中视觉丧失的根本原因[3],如视网膜色素变性、年龄相关性黄斑变性、糖尿病性视网膜病变和视网膜脱离等。视网膜中色素上皮层以及光感受器细胞层具有高代谢活性,而氧化损伤引起的视网膜代谢功能障碍是导致年龄相关性视网膜疾病中视觉衰退甚至丧失的主要原因[4]。已有研究表明参与线粒体融合和分裂的蛋白也广泛参与细胞过程,如线粒体代谢、氧化还原信号转导,维持mtDNA完整性和细胞死亡。因此,对视网膜发育过程中线粒体相关的调控机制进行研究具有重要意义和价值。
本研究观察了Mfn2基因在小鼠视网膜中的表达情况以及Mfn2对小鼠晶状体视网膜发育间相互诱导的影响,为今后研究线粒体与视网膜变性疾病的关系提供了新的思路。
1 材料与方法
1.1 实验动物
所有动物实验均经中国医科大学伦理委员会(16005M)批准,动物实验按照《动物使用与护理指南》进行。Le-Cre转基因小鼠和Mfn2等位基因小鼠由中国医科大学实验动物中心提供。所有动物均饲养于SPF环境中,12 h光/暗周期和温度控制。在Pax6启动子的控制下表达Le-Cre重组酶的转基因小鼠与Mfn2转基因小鼠进行交配,并再次对携带Le-Cre+/-;Mfn2fl/fl基因的雄鼠与Mfn2fl/fl的雌鼠交配,将子代中Le-Cre+/-;Mfn2fl/fl(Mfn2CKO)和Mfn2fl/fl(Mfn2WT)鼠分别设为实验组与对照组。
1.2 实验动物基因型的测定
剪取同窝实验组及对照组小鼠鼠尾,放入裂解液中裂解并提取DNA,行PCR 扩增,扩增条件为94℃预变性5 min,94 ℃变性30 s,退火30 s,72 ℃延伸45 s,经历30个循环,72 ℃后延伸10 min,4 ℃保存。配制浓度为1.5%琼脂糖凝胶,电泳时间20 min,电压140 V,待电泳结束后使用凝胶呈像分析系统照相。
1.3 HE染色实验检测小鼠眼部形态发育
分别在4 ℃下用4%多聚甲醛固定2组小鼠的胚胎头或出生后眼,分别用50%、75%、85%、95%和100%乙醇梯度脱水2 h。石蜡包埋,组织切片机4 mm切片。经HE染色后,中性树脂封片,光学显微镜采集图像。
1.4 免疫荧光方法观察Mfn2在小鼠视网膜中的定位
将石蜡切片依次置于50 ℃二甲苯(2 次,5 min/次)、无水乙醇5 min、95%乙醇5 min、85%乙醇5 min、75%乙醇5 min以及50%乙醇5 min;PBS清洗3次(5 min/次);将切片置入加热至沸腾的pH6.0、0.1 mol/L枸橼酸抗原修复液中,用微波炉使枸橼酸液沸腾维持10 min,待其冷却至室温;BSA室温封闭l h;加入兔抗鼠Mfn2一抗(1∶200稀释),4 ℃孵育过夜;PBS清洗3次(5 min/次);滴加山羊抗兔荧光二抗(1∶500 稀释),室温下避光孵育l h;PBS清洗3次(5 min/次);DAPI(1 ∶1 000稀释)复染l min;PBS清洗3次(5 min/次);防淬灭封片剂封片,荧光显微镜照相。
1.5 免疫荧光方法观察Mfn2基因条件敲除小鼠角膜BrdU标记变化
取E14.5、E17.5、E18.5胎龄小鼠行BrdU腹腔注射(100 mg/kg),1 h后处死,制备石蜡切片。依次置于50 ℃二甲苯(2次,5 min/次)、无水乙醇5 min、95%乙醇5 min、85%乙醇5 min、75%乙醇5 min以及50%乙醇5 min;PBS清洗3次(5 min/次);加入稀盐酸37℃孵育30 min;加入0.1 mol/L四硼酸钠,37 ℃下孵育10 min;PBS清洗3次(5 min/次);BSA 室温封闭l h;加入兔抗鼠 Mfn2一抗(1∶200稀释),4 ℃孵育过夜;37 ℃轻摇后,转入4 ℃过夜;37 ℃复温1 h;PBS清洗3次(5 min/次);滴加山羊抗兔荧光二抗(1∶500 稀释),室温下避光孵育l h;PBS清洗3次(5 min/次);DAPI复染l min;PBS清洗3次(5 min/次);防淬灭封片剂封片,荧光显微镜照相。
1.6 TUNEL法检测小鼠角膜在胚胎期及生后的凋亡情况
将制备好的石蜡切片在60 ℃烤片机上烤片1 h,然后脱蜡水化:依次置于50 ℃二甲苯(2次,5 min/次)、无水乙醇5 min、95%乙醇5 min、85%乙醇5 min、75%乙醇5 min以及50%乙醇5 min;蛋白酶K 37℃消化20 min;1×PBS清洗3次(5 min/次);5 μL TdT酶+45 μL荧光标记液的混合液中避光孵育l h;PBS清洗3次(5 min/次);DAPI复染l min;PBS清洗3次(5 min/次);防淬灭封片剂封片,荧光显微镜照相。
2 结果
2.1 Mfn2基因在视网膜中的表达位置
视网膜在小鼠出生后20 d左右发育成熟。为了探究Mfn2基因在视网膜中的表达位置,本研究选取P20的野生型小鼠进行免疫荧光检测,结果发现Mfn2基因在成熟视网膜中定位于视网膜光感受器外节。见图1。
2.2 表面外胚层Mfn2基因条件性敲除导致眼球结构发育异常
取同窝的实验组与对照组小鼠进行HE染色,结果显示,在E15.5至E17.5期间,实验组小鼠的眼球体积较对照组小,视网膜厚度不均匀,局部有增厚现象。至生后18 d时,实验组小鼠眼球体积较小,视网膜较对照组厚度增加。见图2。

图1 Mfn2基因在小鼠成熟视网膜中的表达 ×200Fig.1 Expression of Mfn2 gene in mature retina of mice ×200
2.3 Mfn2 CKO鼠与Mfn2 WT鼠视网膜细胞增殖差异
为了研究Mfn2基因条件性敲除后对视网膜细胞增殖的影响,本研究选取胚胎时期E14.5、E17.5及E18.5的实验组及对照组鼠进行BrdU实验。结果显示,E14.5时,实验组及对照组小鼠视网膜均有明显细胞增殖且无显著差异;E17.5时,实验组视网膜细胞增殖数较对照组视网膜细胞增殖数明显减少;E18.5时,2组视网膜细胞增殖数均明显减少。见图3。
2.4 Mfn2 CKO鼠与Mfn2 WT鼠视网膜细胞凋亡差异

图2 Mfn2 CKO小鼠视网膜发育异常 HE染色Fig.2 Abnormal retinal development in Mfn2 CKO mice HE staining
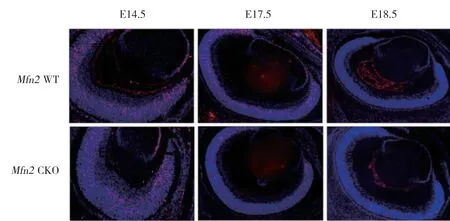
图3 Mfn2 CKO小鼠视网膜细胞增殖情况变化 ×100Fig.3 Proliferation changes of retinal cells in Mfn2 CKO mice ×100
为了探究实验组与对照组小鼠视网膜细胞凋亡情况的变化,本研究分别选取E17.5、P5及P20的小鼠进行TUNEL检测。结果发现,E17.5时实验组与对照组小鼠视网膜细胞凋亡数(7±1.57,4±1.61)均较少,但P5及P20时,2组小鼠视网膜凋亡细胞数均明显增加,且实验组凋亡数多于对照组(P5:实验组98±2.97,对照组74±2.86;P20:实验组33±1.57,对照组14±1.81)。见图4。
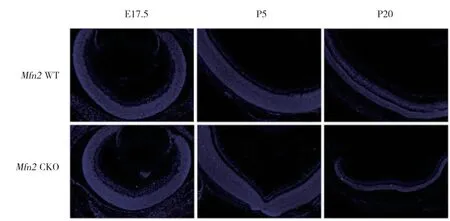
图4 Mfn2 CKO小鼠视网膜细胞凋亡情况变化Fig.4 Apoptosis changes of retinal cells in Mfn2 CKO mice
3 讨论
视网膜的发育受多种信号转导途径及细胞因子的影响,如Notch信号转导途径,hedgehog信号转导途径,以及表皮生长因子(epidermal growth factors,EGFs)、成纤维细胞生长因子(fibroblast growth factors,FGFs)、神经生长因子(nerve growth factors,NGF)等。它们在特定的时空条件下,通过复杂的细胞间相互作用,激活细胞内信号级联反应,最终引起相关基因(如Pax6,Ras,BMP,Eya,Prox1,Vax,Nogo等)表达,从而影响视网膜的发育、分化和增殖。而影响视网膜发育的某些基因,如Pax6、BMP,也同样存在于眼部其他组织[5]。
Mfn2是含757个氨基酸、具有三磷酸鸟苷(guanosine triphosphate,GTP)酶活性的线粒体外膜蛋白,它与Mfn1共同参与线粒体外膜融合[6]。研究[7]表明,线粒体融合和裂变对于细胞存活和凋亡具有重要意义。其中关于细胞凋亡的研究表明,Bcl-2家族成员(Bax,Bak,Bcl-2 和 Bcl-xL)和线粒体形态发生相关蛋白(Mfn1,Mfn2,Drp1和Fis1)有直接关系。本研究采用基于Cre/LoxP系统的条件性基因打靶技术构建表面外胚层Mfn2基因条件性敲除小鼠,通过将特异启动子控制表达位置的Cre重组酶的转基因小鼠Le-Cre与Mfn2条件性基因打靶小鼠(Mfn2flox/flox)交配,将子代中Le-Cre+/-;Mfn2fl/fl(Mfn2CKO)和Mfn2fl/fl(Mfn2 WT)小鼠分别作为实验组与对照组进行研究。结果发现,Mfn2表面外胚层条件性基因敲除小鼠不仅在晶状体发育中存在严重缺陷,且在胚胎期发育中,视网膜各层厚度不均,细胞增殖数减少,细胞凋亡增加。
本研究在表面外胚层条件性敲除Mfn2基因,导致视网膜发育受到影响,其原因涉及眼胚胎发育过程中存在胚胎诱导,即胚胎发育中2种胚胎组织通过相互作用对其中1种或2种组织的形态发生产生影响[8]。Mfn2缺失和线粒体动力学其他组分的潜在下降不仅阻碍线粒体形成,也能造成代谢和氧化还原稳态的恶化,增加应激诱导的突变和凋亡,使视网膜细胞的增殖与凋亡发生改变,同时猜测Mfn2基因的缺失会间接影响与眼发育相关的其他基因的表达,这些基因同时表达于表面外胚层和神经外胚层,通过晶状体视网膜间的胚胎诱导作用,导致视网膜的发育异常和视网膜细胞的增殖凋亡改变。而视网膜变性疾病是一组由于视网膜感光细胞变性凋亡所导致的严重致盲性眼病,动物视网膜变性的发病机制与人类的视网膜变性疾病有某些同源性。研究者普遍认为,视网膜老化及视网膜变性(年龄相关性)的基本因素为氧化应激和视网膜老化[9]。因此,对Mfn2的研究为视网膜的发育以及视网膜变性疾病提供了新的研究靶点。本研究是利用表面外胚层条件性基因敲除小鼠进行视网膜发育的表型观察,未来将利用神经外胚层条件基因敲除小鼠进一步观察Mfn2对视网膜发育的直接影响。

