四种测定直链淀粉和支链淀粉方法的比较
焦梦悦,高 涵,王伟娜,田益玲
(河北农业大学食品科技学院,河北保定 071000)
淀粉主要由直链淀粉和支链淀粉组成。直链淀粉是具有(1-4)-α-D-葡聚糖键的非分支化或轻分支化线性分子,支链淀粉是具有α-(1,6)糖苷键的高度支化聚集分子。直链淀粉、支链淀粉的结构及支直比与淀粉的物理性质、热特性密切相关,如糊化[1-4]。支直比也影响淀粉食品的老化的一个主要问题[5]。总之,直链淀粉和支链淀粉的含量以及支直比对淀粉的功能和营养特性有显著的影响。
近年来发展起来的对于测定支直淀粉含量的方法精确度较高,有近红外光谱分析法[6-8]、自动分析检测法[9-10]、伴刀豆球蛋白法及排阻色谱分析法[11-12]。然而,因其操作复杂、仪器及试剂价格高而难于推广应用[13]。目前,在国内应用的碘亲和力滴定法与碘比色法,但碘亲和力滴定法用来确定直链淀粉含量。碘比色法中的单波长法目前应用于测定谷物中直链淀粉含量,而双波长法消除了直支链淀粉吸收峰重叠带来的干扰,可同时测定直链淀粉、支链淀粉和总淀粉含量三个指标[13]。但目前尚未有对于标准曲线制作与单双波长应用结合的几种方法比较。
本试验主要针对碘比色法中的单双波长的应用结合标准曲线制作方法的不同,建立四种测定淀粉中直链支链淀粉及总淀粉含量的方法。用藜麦淀粉对此方法进行评估,最后通过测定常见淀粉考察其是否具有普适性。
1 材料与方法
1.1 材料与仪器
直链淀粉(A0512)、支链淀粉(A8515) 标准品(土豆来源),Sigma公司;碘 天津市凯通化学试剂有限公司;碘化钾 西陇科学股份有限公司;氢氧化钾 天津市大茂化学试剂厂;藜麦(白藜) 山西省静禾县双路乡藜麦种植合作社;马铃薯、木薯、玉米、小麦 上海裕田农业科技有限公司;水磨糯米粉 广州舒可曼有限公司;大米(粳米) 北京七河源食品科技有限公司。
JJ224BC型电子天平 常熟市双杰测试仪器厂;1512PHS-3CpH计 上海三信仪表厂;UV-1700PC紫外可见分光光度计 上海美析仪器有限公司。
1.2 实验方法
1.2.1 淀粉样品的制备及直链、支链淀粉标准溶液的配制 参照文献[14],从藜麦、马铃薯、木薯、玉米、小麦中提取淀粉。按参考文献[15]分别配制2 mg/mL的直链淀粉、支链标准工作液,待用。
直链淀粉标准液的配制:分别取直链淀粉标准工作液0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL于50 mL容量瓶,加蒸馏水25 mL,以0.1 mol/L HCl溶液调pH至3.5,加入0.5 mL碘试剂,配制成浓度范围为:8~80 μg/mL的工作曲线。20 ℃静置30 min后摇匀,待用。
支链淀粉标准液的配制:分别取支链淀粉标准工作液2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5 mL于50 mL容量瓶,加蒸馏水25 mL,以0.1 mol/L HCl溶液调pH至3.5,加入0.5 mL碘试剂,配制成浓度范围为:80~260 μg/mL的工作曲线。20 ℃静置30 min后摇匀,待用。
混合标准液的配制:分别取直链和支链淀粉工作液按照表1配制混合标准液[2],加蒸馏水25 mL,以0.1 mol/L HCl溶液调pH至3.5,加入0.5 mL碘试剂,待用。

表1 混合标准液的制备Table 1 Mixed standard curve preparation
1.2.2 淀粉的四种测定方法 以蒸馏水为空白对碘溶液、40 μg/mL直链淀粉标准液、80 μg/mL支链淀粉标准液扫描液进行全波长扫描;以碘溶液为空白对照对40 μg/mL直链淀粉标准液、80 μg/mL支链淀粉标准液扫描液进行全波长扫描,确定空白校正液。再分别对40 μg/mL的直链淀粉标准工作液、80 μg/mL支链标准工作液进行全波长扫描,确定直链淀粉测量波长及参比波长;支链淀粉测量波长及参比波长。分别将1.2.1中的直链淀粉标准液、支链淀粉标准液分别按表2中方法1、2所示波长进行测定,将1.2.1中的混合标准液按表2中方法3、4所示波长进行测定。

表2 四种方法测定波长Table 2 Determination of wavelength of four methods
方法1、2以淀粉浓度为横坐标;直链淀粉、支链淀粉测定吸光度值为纵坐标,绘制方法1标准曲线;以直链淀粉、支链淀粉测定吸光度差值为纵坐标,绘制方法2标准曲线。方法3、4以淀粉在混合标准液中的百分比为横坐标;以直链淀粉、支链淀粉测定吸光度值为纵坐标,绘制方法3标准曲线;以直链淀粉、支链淀粉测定吸光度差值为纵坐标,绘制方法4标准曲线。
1.2.3 验证实验 分别取直链淀粉工作液、支链淀粉工作液按表3配成检验液,加入25 mL蒸馏水,按1.2.2方法测定,代入标曲中得到淀粉含量测定值并与实际含量进行比较。

表3 验证液制备Table 3 Preparation of validation solution
1.2.4 精密度试验 精密称取藜麦淀粉样品0.1000 g,料液比1∶10 g/mL石油醚脱脂8 h后,用1.2.2中四种方法分别进行5次重复试验。
1.2.5 样品回收率试验 回收率测定试验是验证测定方法准确度的有效方法之一。向2 mg/mL藜麦淀粉溶液分别添加准确量取的直链淀粉和支链淀粉标准工作液[16],按表4配制回收率测定液,加入25 mL蒸馏水,测定,求其回收率。

表4 回收率测定液制备Table 4 Preparation of recovery solution
1.2.6 直链淀粉、支链淀粉含量的测定 用1.2.2方法分别测定及计算马铃薯、木薯、小麦、玉米、赤豆、小米、大米、糯米淀粉。代入方法可得支链淀粉、直链淀粉含量。代入以下公式求得支直比。
支直比(%)=支链淀粉含量×100/直链淀粉含量
式中:支链、直链淀粉含量单位为mg/mL。
1.3 数据处理
采用Origin 8.0软件作图,样品进行3次重复试验,最后结果以均值±标准偏差表示。采用SPSS 17.0软件进行相关性分析。
2 结果与分析
2.1 直链/支链淀粉扫描图
如图1所示,以蒸馏水或碘溶液为空白对淀粉-碘复合物的扫描图。对比可得,以蒸馏水为空白时,对直链、支链淀粉-碘复合物扫描250~420 nm之间吸收峰为碘溶液吸收峰;以碘溶液为空白时链淀粉扫描图在536 nm处有更明显的峰,方便等吸光度作图法进行分析。直链淀粉在638 nm处也有明显的峰。因此选择碘溶液作空白。

图1 全波长扫描空白校正选择Fig.1 Selection of full wavelength scanning blank correction
参比波长的差别在于标准品的差异及等吸收点作图点选取的差异。用UV-分光光度计对直链/支链淀粉扫描液进行全波长扫描得吸收光谱。由图2可知,根据双波长等吸光度点作图法确定直链淀粉的测量波长638 nm,参比波长430 nm;支链淀粉的测量波长536 nm,参比波长为768 nm。此结果与刘襄河等[17]确定的直链淀粉的测量波长630 nm,参比波长480 nm;支链淀粉的测量波长550 nm,参比波长为735 nm相接近。

图2 直链/支链淀粉波长选择Fig.2 Wavelength selection of amylose and amylopectin
2.2 四种方法测定直链淀粉和支链淀粉标准曲线及回归系数比较
在上述确定的波长下,按照方法1.2.2的方法做相应标准曲线结果如表5所示。从表5可知,四种方法测定直链和支链淀粉工作曲线的决定系数都较高,只有方法4测定支链淀粉的决定系数较差。因此对于直链淀粉的测定可以选用这四种方法的任何一种,在没有其他干扰的情况下准确性还是比较高的,而支链淀粉选用前三种方法更好一些。

表5 直链淀粉和支链淀粉标准曲线及决定系数Table 5 Standard curve and determination coefficient of amylose and amylopectin
2.3 验证实验
为了进一步确定方法的可靠性,按照实验方法的1.2.3进行验证实验,结果如图3所示:
由图3可知,直链淀粉含量测定中,四种方法差异不显著,都适用于直链淀粉含量测定。直链淀粉含量低时,方法1测定值与实际值最接近,但随着含量的增加,差值越来越大,而其他三种方法较为精确。对于支链淀粉,方法1与方法2、3、4差异显著(p<0.05)。方法1偏差大,无法代表实际值,由图4中方法2与实际值高度变化趋势可知,方法2所得在支链淀粉比例变小时偏差变大,不能应用于淀粉中直链/支链的比例测定。这是因为实际样品中一般都含有直链淀粉,直链淀粉在该波长下的吸光度值会影响测定结果。方法4所得数值与实际值偏差较大,方法3测定值更接近于实际值。综合比较可得,方法3更适用于测定淀粉样品中支链淀粉含量。
2.4 精密度测试
在本实验条件下,由表6可知,测定直链淀粉四种方法的5次实验值之间的一致性良好,藜麦淀粉的直链淀粉的相对标准偏差RSD均小于2%,说明采取这四种方法测定淀粉样品中的直链淀粉含量具有较高的精度。可得测定直链淀粉四种方法均一致性良好。

表6 直链淀粉精密度(%)Table 6 Amylose precision test(%)
但经过支链淀粉验证实验发现方法1无法表示实际值,之后不再讨论方法1。由表7可知,测定支链淀粉的方法3相对标准偏差RSD小于2%,方法2、4相对标准偏差RSD小于5%,较方法3一致性稍差。

表7 支链淀粉精密度(%)Table 7 Amylopectin precision test(%)
2.5 回收率实验
直链淀粉回收率测定试验结果如表8所示,无论检验液中是否有加入干扰的支链淀粉,方法2、4的回收率都在100.16%~103.48%,方法1、3的回收率在114.44%~152.72%,RSD均<1%,说明方法2、4分析方法具有较高的准确度和精密度,方法1、3分析方法准确度较差,说明方法2、4适合测定试验原料中的直链淀粉。

表8 直链淀粉各标准曲线回收率检验Table 8 Standard curve recovery test of amylose
支链淀粉回收率测定试验结果如表9所示,在没有加入干扰的直链淀粉工作液情况下,回收率在94.85%~111.58%,RSD均<2%,说明分析方法在无干扰下具有较高的准确度和精密度。回收率越接近于100%,说明结果越好。而在加入干扰的直链淀粉工作液情况下,方法2、4所得测定值的回收率125.30%、139.90%与100%差值变大,表明误差增大,这种误差增大的情况可能与直链淀粉所占比例有关,藜麦淀粉中直链淀粉所占比例小,因加入直链淀粉工作液,直链淀粉比例的增大,误差增大,表明方法2、4并不适合测定试验原料中的支链淀粉含量。表9中样品2方法3的回收率为94.52%,RSD<0.5%,说明该分析方法具有较高的准确度和精密度,适合测定试验原料中的支链淀粉。
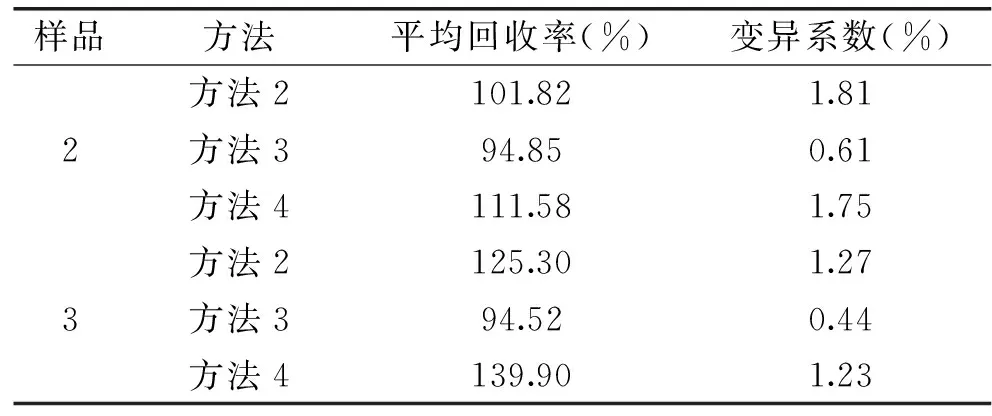
表9 支链淀粉各标准曲线回收率Table 9 Standard curve recovery test of amylopectin
2.6 样品测定
如表10,测定直链淀粉方法中,两种方法测定结果相似,进行显著性分析显示两种方法无差异。测定支链淀粉方法中,方法3、4差异显著(p<0.05),方法2与方法3、4差异不显著,方法2、4测定结果误差大,对应前面回收率实验,可能是双波长方法受直链淀粉含量影响太大,导致结果大;淀粉品种间的差异也会影响测定结果。对比可知,方法3更适用于支链淀粉含量的测定。因支链淀粉测定中方法3使用混标,对应直链淀粉测定中同样使用混标的方法4,因此结合可方便、快捷测出其各个含量。

表10 样品测定结果Table 10 Results of sample determination
表10中藜麦淀粉中的直链淀粉含量为6.00%~7.00%,与以往研究使用Con A沉淀法测定真直链淀粉含量(8.22%~9.30%)的研究大致相当[18-19]。Watanabe等[20]采用凝胶渗透色谱法(GPC)测定直链淀粉含量,藜麦淀粉含量在5.2%~10.9%之间,与本文结果接近。表中数据与文献报道相近品种或产地的马铃薯(24.97%~44.41%)[21]、木薯(15.52%~21.53%)[22]、小麦(31.4%)[23]、玉米(23%~50%)[24]、赤豆(35.43%)[25]、小米(26.29%~31.31%)[26]、大米(17.3%~18.3%)[27]、糯米淀粉直链淀粉占总淀粉比例的结果相近。
2.7 各淀粉总淀粉含量及支直比
表11表示了直链淀粉方法4结合支链淀粉方法3测定值所得常见谷物淀粉和藜麦淀粉中总淀粉含量以及支链淀粉与直链淀粉的比值。总淀粉含量为分别测得的直链淀粉含量与支链淀粉含量总和。因提纯后样品仍存在杂质,所以将分别测定的直链、支链淀粉含量数值相加得出总淀粉含量更准确合理,且排除了杂质的干扰。此方法适用于总淀粉含量的测定。此方法还可计算支直比,支直比反映谷物淀粉组成,支链淀粉比例含量高,将更容易受到淀粉酶的影响,表11中糯米、藜麦支直比相对更高,表明其对淀粉酶的敏感性高。支直比影响淀粉的功能特性,如糊化特性、对酶的敏感性及回生特性等,为淀粉研究提供参考价值。

表11 各淀粉总淀粉含量及支直比Table 11 Total starch content and ratio of starch to amylose
3 结论
通过对单、混标与单、双波长测定方法组合的四种方法从验证、回收率、精密度及实际样品测定结果分析,单独测定直链淀粉采用方法2、4较精确;单独测定支链淀粉,双波长的方法,即方法2、4不适合。而同时测定两种淀粉则是采用方法3、4进行结合更为准确。总结得到的具体方案为:测定加入碘试剂淀粉溶液638、536、430 nm处吸光度,代入以混合标准溶液制作的,A638-A430、A536与淀粉浓度得到的回归方程,能求出支、直淀粉含量、总淀粉含量及支直比。此方法进一步排除了双波长法标准曲线制作过程中两种淀粉标准品的互相干扰,可同时测定两者含量。未来需探明谷物的特性并与淀粉组成结合起来分析以得出更系统的结论。

