设施农业土壤中聚磷菌的筛选及其生物学特性分析
吴晓青,吕玉平,周方园,赵晓燕,张广志,任 何,周红姿,王加宁,张新建*
(1.齐鲁工业大学(山东省科学院)生态研究所,山东省应用微生物重点实验室,济南 250103;2.中国科学院上海植物逆境生物学研究中心,上海 201600;3.山东新时代药业有限公司,山东 临沂 273400)
磷素是植物生长中不可缺少的大量营养元素之一,磷素肥料也是农业生产中最普遍使用的肥料种类之一。为了适应市场需求,近年来我国设施农业产业发展迅速。2015年我国设施农业蔬菜产量已占蔬菜总产量的54%以上,面积、产量和产值都在不断扩大[1]。在设施农业生产中,盲目大量施用磷肥的现象十分严重,磷肥施用量是蔬菜需肥量的5~20倍[2-3],长期超量使用磷肥不仅在0~20 cm耕层中富集大量的磷,20~40 cm深层土壤中磷素积累量也在不断增加[3]。不同含磷量土壤的渗漏液中可溶性磷浓度在0.5~5 mg·L-1之间[4],通过渗漏液流失的磷素易造成毗邻水体富营养化[5],是农业面源污染的重要源头之一[6],亟需进行除磷处理。目前除磷技术主要包括材料吸附法和生物除磷法。其中吸附法是通过添加矿物、聚合物、生物炭等材料,利用不同材料的吸附或改变无机磷形态的作用,达到除磷效果[7]。而利用聚磷菌(Phosphate accumulating organisms,PAOs)等微生物好氧聚磷、无氧放磷特性的生物除磷技术已经在污水治理方面日趋成熟[8-9]。聚磷菌聚磷与编码多聚磷酸盐激酶(PPK)的ppk基因直接相关,其表达的PPK可催化ATP上的磷酸基因连接形成多聚磷酸盐颗粒(Poly-P)[10]。一些聚磷菌从土壤中分离获得,例如从磷化工厂周边土壤中分离的嗜麦芽寡营养单胞菌(Stenotrophomonas maltophilia)[11],从玉米根际土壤中分离的阿氏芽孢杆菌(Bucillus aryabhattai)[12],从烟草秸秆处理厂土壤中分离的嗜线虫沙雷氏菌(Serratia nematodiphila)[13]等。目前,从土壤中分离的聚磷菌主要应用于水体或污泥磷污染的处理,近期研究逐渐关注土壤聚磷菌对土壤磷素的调控作用。设施农业生产中盲目施肥导致过量的磷素渗漏污染地下水,亟需研发土壤磷素调控技术,但目前鲜见设施农业环境中聚磷菌的筛选。为了开发适用于设施农业环境的生物除磷技术,本研究对设施蔬菜大棚土壤中的聚磷菌进行了分离筛选和鉴定,并测定了菌株的环境适应特性和对病原菌的拮抗能力。本研究获得的不同生物学特性的聚磷菌为进一步开发设施农业生物除磷技术提供了优良的菌种资源。
1 材料与方法
1.1 样品采集
土壤样品采集自山东兰陵设施蔬菜大棚(117°57′12″E,34°52′44″N),采样时间为2017年9月,采样深度为40 cm以内,土壤类型为褐土,pH 7.0~8.5。
1.2 聚磷菌的筛选
将土壤样品梯度稀释后涂布于PAOs平板进行聚磷菌的初步筛选[14]。用无菌水将土壤分别稀释至10-1、10-2、10-3,振荡 30 min后静置30 min获得上清,即为梯度稀释液。分别吸取3个梯度稀释液1 mL置于9 cm培养皿中,与40℃左右的PAOs固体培养基[含柠檬酸钠 4 g、NaCl 0.5 g、(NH4)2SO42.5 g、CaCl20.25 g、MgSO40.25 g、Na2HPO412.8 g、KH2PO43 g、麦芽糖 0.01 g、甲苯胺蓝 0.025 g、琼脂 20 g,无需调节pH,115℃灭菌30 min]充分混合凝固,在28℃恒温培养箱中暗培养7~10 d。在PAOs平板上长出的菌落中挑选着色为紫红色的菌落,反复划线分离,直至平板上的单菌落形态一致,显微镜下大小形态也一致,即为初筛菌株。
采用异染粒染色法[15]对初筛菌株进行复筛。在载玻片上涂布菌液,首先置于染色液Ⅰ(甲苯胺蓝0.15 g和孔雀绿0.2 g溶于2 mL乙醇,再加入混合均匀的1 mL冰醋酸和100 mL蒸馏水)中染色5 min,再用染色液Ⅱ(碘2 g和碘化钾3 g,共同溶于100 mL蒸馏水)冲去染色液Ⅰ,继续染色1 min,在显微镜下镜检,其中异染粒被染成紫黑色,菌体为绿色。
1.3 菌体磷含量和除磷率的测定
挑选纯化后的单菌落接入到LB(含胰蛋白胨10 g·L-1、酵母提取物5 g·L-1、NaCl 10 g·L-1)培养液中,30℃、180 r·min-1振荡暗培养过夜,活化菌株。将菌株发酵液以体积比1∶100加入到低营养检测培养液[16][含 MgSO4·7H2O 0.4 g、FeSO4·7H2O 0.002 g、CaSO4·2H2O 0.08 g、CH3COONa 0.5 g、牛肉膏 0.22 g、(NH4)2SO40.2 g、KH2PO443.87 mg、dd′H2O 1 L,用1.0 mol·L-1的NaOH调节pH至6.5]中,初始总磷质量浓度为10 mg·L-1,30 ℃、180 r·min-1振荡暗培养至对数期,以未接菌株的低营养培养液为对照。参考蔡天明等[17]方法,以过硫酸钾消解菌体,按照总磷测定方法测菌体总磷量:
菌体磷含量=菌体总磷量/菌体干质量×100%。
将获得的培养物 5000 r·min-1离心 10 min,取上清测定磷含量,计算除磷率:
除磷率=(对照总磷量-上清液总磷量)/对照总磷量×100%。
上述实验均设置3个生物学重复。采用钼锑抗比色法[14]测定磷含量。测定5个浓度(1、3、5、10、20 mg·L-1)磷标准液的吸光度,通过绘制标准曲线获得磷浓度和吸光度关系公式(图1),利用关系式计算待测液中的磷含量。
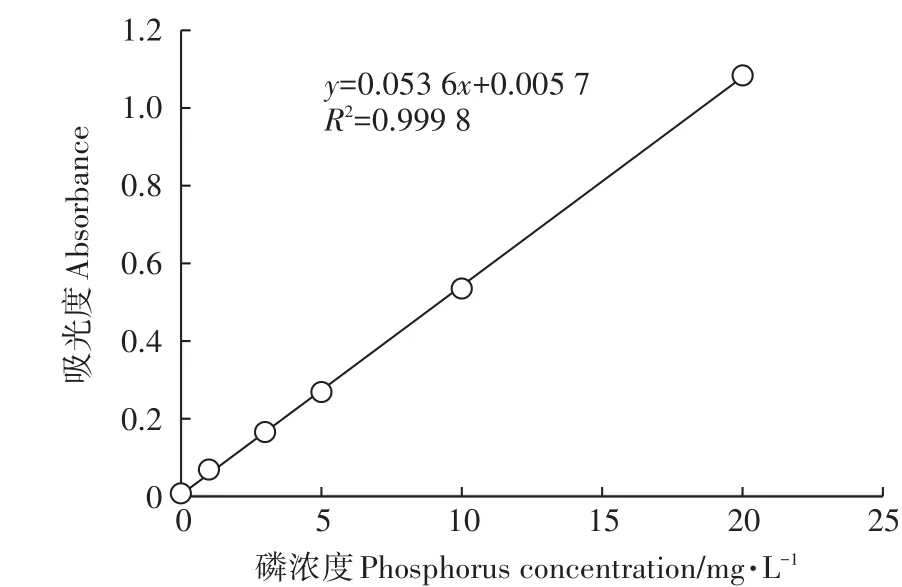
图1 磷浓度测定的标准曲线Figure 1 Standard curve for determination of phosphorus concentration
1.4 菌株种属的分子鉴定
菌株活化后(同1.3),将菌液寄送至青岛擎科公司进行测序,测序基因为16S rRNA,引物分别为1492 R和27 F[18]。将基因测序结果在Genbank中BLAST比对,采用MEGA-X对16S rRNA结果进行比对分析,采用Maximum Likelihood法绘制系统发育树。
1.5 多聚磷酸盐激酶基因(ppk)的PCR验证
针对两株节杆菌Fp64和Fp38,参考Genbank中节杆菌属ppk基因序列,利用Bioedit软件分析保守区,设计引物并进行PCR扩增。微杆菌Np20和红球菌Fp31分别参考Genbank中同种序列,设计引物进行PCR扩增。引物设计软件为Primer Premier 6.0,引物序列详见表1。PCR反应体系包括:2×Taq PCR Colorless Mix(鼎国)25L,DNA模板0.5L,primer(10mol·L-1)各2L,dd′H2O 20.5L。PCR扩增条件:94℃ 5 min,94℃ 45 s、55℃或50℃ 45 s、72℃ 1 min 20 s,32个循环,72℃10 min。PCR产物寄送至上海生工测序后,利用Bioedit软件进行序列同源性比对。
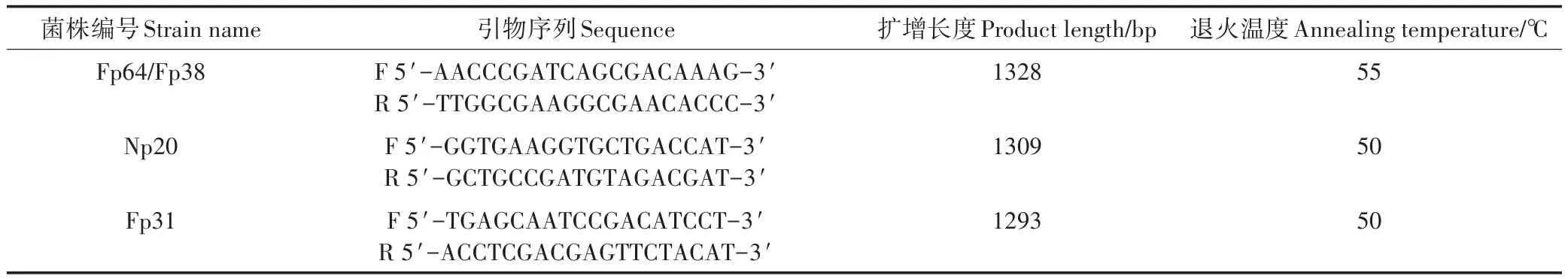
表1 ppk基因的引物信息Table 1 Primer information of ppk genes
1.6 菌株的耐盐效果测定
菌株活化后(同1.3),将浓度统一调整至1×109CFU·mL-1,以体积比1∶100分别接种至NaCl终浓度为 50、100、150 g·L-1的 LB培养液中,30 ℃、180 r·min-1暗培养振荡28 h,以不添加NaCl的LB培养液为对照。从不同处理中分别取100L培养物,均匀涂布在LB固体(含胰蛋白胨10 g·L-1、酵母提取物5 g·L-1、NaCl 10 g·L-1、琼脂15 g·L-1)培养平板上,在30 ℃恒温培养箱中暗培养48 h,统计单菌落数,计算耐盐率,本试验设3个生物学重复。计算公式:
耐盐率=处理菌数/对照菌数×100%。
1.7 菌株的耐高温效果测定
菌株活化后(同1.3),将浓度统一调整至1×109CFU·mL-1,以体积比1∶100接种至LB培养液中,分别在40℃和50℃下,180 r·min-1暗培养振荡28 h,以30℃培养条件为对照。从不同处理中分别取100L培养物,均匀涂布在LB固体培养平板上,在30℃恒温培养箱中暗培养48 h,统计单菌落数,计算耐高温率,本试验设3个生物学重复。计算公式:
不同温度下耐高温率=处理菌数/对照菌数×100%。
1.8 菌株对病害的拮抗效果测定
菌株活化后(同1.3),将浓度统一调整至1×109CFU·mL-1,取200L菌液至9 cm培养皿中,与40℃左右的PDA(BD,America)固体培养基充分混匀凝固。分别在培养平板中央接入直径为5 mm的病原菌菌块,分别为从病株分离的灰霉菌(Botrytis spp.)、腐霉菌(Pythium spp.)、立枯丝核菌(Rhizoctonia spp.)和镰刀菌(Fusarium spp.),对照为各病原菌在PDA平板上单独培养。将上述平板置于25℃培养3~4 d,统计病原菌菌落直径,计算拮抗率,本试验设3个生物学重复。计算公式:
对不同病原菌的拮抗率=(对照直径-处理直径)/对照直径×100%
1.9 统计学分析方法
采用Excel 2016软件进行数据统计分析。采用SPSS 22.0软件,用Duncan法进行多组样本间差异显著性分析。
2 结果与分析
2.1 设施土壤聚磷菌的筛选
将采集自设施蔬菜大棚的土壤样品,通过PAOs平板筛选获得初筛单菌落,再根据其菌落、革兰氏染色等形态特征初步分为17类细菌。对筛选获得的17类细菌进行异染粒染色,显微镜检具有明显异染粒结构的菌株。复筛获得7株细菌(分别命名为Fp64、Fp31、Np20、Fp38、Bp13、Bp14和Bp12),均为革兰氏阳性菌并可观察到异染粒结构。图2所示为代表菌株Fp64的革兰氏染色和异染粒染色情况。

图2 菌株Fp64的形态学观察Figure 2 Morphological observation of the strain Fp64
PCR扩增筛选菌株的16S rRNA后测序,并在Genbank中进行Blast比对,结果表明上述7株菌分别属于节杆菌(Arthrobacter spp.)、芽孢杆菌(Bacillus spp.)、红球菌(Rhodococcus spp.)和微杆菌(Microbacterium spp.)4个属的6个不同种,系统发育树如图3所示。经Bioedit软件进行序列同源性比对分析,Fp64与A.ureafaciens FN433020.1的16S rRNA同源性为98.8%,Fp38与A.keyseri JF703649.1的同源性为100%,Bp12和Bp13与B.subtilis MF196314.1的同源性分别为99.0%和97.1%,Bp14与B.methlotrophicus KC172004.1的同源性为99.0%,Fp31与R.rhodochrous KP-25713.1的同源性为99.9%,以及Np20与M.esteraromaticum JN082268.1的同源性为100%。
2.2 聚磷菌的除磷作用分析
利用钼锑抗比色法检测了上述7株聚磷菌的除磷作用。结果表明,培养至对数期时,除磷率最高的菌株为节杆菌Fp64(70.52%),其次高于50%的依次为红球菌Fp31(64.34%)、微杆菌Np20(61.39%)和节杆菌 Fp38(56.30%),3株芽孢杆菌 Bp13、Bp14和Bp12的除磷率均低于50%(图4A)。可以看出,在好氧条件下,筛选获得的聚磷菌均有除磷效果,其中节杆菌、红球菌和微杆菌菌株的除磷率比芽孢杆菌菌株的高。另检测了对数期菌体中的磷含量(磷占菌体干质量的百分比)。结果表明,Fp31的菌体磷含量最高为18.74%,另外Fp64、Np20和Fp38的菌体磷含量分别为17.89%、15.87%和13.69%,均高于10%,其余Bp14、Bp13和Bp12的菌体磷含量均低于10%(图4 B)。上述结果表明所筛选聚磷菌中,节杆菌、红球菌和微杆菌的聚磷效果和除磷作用显著高于芽孢杆菌。
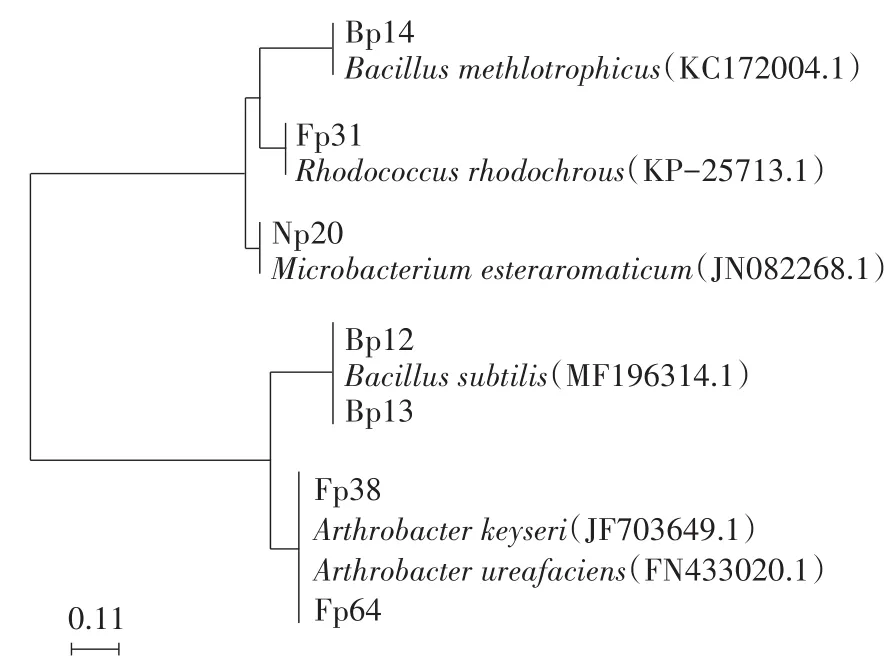
图3 菌株系统发育树Figure 3 Phylogenic tree of screened strains
对筛选获得的除磷率在50%以上的4株菌Fp64、Fp31、Np20和Fp38进行了ppk基因的PCR验证(图5)和DNA测序。本研究筛选的节杆菌A.ureafaciens Fp64和A.keyseri Fp38两个种在Genbank中没有ppk基因登记,通过比对同属ppk基因保守序列,设计引物,PCR扩增获得的序列与Arthrobacter sp.ATCC21022的ppk基因同源性分别为99.30%和99.20%。根据同种已登记的ppk基因设计引物,PCR扩增获得的Np20序列与M.esteraromaticum DSM8609的ppk基因同源性为99.70%,Fp31序列与R.rhodochrous NCTC630的ppk基因同源性为99.50%。结果表明,本研究筛选的聚磷菌基因组中均具有可催化产生Poly-P的ppk基因,从基因水平验证了4株菌的聚磷作用。
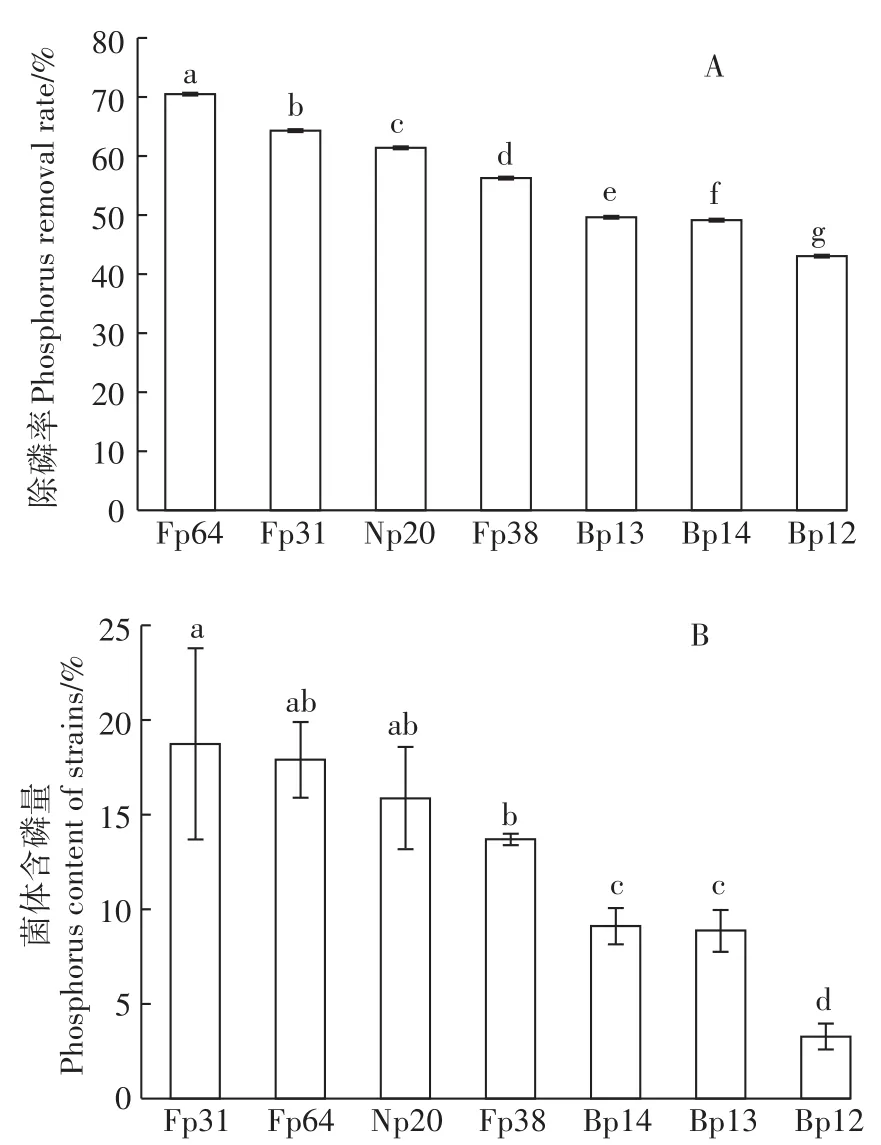
图4 聚磷菌的除磷效果分析Figure 4 Phosphorus removal efficiencies of the screened PAOs
图5 4株聚磷菌ppk基因片段的PCR产物Figure 5 PCR product of ppk gene fragment of 4 strains
2.3 聚磷菌的其他特性分析
许多设施农业生产中存在积盐、高温和病害高发等不良生长条件,为了检测所筛选菌株在应用中的环境适应性,分别对其中除磷率大于50%的4株菌Fp64、Fp31、Np20和Fp38的耐盐、耐高温和对常见病原菌的拮抗能力进行了分析。
结果表明,4株菌均具有一定的耐盐性,但水平高低不同。其中红球菌Fp31的耐盐能力最为显著,在50 g·L-1和100 g·L-1的NaCl条件下其生长不仅未被胁迫,反而菌数大幅提高(分别提高到4.88倍和3.07倍),在盐浓度高达150 g·L-1时,菌数仍可达对照的42.03%,其他3株菌则被严重抑制。两株节杆菌Fp64和Fp38在50 g·L-1NaCl条件下菌数未受显著影响,Fp64还可耐受100 g·L-1盐浓度,但同样浓度下Fp38的菌数仅为对照的69.69%。微杆菌Np20的耐盐水平较差,在50 g·L-1盐胁迫下菌数已降至对照的59.10%(图6A)。
在50℃高温条件下,4株菌的生长均受到抑制,其中微杆菌Np20和红球菌Fp31的耐受性较好,分别为44.15%和32.04%,而两株节杆菌Fp64和Fp31几乎被高温完全抑制(图6B)。
两株节杆菌Fp64和Fp31对4种病原真菌均具有较强的抑制作用,其中对腐霉菌均可100%抑制,对镰刀菌的抑菌率分别为86.99%和78.57%,对灰霉菌和立枯丝核菌的抑菌率也在50%~70%。微杆菌Np20也可完全抑制腐霉菌生长,对镰刀菌和灰霉菌的抑制率在60%以上,但对立枯丝核菌的抑制率低于10%。红球菌Fp31对4种病原真菌的抑制能力较差,对腐霉菌无抑制作用,对其他病原菌的抑制率均在20%以下(图6C)。结果表明,4株聚磷菌具有不同的生物学特性,其中红球菌的耐盐性较强,两株节杆菌的病原菌拮抗性、耐盐性较好,微杆菌比较耐高温。
3 讨论
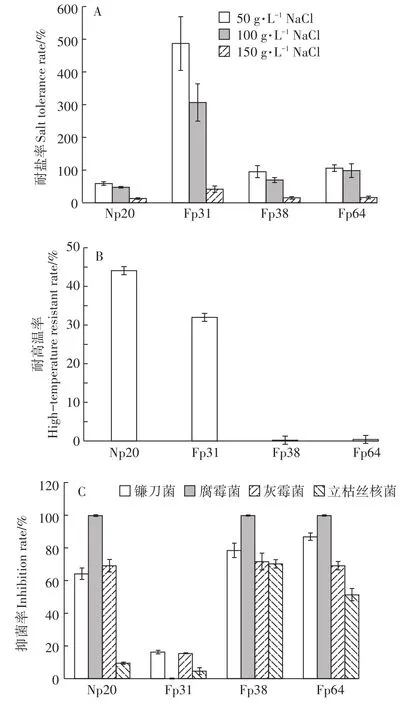
图6 聚磷菌的生物特性检测Figure 6 Biological characters of PAO strains
本研究对设施蔬菜大棚土壤中的聚磷菌进行了分离、筛选和鉴定,共获得属于节杆菌、红球菌、微杆菌和芽孢杆菌4个属的7株菌。刘菡[9]从东北玉米主产区的黑土、白浆土和黑钙土中分离得到的聚磷菌除了节杆菌、芽孢杆菌属外,还有不动杆菌(Acinetobacter spp.)、气单胞菌(Aeromonas spp.)、棒杆菌(Corynebacterium spp.)等10个属的细菌以及少数放线菌和真菌。Li等[19]从玉米根际土中分离得到的高效聚磷菌PA09经鉴定为烟草节杆菌(A.nicotinanae)。另外费氏柠檬酸杆菌(Citrobacter freundii)[17]和嗜线虫沙雷氏菌(Serratianem atodiphila)[13]也是自土壤中分离得到的高效聚磷菌。闫海啸等[20]发现农田黑土中具有除磷功能的细菌种属显著高于污水处理厂活性污泥中筛选的聚磷菌。上述研究表明,不同类型的土壤中定殖着各种具有除磷功能的聚磷菌,本研究从设施蔬菜土壤中筛选获得的节杆菌、红球菌和微杆菌的除磷效果较好,其中红球菌和微杆菌是首次从土壤中筛选得到的被证明有除磷作用的聚磷菌。无论从水体污泥还是土壤中获得的聚磷菌,大部分用于外部水体磷污染的治理[8,21-24],而鲜见针对设施农业土壤环境进行的聚磷菌筛选,本研究从设施大棚土壤中筛选聚磷菌,可利用其好氧摄磷的特性将磷固定在菌体中。初始总磷浓度为10 mg·L-1,时最高可去除70.52%的磷,共有4株菌高于50%,而土壤渗漏液中的可溶性磷一般在10 mg·L-1以下[4]。据相关报道,高磷浓度下筛选获得的聚磷菌可充分满足较低浓度磷污染的修复[25-26],故而本研究所筛选菌株可满足土壤渗漏液除磷。所筛选聚磷菌的菌体含磷量最高为18.74%,共有4株菌高于10%,参考前人研究[17],所筛菌株的聚磷能力较强。其中节杆菌Fp64的菌体含磷量略低于红球菌Fp31,但同样在对数期时,前者的除磷效果却显著高于后者。由于菌体含磷量与菌体质量负相关,而除磷率与菌数正相关。因此,在单菌细胞吸收磷素水平差异较小时,可能出现菌体含磷量较低但除磷率较高的情况。另外,本文通过PCR验证了4株聚磷菌中均存在ppk基因,但该基因在聚磷作用中的表达水平未经验证,需要进一步揭示其作用机制。
为了解所筛选的聚磷菌对设施农业环境的适应性,本研究还考察了聚磷菌的耐高温、耐盐和对病原菌的抑制率,结果表明不同属的聚磷菌呈现不同的生物学特性。其中两株节杆菌Fp64和Fp38对真菌病原菌均具有高效抑制作用,并可耐受100 g·L-1的盐浓度,前人研究中节杆菌属菌株具有病原菌拮抗作用[27-30],也具有耐盐特性[31]。另有研究表明产脲节杆菌(A.ureafaciens)还具有对一种毒性农药阿特拉津的降解作用[32-33],因此节杆菌在设施农业中具有多功能的应用潜力。除了节杆菌之外,本研究中微杆菌Np20对病原菌也具有一定的拮抗作用,且耐高温性较好,而红球菌Fp31较耐高温、对病原菌拮抗作用不明显,但具有显著耐盐性。另外,节杆菌、微杆菌、红球菌和芽孢杆菌属均曾报道为促生植物生长根际细菌(PGPR)[34-35],本文中聚磷菌是否兼具促生作用还有待进一步验证。在接下来的研究中,我们将分析各菌株在土壤中施用后调节土壤渗漏液磷含量的效应,以及控制磷流失的能力,并利用其生物特性优势,针对不同土壤环境条件配伍复合菌剂。
4 结论
(1)本研究从设施蔬菜大棚土壤中筛选出7株聚磷菌,经鉴定属于节杆菌、微杆菌、红球菌和芽孢杆菌4个属。
(2)好氧条件下,所有菌株均具有除磷作用,其中Fp64的除磷效果最显著(70.52%),Fp31的菌体含磷量最高(18.74%)。在除磷率>50%的4株聚磷菌中,均可扩增出ppk基因。
(3)所筛选的聚磷菌兼具多种其他生物学特性,其中Fp64和Fp38具有病原菌拮抗和耐盐性,Np20具有病原菌拮抗和耐高温性,Fp31具有极其显著的耐盐性。
(4)本研究所筛选的菌株具有较高的除磷能力和菌体含磷量,兼具拮抗病原菌和良好环境适应性等特点,有望用于控制土壤渗漏液磷流失,为进一步研发针对设施农业土壤环境的高效生物除磷技术提供了优良菌种。

