根际过程和高底物浓度促进黑土有机磷矿化*
于星辰 刘 倩 李春杰 朱 平 李海港,3† 张福锁
(1 中国农业大学资源与环境学院/植物-土壤相互作用教育部重点实验室,北京 100193)(2 吉林省农业科学院农业资源与环境研究所,长春 132000)(3 内蒙古农业大学草原与资源环境学院,呼和浩特 010011)
大量研究表明,根际过程能促进土壤无机磷的活化[1-3]。缺磷胁迫促使植物进化形成了各种生理适应机制来活化、吸收土壤难溶性无机磷。生理适应机制包括根系有机酸阴离子的分泌、根际酸化等[4-5]。低磷胁迫增加了番茄(Lycopersicon esculentum L.)、鹰嘴豆(Cicer arietinum L.)和白羽扇豆(Lupinus albus L.)根系的质子分泌[6]。生长在钙质土壤上的蚕豆(Vicia faba L.)能够降低根际pH,而玉米(Zea mays L.)根际pH变化不明显[7]。根系所分泌的有机酸阴离子主要包括柠檬酸、苹果酸、草酸、琥珀酸等[8]。有机酸阴离子通过基团置换、溶解作用和占据磷吸附位点来增加土壤无机磷的生物有效性[6,9]。而这些根际过程对土壤有机磷矿化的影响尚缺乏系统研究。
我国耕作土壤有机磷占土壤全磷的25%~56%,东北黑土可达70%以上[10],是作物吸收磷素的重要来源。土壤有机磷必须经过矿化作用分解为无机态磷酸根离子才能被根系所利用[11]。土壤有机磷的矿化作用分为两步:1)有机磷从土壤矿物上解吸进入土壤溶液;2)土壤溶液中的有机磷被磷酸酶分解为无机态磷酸根离子[11]。有机磷在土壤中的吸附过程与无机磷相似。根系有机酸阴离子和质子的分泌促进了有机磷在土壤中的解吸,这是有机磷矿化的前提。酸性磷酸酶是土壤有机磷矿化所需要的一种水解酶,是土壤有机磷矿化过程的决定物质。根际酸性磷酸酶主要来自于植物根系和根际微生物的分泌作用等[12]。缺磷胁迫显著增加了植物根际酸性磷酸酶活性,促进了土壤有机磷的矿化[13-14]。此外,土壤有机磷也可能通过提高底物浓度而促进矿化作用的进行。
玉米和蚕豆是我国重要的粮食作物和豆科作物,对低磷土壤具有很强的生理适应特性[15]。因此,研究玉米和蚕豆根际过程对有机磷矿化的影响,对于有机磷高效利用有重要意义。本研究采用室内培养和田间试验相结合的方法,拟定量分析根际过程和有机磷浓度对土壤有机磷矿化的促进作用。
1 材料与方法
1.1 研究区概况与试验材料
试验所用土壤取自吉林省农业科学院公主岭市肥料长期定位试验田(124°48′33.9″E,43°30′23″N),该地区属温带大陆性季风气候,地势平坦,海拔220 m,年均气温4~5℃,年最高温度3 4 ℃,年最低温度-3 5 ℃,无霜期125~140 d,有效积温2 600~3 000℃,年降水量450~600 mm,年蒸发量1 200~1 600 mm,年日照时数2 500~2 700 h,土壤类型为黑土。原始土壤pH为7.6,有机质23.3 g·kg-1,全氮1.40 g·kg-1,全磷0.61 g·kg-1,全钾18 g·kg-1,碱解氮124.7 mg·kg-1,有效磷(Olsen-P)11.8 mg·kg-1,速效钾158.3 mg·kg-1。
试验始于1 9 8 7 年,试验处理主要包括①对照(CK,不施肥,种植作物);②施用氮磷钾(NPK);③施用氮磷钾+秸秆还田(NPKS);④施用氮磷钾+有机肥(NPKM)。处理②、④按等氮量投入原则设计,其中施有机肥处理④,有机氮和无机氮的比例为7∶3。有机肥和秸秆为一年施用一次,于第一茬作物播种前作基肥施用。每季作物的磷、钾肥均作为基肥施用,氮肥作基肥一次性施用或追肥分次施用。有机肥料(M)多为猪粪(约为23 t·hm-2),其养分含量为:N5 g·kg-1,P2O54 g·kg-1,K2O 4.9 g·kg-1。还田的秸秆(S)为玉米秸秆(7.5 t·hm-2),玉米秸秆的养分含量为:N 7 g·kg-1,P2O51.6 g·kg-1,K2O 7.5 g·kg-1。化肥为尿素(含N 460 g·kg-1)、磷酸二铵(含P2O5460 g·kg-1、N 18 g·kg-1)和氯化钾(含K2O 62 g·kg-1)。NPK处理化肥施用量为N165 kg·hm-2、P2O582.5 kg·hm-2和K2O 82.5 kg·hm-2;NPKS处理化肥施用量为N112 kg·hm-2、P2O582.5 kg·hm-2、K2O 82.5 kg·hm-2和秸秆7.5 kg·hm-2;NPKM处理化肥施用量为N50 kg·hm-2、P2O582.5 kg·hm-2、K2O 82.5 kg·hm-2和有机肥23 kg·hm-2[10]。四个处理土壤的基本理化性质如表1所示。
1.2 温室盆栽试验
温室盆栽试验在中国农业大学资源与环境学院玻璃温室进行。所用土壤取自上述肥料长期定位试验中的不施肥(CK)与施用氮磷钾+有机肥(NPKM)两个处理,取样深度为0~20 cm,所取土壤自然风干,磨细,过2 mm筛。
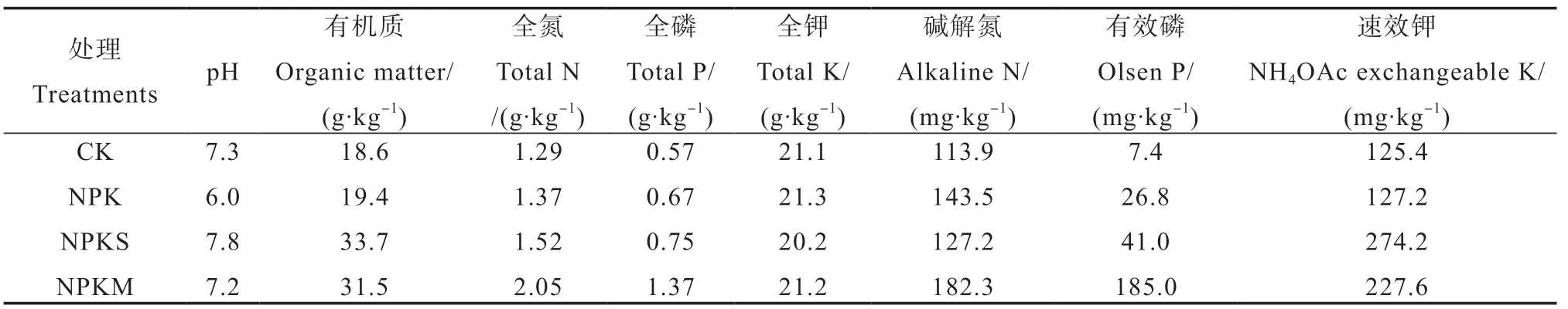
表1 四个处理土壤基本理化性质Table 1 Basic soil properties of the four treatments
试植物为玉米(Zea mays L. cv. L224)和蚕豆(Vicia faba L. cv. Lincan No.2)。种子用10%H2O2浸泡种子30 min灭菌,用蒸馏水充分洗净后,在饱和CaSO4溶液中浸泡24 h催芽,期间换一次溶液,然后将种子铺在湿润的滤纸上,在25°C培养室中避光发苗2~3 d,待胚根长出1 cm左右时,将种子移入根垫装置内培养。移苗后,所有幼苗在水培装置下培养1个月,所用根垫装置如图1A(直径10 cm的聚氯乙烯(PVC)管),此时用的营养液为全营养液,每3天更换一次,pH用NaOH和H2SO4溶液调至6.0~6.5;待根系能够覆盖10 cm直径范围时,将其放置根垫土壤如图1B,此时营养液为无磷营养液(不加KH2PO4),土壤层与营养液之间用滤纸条连接,用于输送营养液。根垫装置中的土壤即为根际土[2]。每个处理设四次重复,培养15 d后收获。营养液配方为(mol·L-1):C a(N O3)2,2×1 0-3;K2S O4,0.7 5×1 0-3;MgSO4,0.65×10-3;KCl,0.1×10-3;KH2PO4,0.25×10-3;H3BO3,10×10-6;ZnSO4,1.0×10-6;MnSO4,1.0×10-6;CuSO4,0.1×10-6;(NH4)6Mo2O24,0.005×10-6;Fe-EDTA,0.2×10-3。

图1 根垫装置 (A:全营养液培养;B:无磷营养液培养)Fig. 1 Root mat device(A:Culture in complete nutrient solution; B: Culture in nutrient solution without phosphorus)
作物生长45 d后,分别收获为地上部与根系,洗净后,105℃杀青30 min,然后在65℃烘干至恒重,称重。同时,取新鲜土壤样品置于盛有25 mL 0.2 mmol·L-1CaCl2的离心管中,振动、混匀,提取作为根际土壤提取液,此离心管中的提取液用于土壤pH、有机酸阴离子和酸性磷酸酶活性的测定[16]。取5 mL左右两份提取液,装入5 mL离心管中,其中一份滴加2滴浓磷酸防止微生物分解,并保存于-20℃冰柜中,用于有机酸阴离子测定,另一份直接放入4℃冰箱,用于酸性磷酸酶活性测定。土壤样品自然风干后,测定土壤有机磷含量。
1.3 田间原位试验
取吉林公主岭长期定位试验点的四个施肥处理:对照不施肥(CK)、单施氮磷钾(NPK)、氮磷钾+秸秆(N P K S)及氮磷钾+有机肥(NPKM)中的直播玉米(Zea mays L. cv. Zhengdan 958)进行根际过程的测定。试验田的种植方式为玉米-玉米,一年一熟连作。
玉米生长至第45天时,整株收获,取样。根系从土壤中取出后,抖掉多余的土壤,紧紧附着在根系上的土壤被看作是根际土。剪下几条根系,将附有根际土的根系浸入25 mL 0.2 mmol·L-1CaCl2离心管中,轻轻摇动,收集液用于根际过程的测定,测定方法同上。
1.4 测定项目与方法
植株磷含量测定:植物材料用100 g容量粉碎机粉碎后,用浓H2SO4-H2O2消煮,消煮液的磷浓度用钒钼黄比色法测定[16]。
土壤p H 的测定及校正:提取液的p H 由装配有玻璃复合电极的pH计(Sartorius PB-10,Göttingen,德国)测定。因土壤提取液的水土比不同,测得pH需经过校正。用一系列不同水土比(1、2.5、4、7、10、20、30、60)条件下测得的土壤pH进行模拟,选择显著性系数最高的方程为校正的模拟方程(表2),校正为水土比为2.5∶1的标准pH。校正后的pH认为是根际pH。

表2 校正pH的模拟方程Table 2 Simulation equation to modify pH
根际酸性磷酸酶活性测定:酸性磷酸酶活性的测定采用酶标法[16]:取土壤悬浊液2 mL与2 mL 50 mmol·L-1醋酸钠缓冲液(pH=5.2)混匀,采用12×8(96 孔)、300 μL微孔的酶标板(Whatman Inc., Florham Park, NJ),每竖排8个孔内为同一样品,测定时进样8次。每个样品有以下三类加样:样品待测液加底物(4-MUBphosphate(4-甲基伞形酮磷酸酯))、待测液加标准底物(4-MUB,4-methylumbelliferyl(4-甲基伞形酮))、待测液加缓冲液。每孔内加待测液200 μL,加底物或缓冲液50 μL,最后再设阴性对照(缓冲液加底物)和参比标准(缓冲液加标准底物),每个处理均为四次重复。在30℃培养箱内培养4 h,再由光谱扫描多功能读数仪(Thermo Scientific Varioskan Flash,赛默飞世尔科技)测定,Thermo Scientific SkanIt软件控制操作,酶活性以nmol·h-1·g-1为单位。
有机酸阴离子的测定:根际提取液中的有机酸用高压液相色谱(HPLC)测定。高压液相色谱以离子压缩模式分析测定根分泌物中的有机酸阴离子。分析条件如下:250 mm× 4.6 mm反相色谱柱(Alltima C-18,Alltech,Deerfield,IL,美国);流动相为25 mmol·L-1KH2PO4(pH =2.5);流速为1 mL·min-1;柱温为28℃;检测波长为:214 nm;样品的注射体积为20 μL。所有样品测定前均过0.45 μm 滤膜。HPLC通过不同组分在色谱柱上保留时间和标准曲线来定性和定量检测样品的成分及含量。
土壤有机磷测定:在马福炉中550℃高温灼烧土壤样品1 h,然后与未经灼烧的土壤样品一起,用0.2 mol·L-1硫酸(1/2H2SO4)浸提后用钼锑抗比色法测定磷含量,灼烧的与未灼烧的差值即为有机磷含量[16]。
1.5 数据处理与统计分析
用SAS 8.1分析试验数据。最小显著差异法(LSD)进行显著性检验,显著水平为0.05。
2 结 果
2.1 施肥对植株生物量和磷含量的影响
盆栽试验中,玉米、蚕豆的地上部和根系干重在处理间无显著差异(图2A)。在CK和NPKM处理中玉米根冠比均为0.25,分别显著高于相应处理中的蚕豆(0.08和0.07)(图2B)。
施肥处理未显著影响玉米地上部及根系的磷浓度(图3A)。蚕豆的地上部磷浓度对土壤肥力也无显著响应,但是施肥处理提高了蚕豆根系的磷浓度,NPKM处理的蚕豆根系磷浓度较CK处理高57.6%(图3B)。
2.2 施肥对根际pH和酸性磷酸酶活性的影响
CK处理的玉米根际pH为7.07,显著高于空白土壤0.09个单位。CK处理的蚕豆根际pH与空白土壤无显著差异(图4)。NPKM处理的空白土壤pH与玉米根际pH间无显著差异,但NPKM处理的蚕豆根际pH为7.32,显著高于空白土壤0.11个单位,并且较玉米根际土壤高0.09个单位。

图2 温室培养条件下玉米和蚕豆的地上部和根系的生物量(A)以及根冠比(B)Fig. 2 Dry weight of shoot and root (A) and root/shoot ratio (B) of maize and faba bean in greenhouse

图3 温室培养条件下玉米(A)和蚕豆(B)植株磷浓度Fig. 3 Phosphorus concentrations in shoot and root of maize (A) and faba bean (B) in greenhouse
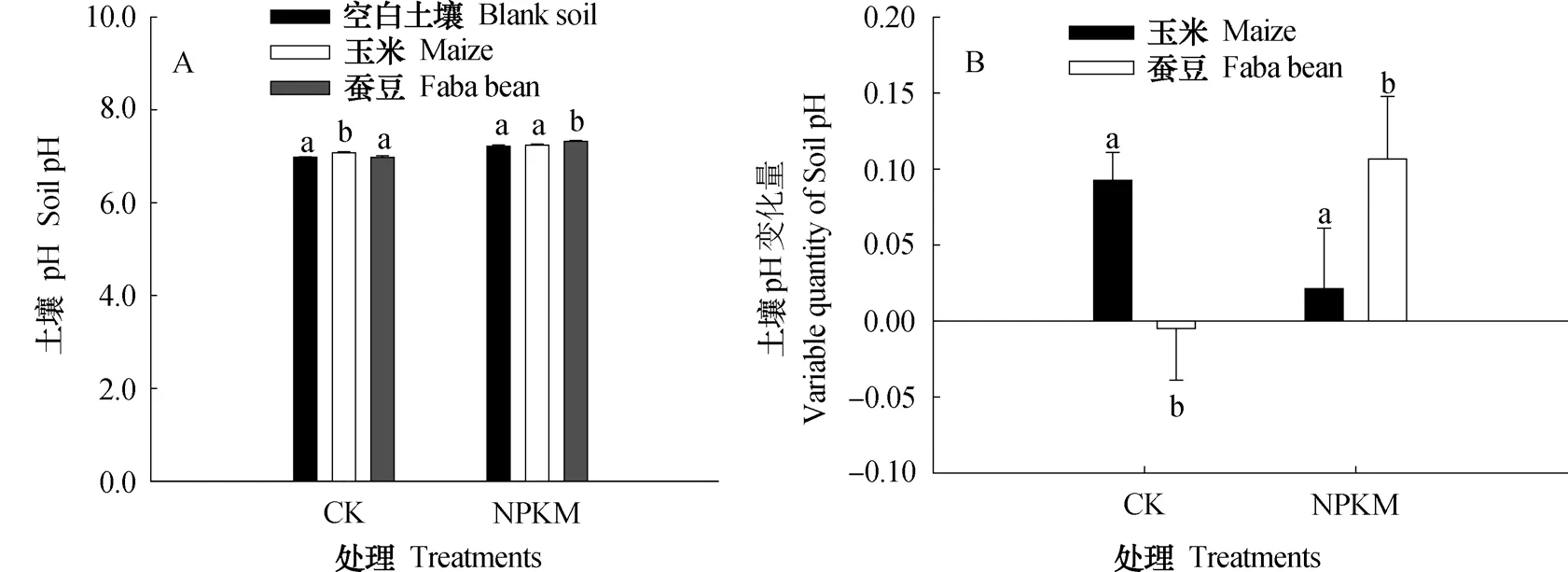
图4 温室培养条件下根际pH (A)与变化量(B)Fig. 4 Rhizosphere pH (A) and variation (B) between treatments in greenhouse

表2 校正pH的模拟方程Table 2 Simulation equation to modify pH

图5 长期定位试验点玉米根际与非根际土壤pH(A)与酸性磷酸酶活性(B)Fig. 5 Soil pH (A) and acid phosphatase activities (B) in rhizosphere and non-rhizosphere soil in a long-term experiment
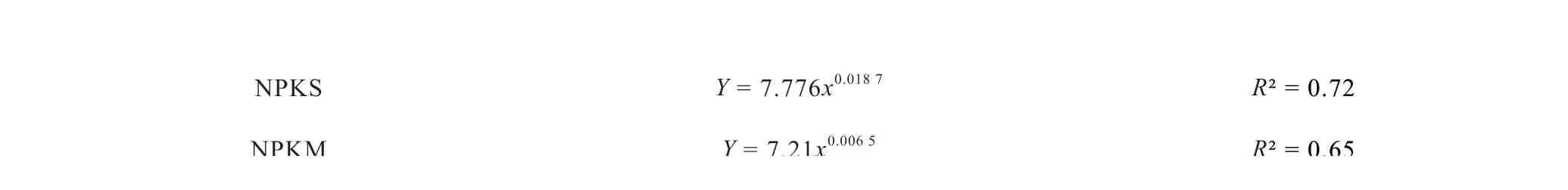
NPKS Y = 7.776x0.018 7 R² = 0.72 NPKM Y = 7.21x0.006 5 R² = 0.65
根际酸性磷酸酶活性测定:酸性磷酸酶活性的测定采用酶标法[16]:取土壤悬浊液2 mL与2 mL 50 mmol·L-1醋酸钠缓冲液(pH=5.2)混匀,采用12×8(96 孔)、300 μL微孔的酶标板(Whatman Inc., Florham Park, NJ),每竖排8个孔内为同一样品,测定时进样8次。每个样品有以下三类加样:样品待测液加底物(4-MUBphosphate(4-甲基伞形酮磷酸酯))、待测液加标准底物(4-MUB,4-methylumbelliferyl(4-甲基伞形酮))、待测液加缓冲液。每孔内加待测液200 μL,加底物或缓冲液50 μL,最后再设阴性对照(缓冲液加底物)和参比标准(缓冲液加标准底物),每个处理均为四次重复。在30℃培养箱内培养4 h,再由光谱扫描多功能读数仪(Thermo Scientific Varioskan Flash,赛默飞世尔科技)测定,Thermo Scientific SkanIt软件控制操作,酶活性以nmol·h-1·g-1为单位。
有机酸阴离子的测定:根际提取液中的有机酸用高压液相色谱(HPLC)测定。高压液相色谱以离子压缩模式分析测定根分泌物中的有机酸阴离子。分析条件如下:250 mm× 4.6 mm反相色谱柱(Alltima C-18,Alltech,Deerfield,IL,美国);流动相为25 mmol·L-1KH2PO4(pH =2.5);流速为1 mL·min-1;柱温为28℃;检测波长为:214 nm;样品的注射体积为20 μL。所有样品测定前均过0.45 μm 滤膜。HPLC通过不同组分在色谱柱上保留时间和标准曲线来定性和定量检测样品的成分及含量。

图6 温室培养条件下根际酸性磷酸酶活性(A)土壤有机磷含量(B)

图7 长期定位试验点玉米根际苹果酸阴离子浓度Fig. 7 Rhizosphere malate concentration in maize in a longterm experiment in Gongzhuling
土壤有机磷测定:在马福炉中550℃高温灼烧土壤样品1 h,然后与未经灼烧的土壤样品一起,用0.2 mol·L-1硫酸(1/2H2SO4)浸提后用钼锑抗比色法测定磷含量,灼烧的与未灼烧的差值即为有机磷含量[16]。
1.5 数据处理与统计分析
用SAS 8.1分析试验数据。最小显著差异法(LSD)进行显著性检验,显著水平为0.05。
2 结 果
2.1 施肥对植株生物量和磷含量的影响
盆栽试验中,玉米、蚕豆的地上部和根系干重在处理间无显著差异(图2A)。在CK和NPKM处理中玉米根冠比均为0.25,分别显著高于相应处理中的蚕豆(0.08和0.07)(图2B)。
施肥处理未显著影响玉米地上部及根系的磷浓度(图3A)。蚕豆的地上部磷浓度对土壤肥力也无显著响应,但是施肥处理提高了蚕豆根系的磷浓度,NPKM处理的蚕豆根系磷浓度较CK处理高57.6%(图3B)。
2.2 施肥对根际pH和酸性磷酸酶活性的影响
CK处理的玉米根际pH为7.07,显著高于空白土壤0.09个单位。CK处理的蚕豆根际pH与空白土壤无显著差异(图4)。NPKM处理的空白土壤pH与玉米根际pH间无显著差异,但NPKM处理的蚕豆根际pH为7.32,显著高于空白土壤0.11个单位,并且较玉米根际土壤高0.09个单位。
田间试验中,CK处理的玉米根际和非根际土壤pH显著高于施肥处理(NPK、NPKS、NPKM)
温室培养条件下,C K 处理玉米的根际酸性磷酸酶活性较空白土壤高1 9.7 n m o l·h-1·g-1(P<0.05),但NPKM处理的根际酸性磷酸酶活性与空白土壤无显著差异(图 6A)。CK处理的蚕豆根际酸性磷酸酶活性与空白土壤无显著差异,但显著低于玉米根际酸性磷酸酶活性。NPKM处理的蚕豆根际磷酸酶活性为29.4 nmol·h-1·g-1,分别高于空白土壤和玉米根际土磷酸酶活性89.7%和93.4%。NPKM处理的土壤有机磷浓度显著高于CK处理(图6B)。CK处理的土壤有机磷浓度范围为214~218 mg·kg-1,较NPKM处理低了103%~171%。CK处理的玉米、蚕豆根际土与空白土有机磷含量无差异。NPKM处理有机磷在根际出现了耗竭,玉米和蚕豆分别耗竭了138和86 mg·kg-1有机磷。
2.3 施肥对根际有机酸阴离子的影响
温室培养条件下的玉米和蚕豆根际中有机酸阴离子种类有酒石酸阴离子和苹果酸阴离子(表3)。CK处理空白土壤中未检测到酒石酸阴离子,但NPKM处理中有大量的酒石酸阴离子。NPKM中的玉米根际酒石酸阴离子浓度高于CK处理77.0%(P<0.05)。CK处理与NPKM处理的蚕豆根际酒石酸阴离子浓度无显著性差异。在CK处理的空白土壤中检测到了苹果酸阴离子,而NPKM处理中无苹果酸阴离子。CK处理和NPKM处理的玉米根际中均未检测到苹果酸阴离子。NPKM处理的蚕豆根际中存在苹果酸阴离子,CK处理中未发现苹果酸阴离子。
田间的玉米根际有机酸种类主要为苹果酸阴离子(图7)。NPKM处理的根际土壤中苹果酸阴离子含量高于CK处理3.57倍(P<0.05)。CK、NPK、NPKS处理的根际土壤中苹果酸阴离子含量无显著差异。
3 讨 论
(图 5A)。不同施肥处理显著影响了非根际土壤pH,长期施用化肥,显著降低了非根际土壤pH。玉米根际存在明显酸化现象,与非根际土相比,各处理根际土壤pH下降了0.3~0.51 个单位。NPK处理的根际土和非根际土pH显著低于其他处理。NPKS处理的根际土壤pH与NPKM处理无显著差异,但NPKS处理的非根际土壤pH显著高于NPKM处理。田间玉米根际酸性磷酸酶活性显著高于非根际土壤(图 5B),CK、NPK、NPKS、NPKM处理根际土酸性磷酸酶活性分别是非根际土的10.4倍、12.1倍、20.6倍和27.6倍。非根际土和根际土各施肥处理的酸性磷酸酶活性无明显差异。
3.1 缺磷对生物量与植株磷浓度的影响
已有研究表明,玉米和蚕豆生长受限制的临界地上部磷浓度分别为2.0和1.4 mg·g-1[17]。根垫试验中玉米和蚕豆的地上部磷浓度均大于临界浓度(图3),说明试验过程中作物未受到缺磷胁迫。可能原因是前期作物在含磷营养液中吸收了足够的磷,在缺磷营养液中的生长期短(15 d),不足以使地上部磷浓度降至临界浓度之下。因此,玉米和蚕豆的地上部生物量在CK处理和NPKM处理间无显著差异。田间土壤有效磷浓度大于20 mg·kg-1时,土壤供磷能力能够满足作物高产的磷需求[18-20]。本田间试验的黑土N P K、N P K M、NPKS处理的土壤有效磷浓度均大于20 mg·kg-1(表1),说明生长在以上处理中的玉米未受到缺磷胁迫,而CK处理中玉米根际的有效磷含量仅有11.8 mg·kg-1,可见玉米的生长受到缺磷胁迫。
3.2 根际过程对土壤有机磷的影响
土壤pH是影响有机磷形态转化与有效性的重要因素之一。土壤有机磷矿化的关键限速因子是土壤溶液中有机磷的浓度,即磷酸酶底物的浓度。植物可以通过改变根际pH来促进有机磷溶解或解吸,提高土壤溶液中有机磷的浓度[21]。本研究根际pH改变最高仅为0.11单位,不足以明显增加土壤溶液中有机磷的浓度。田间玉米根际土壤pH均明显低于非根际土,可能是由于取样期间的作物生长快,对土壤阳离子的吸收量高于阴离子,为平衡体内电荷,根系向根际分泌了大量质子,从而降低了根际pH,有利于土壤有机磷从土壤矿物中解吸和溶解,从而可能增加土壤溶液中有机磷的浓度,促进土壤有机磷的矿化。
大量研究表明,缺磷植物根系会分泌有机酸阴离子活化土壤磷来改善植物的磷营养,如白羽扇豆(Lupinus albus L.)、油菜(Brassica napus L.)、蚕豆(Vicia faba L.)[15]等。由于土壤有机磷与无机磷在化学特性上具有相似性,土壤有机酸阴离子对土壤有机磷的活化作用与无机磷类似,其机理是:(1)有机酸阴离子可通过竞争磷酸根的结合位点,改变吸附剂表面电荷,消除有机磷吸附位点;(2)有机酸阴离子通过与土壤中Fe、Al、Ca等金属离子的络合作用来释放被其固定的有机磷[8,22]。根系分泌的有机酸阴离子会增加根际溶液中有机磷的浓度,通过提高底物浓度,促进磷酸酶对有机磷的酶解作用;分解出的无机磷酸根离子被植物根系吸收,降低了产物浓度,促进了酶解反应的进行。根垫试验中,即使NPKM处理的空白土壤有很高的有机酸阴离子浓度(表3),但由于无根系吸收作用,一方面会抑制酶解反应的进行,另一方面,分解出的无机磷酸根离子会被微生物重新吸收,转化为有机磷。田间玉米根际有机酸阴离子以苹果酸为主(图7),与其他作物相似,充足的磷供应会促进玉米有机酸阴离子的分泌,与前人结论一致[17],这可能与作物代谢水平有关。根际有机酸阴离子浓度的增加,促进了与土壤中吸附态有机磷的交换过程,提高了土壤中有机磷的浓度,从而有利于土壤有机磷的矿化。根垫试验的玉米未检测到苹果酸,大田试验检测的主要是苹果酸,可能的原因是根垫试验中玉米分泌的苹果酸被微生物作为碳源利用了,具体的机制有待于今后进一步分析。
根垫试验的CK处理中玉米根际酸性磷酸酶活性显著高于空白土壤(图6)。由于玉米并未受到磷胁迫,酸性磷酸酶活性的增加可能归因于缺磷土壤微生物的分泌作用[23]。NPKM处理中土壤有效磷水平很高,土壤微生物与玉米均不缺磷,因此,根际酸性磷酸酶活性与空白土壤相比无明显的增加。与空白土壤相比,NPKM处理的蚕豆根际磷酸酶活性明显增加(图6A),这与以前研究不一致[24],这可能归因于蚕豆根系分泌物增加,使得土壤微生物的数量增加。田间玉米根际碳淀积对根际微生物的激发作用可能是根际酸性磷酸酶活性高于非根际土壤的原因[23]。根际酸性磷酸酶活性的增加有利于土壤有机磷的矿化。
根垫试验的NPKM处理中玉米和蚕豆明显耗竭了根际中的有机磷(图6B)。这可能与作物根系对磷吸收及根际过程对有机磷的活化和分解有关。CK处理中玉米与NPKM处理中蚕豆的根际酸性磷酸酶活性相似,但与土壤有机磷的浓度变化并不一致。说明根际过程不是决定土壤有机磷矿化的唯一因素。土壤有机磷作为底物,其浓度也是控制有机磷矿化的主要原因之一。CK处理的土壤有机磷浓度低,可以进入土壤溶液中的有机磷数量相对于NPKM处理要少得多,因此,矿化作用缺少底物,与NPKM处理相比,其有机磷浓度并未发现明显变化。在田间,长期施肥显著增加了土壤有机磷的积累(表1),提高了矿化过程的底物浓度,而玉米的根际过程又有利于土壤有机磷的矿化,因此,玉米根际过程与土壤有机磷浓度共同调控了土壤有机磷的矿化过程。
根际过程控制有机磷酶解过程,并与土壤有机磷浓度一起决定矿化过程的底物供应,因此,两者共同调控了农田土壤中有机磷矿化过程的速率。自20世纪80年代以来,大量有机肥和化肥的投入促进了作物的生长,有利于土壤有机磷的积累。由于作物根际过程和微生物过程的存在,使有机磷库成为了土壤有效磷的潜在来源。
4 结 论
土壤有机磷的矿化不仅受根际过程的调控,而且受土壤有机磷浓度的影响。长期施肥促进了黑土中的有机磷积累,增加了矿化作用的底物浓度,从而有利于矿化作用的进行。田间玉米的根际过程增强了矿化作用,维持了根层土壤供磷强度。因此,构建土壤高有机磷库,选择有机磷高效利用的作物品种,是维持黑土供磷能力、实现减磷增效的措施之一。

