晚期氧化蛋白产物对小肠上皮细胞线粒体膜电位的影响
谢芳,石洁,白岚
晚期氧化蛋白产物(advanced oxidation protein products, AOPPs)是体内氧化应激过程中由激活的中性粒细胞髓过氧化物酶产生的次氯酸(HClO)氧化蛋白质而形成的蛋白质氧化交联产物[1]。AOPPs在许多氧化应激损伤相关疾病如尿毒症、糖尿病、炎症性肠病、缺血性损伤等患者体内大量聚集[2-5],能够引起广泛的病理作用,参与疾病的发生与发展[6-7]。既往研究表明,模拟体内生成途径经体外制备的AOPPs均可通过氧化应激途径引起肾足细胞、软骨细胞以及心肌细胞凋亡,加重疾病损害[8-10]。我们的前期研究也发现,AOPPs能够诱发小肠上皮细胞(intestinal epithelial cells, IEC)生成大量的活性氧(reactive oxygen species,ROS),最终诱导细胞凋亡的发生,从而参与小肠慢性炎症过程[11]。线粒体是产生ROS的主要场所[12],并且线粒体信号通路是细胞凋亡最主要的途径之一[13]。当线粒体受到氧化应激时可导致线粒体对离子选择性通过作用减弱,降低线粒体膜电位(mitochondrial membrane potential,MMP),引发线粒体功能障碍,进一步诱发ROS的过量产生,形成恶性循环,最后导致细胞凋亡的发生[14]。有研究报道,晚期糖基化终产物受体(advanced glycosylation end product receptor, RAGE) 参与各种肠道炎症反应[15-16],并且介导由AOPPs引起的氧化应激相关凋亡过程[8]。然而,AOPPs对小肠上皮细胞MMP的影响及可能机制尚未阐明。本研究拟通过体外制备的AOPPs作用于培养的大鼠小肠隐窝上皮细胞系(IEC-6),观察MMP、ROS的水平及RAGE的变化,探索AOPPs对体外培养的IEC-6细胞MMP的影响及其相关机制,为深入研究AOPPs的致病作用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 IEC-6细胞系(中国科学院典型培养物保藏委员会昆明细胞库);DMEM高糖培养基、胎牛血清(美国Gibco公司);大鼠血清白蛋白(美国Sigma公司); 兔抗RAGE单克隆抗体(英国Abcam公司);小鼠抗GAPDH单克隆抗体(美国CST公司);JC-1线粒体膜电位检测试剂盒(美国BD公司);活性氧检测试剂盒(中国上海碧云天生物技术有限公司)等。
1.1.2 仪器 CO2恒温孵育箱(美国Thermo公司);超净工作台(苏州安泰设备厂);OLYMPUS BX40光学显微镜(日本OLYMPUS公司);离心机(美国Thermo公司);流式细胞仪(美国BD公司);移液器(德国eppendorf公司);化学发光凝胶成像系统(美国ProteinSimple公司)。
1.2 方法
1.2.1 IEC-6细胞培养 IEC-6细胞在37 ℃,5% CO2条件下,使用含10%胎牛血清的DMEM培养基,培养于25 cm2细胞培养瓶,隔天更换培养液。3~4 d后细胞生长融合达90%,消化、传代。
1.2.2 体外AOPPs的制备 参照文献[8]的方法在体外使用HClO作用于纯化的大鼠血清白蛋白制备AOPPs。
1.2.3 流式细胞术检测细胞MMP 细胞经AOPPs或阻断剂加AOPPs处理后,每组取5×106个细胞,加入1 mL细胞培养液和1 mL JC-1染色工作液,混匀后将其置于37 ℃培养箱孵育20 min,离心(1 000 r/min,4 min)取沉淀细胞,用JC-1染色工作液(1×)清洗,再用相同条件离心后加入2 mL细胞培养液重悬,上机检测。当MMP高时,在流式图上表现为FL1和FL2双阳性,而当MMP低时,表现为FL1单阳性。
1.2.4 Western blotting检测RAGE表达 收集AOPPs处理IEC-6细胞后的样本,使用RIPA裂解细胞提取总蛋白,紫外分光光度计检测各样本蛋白浓度。经10%聚丙烯酰胺凝胶电泳分离蛋白、转膜、室温封闭1h后,使用RAGE (1 ∶1 000)、GAPDH (1 ∶1 000) 一抗4 ℃孵育过夜,二抗(1 ∶3 000) 室温孵育1 h。将PVDF膜与超敏发光液(ECL)试剂反应1 min,使用化学发光凝胶成像系统扫描PVDF膜,AlphaView软件分析RAGE蛋白条带,使用GAPDH蛋白条带校正。
1.2.5 流式细胞术检测细胞ROS 按照1 ∶1 000用无血清培养基稀释DCFH-DA,使终浓度为10 μmol/L。细胞经AOPPs处理后,去除6孔板中细胞培养液,加入2 mL的DCFH-DA,37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,再用含0.25% EDTA的胰酶消化,最后收集细胞后用流式细胞仪检测。使用488 nm激发波长,525 nm发射波长,检测刺激前后荧光的强弱。
1.3 统计学方法
所有实验均重复3次或3次以上,结果以均数±标准差表示,采用SPSS 20.0统计学软件对实验数据进行处理。多组间均数的比较采用单因素方差分析,在比较前先计算方差齐性,方差不齐时采用Welch近似方差分析法。当方差齐时两两比较采用LSD法,方差不齐时采用Dunnetts T3法。P<0.05为具有统计学差异。
2 结果
2.1 AOPPs降低IEC-6细胞MMP
为了验证AOPPs对IEC-6细胞线粒体功能的影响,我们采用JC-1标记法检测MMP的变化。IEC-6细胞与AOPPs (200 μg/mL)孵育0、24 h、48 h、72 h后利用流式细胞仪进行检测。结果显示:各AOPPs刺激组发生线粒体膜电位下降的细胞比例(即Q4象限中的细胞比例,为FL1单阳率)明显高于对照组,且随着刺激时间的延长MMP下降越显著(P<0.05或P<0.01),见图1和表1。
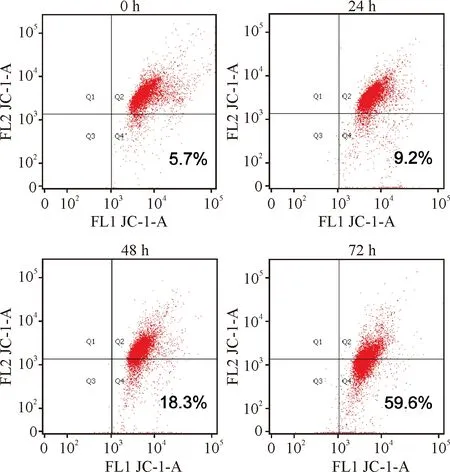
图1AOPPs呈时间依赖性降低IEC-6细胞线粒体膜电位
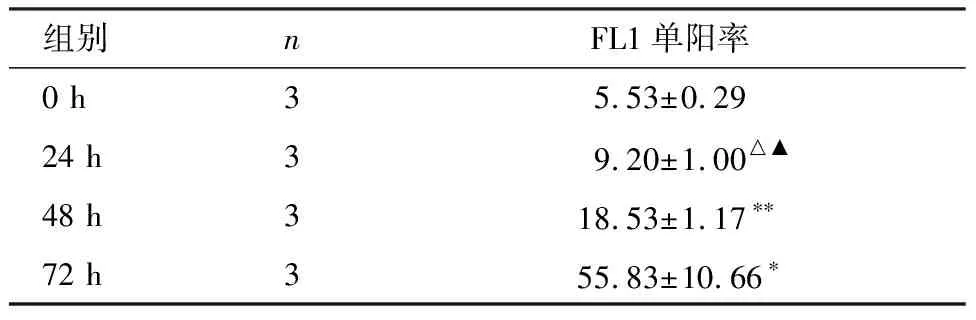
表1 AOPPs (200 μg/mL)刺激不同时间对IEC-6细胞线粒体膜电位的影响
注:多组间比较,采用Welch近似方差分析法校正,F=3.609,P=0.001;与0 h组比较,*P<0.05,**P<0.01;与48 h组比较,△P=0.002;与72 h组比较,▲P=0.049
2.2 AOPPs通过细胞膜受体RAGE介导IEC-6细胞MMP下降
为了验证AOPPs降低IEC-6细胞MMP是否由RAGE介导,我们首先采用200 μg/mL的AOPPs刺激0~24 h,以Western blotting检测RAGE的表达。如图2所示,AOPPs呈时间依赖效应上调IEC-6细胞RAGE的蛋白表达水平(P<0.05或P<0.01)。然后,我们采用了RAGE中和抗体进行阻断,IEC-6细胞与anti-RAGE (5.0 μg/mL)预孵育2 h后,再与AOPPs (200 μg/mL)孵育72 h,观察AOPPs刺激对IEC-6细胞MMP的影响。结果显示,anti-RAGE能够逆转AOPPs诱导的IEC-6细胞MMP下降(P<0.01),见图3和表2。
2.3 AOPPs诱导的IEC-6细胞MMP下降与ROS的生成有关
为了验证AOPPs诱导的IEC-6细胞MMP下降是否与ROS的生成有关,我们首先采用DCFH标记法检测ROS的产生。IEC-6细胞与AOPPs (200 μg/mL)孵育0、5 min、30 min、60 min和120 min后利用流式细胞仪检测产生的ROS。结果显示:AOPPs刺激后细胞内ROS迅速升高,且随着刺激时间的延长生成增加(P<0.05或P<0.01),见表3。接着,IEC-6细胞与超氧化物歧化酶SOD (200 U/mL)预孵育1 h后,再与AOPPs (200 μg/mL)孵育72 h,发现AOPPs诱导的IEC-6细胞MMP下降能被SOD逆转(P<0.01),见图3和表2。
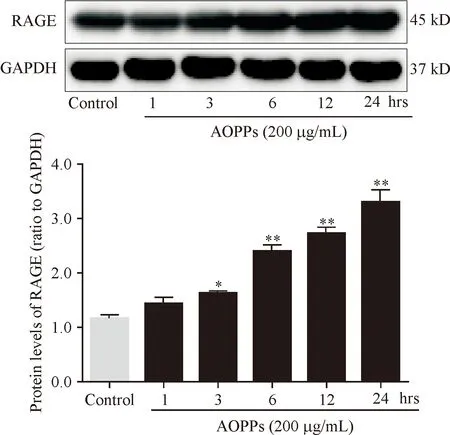
图2AOPPs呈时间依赖性上调IEC-6细胞RAGE表达 多组间比较,F=35.973,P=0.000;与Control组比较,*P<0.05,**P<0.01
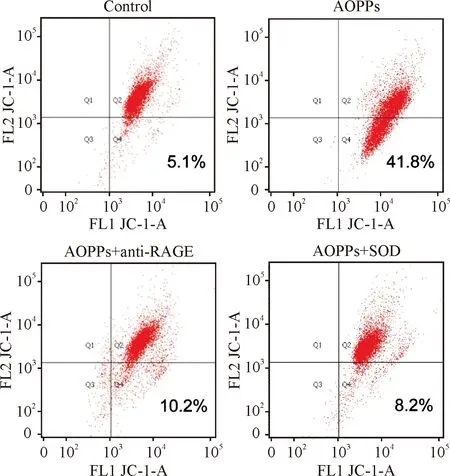
图3anti-RAGE、SOD阻断AOPPs诱导的IEC-6细胞线粒体膜电位下降
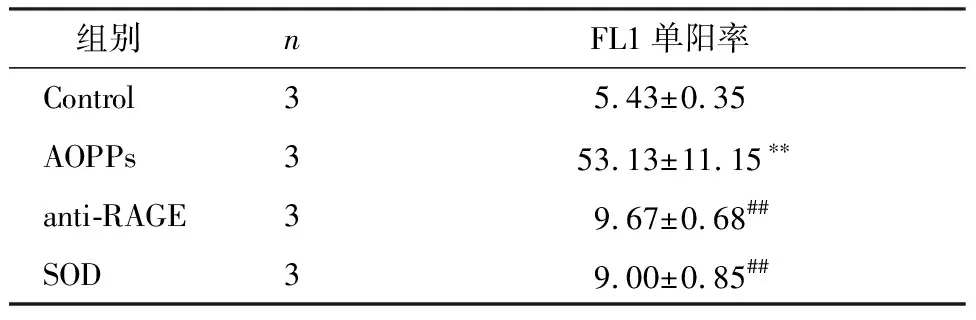
表2 不同阻断剂对AOPPs诱导IEC-6细胞线粒体膜电位下降的影响
注:多组间比较,F=48.859,P=0.000;与Control组比较,**P<0.01;与AOPPs组比较,##P<0.01
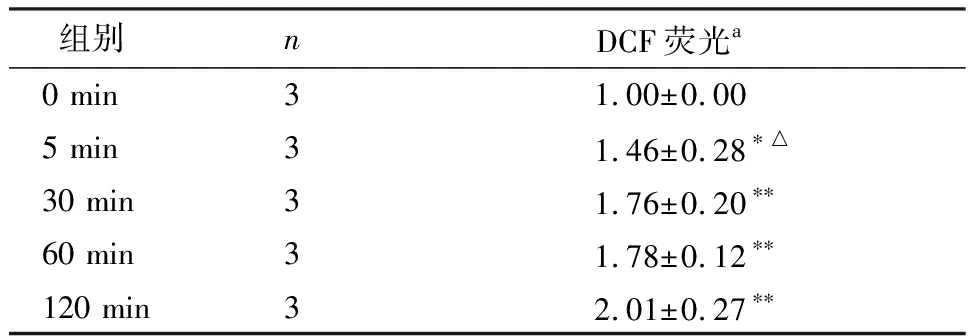
表3 AOPPs (200 μg/mL)刺激不同时间对IEC-6细胞内活性氧的影响
注:多组间比较,F=11.152,P=0.001。与0 min组比较,*P<0.05,**P<0.01;与120 min组比较,△P=0.007;a:与0 min组的比值
3 讨论
线粒体是细胞发挥正常生物学效应的最主要能量来源,其正常产能有赖于膜电位的稳定。正常MMP电位内负、外正,是维持线粒体呼吸链和氧化磷酸化正常调控的前提,是保持线粒体能量产生所必需的[17]。膜电位异常会导致线粒体发生一系列的功能和状态的变化,使呼吸链异常,诱发能量生成障碍[18]。由此可见,正常的MMP是线粒体功能和结构的重要基础,对于维持细胞的正常生命活动具有重要意义。本研究显示,与对照组相比较,AOPPs刺激组IEC-6细胞MMP显著下降,表明AOPPs对IEC-6细胞线粒体功能造成损害,可能进一步引起细胞功能异常。
近年来,作为调节细胞氧化应激反应的重要细胞膜受体,RAGE逐渐成为研究热点。RAGE是免疫球蛋白超家族的成员,参与了多种配体信号的传递,包括晚期糖基化终产物(AGEs)和AOPPs[19]。RAGE通过传递来自细胞外环境的信号在上皮细胞功能障碍中发挥关键作用[20-21]。在本研究中,我们发现AOPPs呈时间依赖性上调RAGE的表达,并且AOPPs诱导的IEC-6细胞MMP下降是由RAGE介导的。因此,我们推测,当AOPPs与细胞膜受体RAGE相互作用时,激活细胞内氧化途径,使膜两侧的离子梯度发生改变,导致MMP下降,启动细胞功能障碍。
研究表明,机体受到氧化应激以后,细胞内产生大量的ROS,导致细胞的氧化还原系统平衡受损,进一步诱导线粒体产生过量的ROS积聚,诱发线粒体通透性转换孔的持续开放,引起MMP下降,使线粒体功能发生障碍[14,22-23]。本研究中,用200 μg/mL的AOPPs对IEC-6细胞进行处理,发现与对照组相比,AOPPs处理的IEC-6细胞其活性氧水平显著上升,说明AOPPs刺激时,IEC-6细胞内的正常氧化还原被打破。当使用超氧化物歧化酶SOD清除细胞内ROS后,AOPPs诱导的IEC-6细胞MMP下降被逆转,提示ROS增多是AOPPs诱导IEC-6细胞MMP下降的关键因素。因此,减少ROS的生成就显得尤为重要。
综上所述,AOPPs能够降低IEC-6细胞的MMP,其作用机制可能与细胞膜受体RAGE和细胞内ROS传递信号有关。本研究为开展后续的实验工作(如AOPPs调控线粒体功能与细胞凋亡的关系等)提供方向,并有望进一步探究有效的抗氧化剂,为药物研发提供实验依据。

