重度子痫前期胎盘microRNA谱差异表达研究
李晓娟 周芝熠 王珏 钱源2.3.*
(1.昆明医科大学第一附属医院 产科,云南 昆明 650032;2.云南省检验医学重点实验室,云南 昆明 650032;3.云南省内设研究机构实验诊断研究所,云南 昆明 650032;4.昆明医科大学第一附属医院医学 检验科,云南 昆明 650032)
子痫前期是妊娠期特有疾病,对母儿健康造成严重损害,重度子痫前期是引起孕产妇及新生儿患病率和死亡率增加的主要原因。有研究显示3%~8%的孕期妇女可发生子痫前期,并与妊娠期高血压和蛋白尿有关[1]。目前子痫前期的发病机制尚未明确,普遍认为子痫前期是多种因素共同作用的结果,如滋养细胞功能障碍、子宫螺旋动脉重塑障碍、血管内皮细胞广泛损伤、母胎免疫不耐受等[2]。胎盘娩出后子痫前期病情可明显好转,提示其病因可能与胎盘相关。子痫前期不仅危害母体,还可对后代造成不良影响,Kajantie E等[3]研究发现子痫前期可通过胎儿宫内内皮功能障碍增加后代患心血管疾病的概率。早期有效的预测手段将有助于降低子痫前期的发病率,减轻该病的严重性,减少并发症及改善围生期不良结局。
microRNA 是一类长约22个核苷酸的单链非编码RNA,可以通过与靶mRNA的3'UTR 完全或不完全互补配对结合,导致靶基因降解或抑制其蛋白质翻译,从而参与基因的表达调控,在发育、分化、细胞增殖、凋亡等基本的细胞生物学过程中起重要作用[4]。microRNA对基因进行翻译后水平的调节,Pineles BL等[5]于2007年首次报导胎盘组织中microRNAs差异表达,并提示胎盘中microRNA差异表达可能与子痫前期的病理机制相关。此后多项研究发现重度子痫前期患者胎盘组织中microRNA的表达水平显著高于正常孕妇[6]。最近的一些研究表明microRNA在调节胎盘发育和功能方面起着重要作用[7]。尤其是对于子宫螺旋动脉重铸、滋养细胞增殖、侵袭功能、内皮功能、上皮间质转化、Ca2+反应及NO产生等方面起调控作用。本研究通过将重度子痫前期患者microRNA表达谱与正常孕妇的对比筛选,寻找差异表达的microRNA,为探究microRNA在重度子痫前期发病机制中的作用提供依据,为探寻新的重度子痫前期诊断标记物及潜在治疗靶点提供依据。
1 对象与方法
1.1 研究对象
1.1.1 实验组选取2016年在昆明医科大学第一附属医院住院分娩的3例重度子痫前期患者。重度子痫前期组的诊断标准按照美国妇产科医师学会的要求,以下表现则作为子痫前期的严重表现[8]:①收缩压≥160mmHg或舒张压≥110mmHg(卧床休息,两次血压测量间隔至少4h);②血小板减少(血小板<100×109/L);③肝功能损害(血清转氨酶水平为正常参考值2倍以上),严重的持续右上腹或上腹痛,对药物治疗没有反应,并排除其他诊断,或两者兼而有之;④进行性肾功能不全(血清肌酐浓度大于1.1mg/dl(97.2umol/L)或在无其他肾脏疾病的情况下血肌酐浓为正常参考值2倍以上);⑤肺水肿;⑥新发生的脑功能或视觉障碍。
1.1.2 对照组选取同时期相同孕产次的3例正常患者。
1.1.3 排除标准合并原发性高血压、心血管疾病、肝肾疾病、糖尿病、肿瘤、急慢性感染性疾病及胎儿染色体异常或发育畸形等妊娠合并症病史。所选样本均经过昆明医科大学第一附属医院伦理委员会批准,每位研究对象均已签署知情同意书。
1.2 研究方法
1.2.1 胎盘组织处理及microRNA的分离及提取胎盘娩出后,选取胎盘上无钙化和出血点的部位,从母体面至胎儿面采集数块面积约1cm×1cm×1cm的胎盘组织,并用生理盐水反复漂洗去除血液等,用纱布吸干后加入RNA later后置于-80℃的冰箱保存,准备对等量混合后组织中Total RNA的提取。
1.2.2 microRNA测序分析样品检测合格后,使用Small RNA Sample Pre Kit构建文库,文库构建完成后,先使用Qubit2.0进行初步定量,稀释文库至1ng/ul,随后使用Agilent 2100对文库的insert size进行检测,符合预期后使用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>2nM)。库检合格后通过illumina HiSeqTM2500平台进行高通量测序,测序及结果分析由北京诺禾致源公司完成。
1.2.3 microRNA数据分析对高通量测序结果进行质量评估后用bowtie将长度筛选后的sRNA定位到参考序列上,分析small RNA在参考序列上的分布情况,将上述mapped到参考序列上的reads,与miRBase中指定范围序列进行比对,得到各样品匹配上的sRNA的详细情况。对各样本中已知和新microRNA进行表达量的统计,并用TPM进行表达量归一化处理。并对样品间基因表达水平进行相关性分析以检验实验可靠性和样本选择是合理性。
1.3 microRNA差异表达分析及筛选方法对样品采用基于负二项分布的DESeq进行分析,从差异倍数(Fold change)和校正后的显著水平(padj/qvalue)两个水平进行评估,以qvalue<0.01 、log2(foldchange)>1为筛选条件对差异microRNA进行筛选。再用火山图推断差异microRNA的整体分布情况,将所有比较组合差异microRNA的并集在每个实验组中的TPM值,用R语言中的pheatmap聚类软件包进行层次聚类分析。
1.4 microRNA靶基因预测、候选靶基因GO富集分析及KEGG分析使用miRanda软件(http://www.microrna.org/microrna/home.do)对差异microRNA进行靶基因预测,之后我们对每组差异表达的microRNA靶基因集合通过GOseq方法进行Gene Ontology富集分析,应用KOBAS进行KEGG富集分析,以P<0.05为筛选标准。
2 结果
2.1 正常孕妇与重度子痫前期患者胎盘组织基因表达水平相关分析显示R2=0.975,spearman相关系数为0.905,kendall-tau相关系数为0.788,表明样本选择合理、实验可靠(图1)。
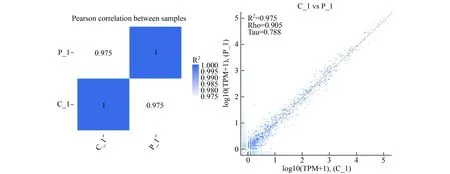
图1 样品间microRNA表达量相关性示意图
横坐标与纵坐标分别为为样品的log10(TPM+1)(R2:pearson相关系数方;Rho:spearman相关系数;Tau:kendall-tau相关系数)。
2.2 实验筛选出931个差异表达的microRNA,有41个microRNA符合q value<0.01 、log2(fold change)>1的筛选条件,其中22个表达上调,19个表达下调(表1)。差异microRNA火山图、整体层次聚类图显示这些microRNA在两组中有显著差异(图2)。
2.2 对候选靶基因KEGG富集最显著的20条分析结果显示:候选靶基因功能富集通路与Rap1信号通路、雌激素信号通路、焦点黏着、FcγR介导的吞噬作用、调节干细胞多能性的信号通路、钙信号通路、炎症介质调节的TRP通道、Ras信号通路、TGF-β信号通路的炎症介质调节等相关见表2。

图2 差异miRNA火山图、整体层次聚类图火山图:横坐标代表miRNA在不同实验组中表达倍数化,纵坐标代表miRNA表达量变化的统计学显著程度,图中的散点代表各个miRNA,蓝色圆点表示无显著性差异的miRNA,红色圆点表示显著上调的差异miRNA,绿色圆点表示显著下调的差异miRNA;聚类图:以log10(TPM+1)值进行聚类,红色表示高表达miRNA,蓝色表示低表达miRNA

microRNA差异倍数Pq表达调控hsa-miR-373-3p1.01690.00139980.007363uphsa-miR-433-3p1.02672.6415E-082.02E-07uphsa-miR-205-5p1.02738.038E-752.67E-73uphsa-miR-450b-5p1.13914.9045E-571.27E-55uphsa-miR-144-5p1.1921.48E-1411.1E-139uphsa-miR-450a-5p1.27141.1581E-492.84E-48uphsa-miR-324-5p1.28462.1329E-061.37E-05uphsa-miR-503-5p1.37652.4164E-647.03E-63uphsa-miR-335-3p1.64494.126E-1001.83E-98uphsa-miR-767-5p1.94130.000731910.003939uphsa-miR-378a-5p2.14550.000293440.001646uphsa-miR-1269b6.26442.7481E-132.61E-12uphsa-miR-498-1.00783.3985E-548.55E-53downhsa-miR-29a-3p-1.03238.822E-1537.5E-151downhsa-miR-520a-3p-1.03400downhsa-miR-154-5p-1.05310.000604030.003289downhsa-miR-218-5p-1.10712.5119E-263.6E-25downhsa-miR-146b-5p-1.11192.759E-314.35E-30downhsa-let-7b-5p-1.11554.0015E-336.77E-32downhsa-miR-320a-1.11942.6333E-831.07E-81downhsa-miR-151a-5p-1.12928.5492E-137.96E-12downhsa-miR-521-1.15051.0939E-362.04E-35downhsa-miR-34a-5p-1.22061.2455E-171.43E-16downhsa-miR-483-5p-1.23915.6036E-073.75E-06downhsa-miR-519e-3p-1.34992.0849E-121.87E-11downhsa-miR-376c-3p-1.39343.5137E-396.96E-38downhsa-miR-381-3p-1.42641.428E-2371.5E-235downhsa-let-7e-5p-1.46019.9213E-452.31E-43down

续表
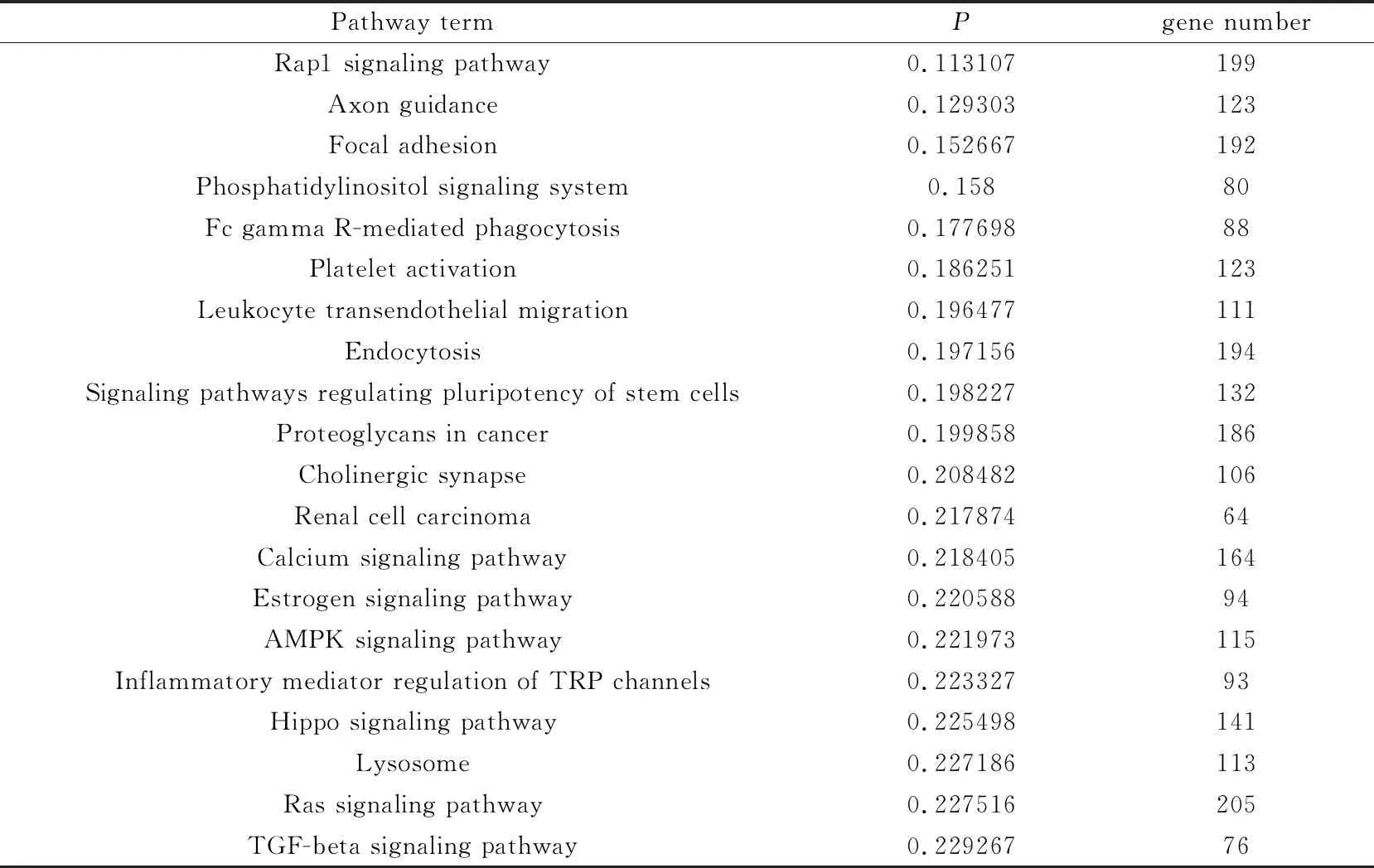
表2 候选靶基因KEGG富集集最显著的20条通路
3 讨论
子痫前期的发病机制目前尚未明确,国内外多项研究认为其病理根源在于胎盘,胎盘功能障碍与子痫前期发生、发展密切相关。子宫螺旋动脉重塑不良、胎盘缺氧、滋养细胞功能障碍、炎症反应和内皮功能障碍在子痫前期发病机制中起关键作用,目前已有多项关于子痫前期患者胎盘中microRNA表达谱的研究表明子痫前期胎盘microRNA存在差异表达,且与子痫前期密切相关[9, 10]。可推测胎盘中过表达的microRNA可能过度降解对子痫前期起抑制作用的靶mRNA,导致相关蛋白表达下降;相反,低表达的microRNA可能对促进子痫前期发生发展的靶mRNA抑制不足,导致相关蛋白表达上调。这些差异表达的microRNA可能通过调节相应的靶基因,通过不同的信号通路在子痫前期的病理过程中发挥重要作用。
此次重度子痫前期胎盘差异表达的microRNA候选靶基因功能富集通路与细胞增殖、黏附、迁移、雌激素信号通路、钙调节、炎症介质调节、TGF-β信号通路等相关,这些通路异常与子痫前期发生、发展密切相关。这些信号通路与胎盘滋养细胞增殖、侵袭等功能密切相关,滋养细胞功能障碍可导致螺旋动脉重铸不良、胎盘浅着床,胎盘缺血、缺氧引起炎症因子释放导致内皮损伤,诱发全身血管收缩、体液外渗诱导子痫前期的发生。其中部分通路已被验证和子痫前期发病相关。Schiessl B等人的研究表明雌激素受体(estrogen receptor, ESR)在子痫前期患者胎盘组织中高表达,ESR可能通过影响滋养细胞的功能参与子痫前期的发生、发展[11]。妊娠期母体易缺钙,细胞内Ca2+浓度与血管平滑肌的兴奋性有关,血管内皮素(ET-1)可使细胞内钙通道开放,使Ca2+向细胞内转移,使平滑肌兴奋性增加,同时Ca2+还与NO的生成和活性维持有关,低Ca2+时NO生成减少,这些都可引起血管收缩导致血压升高[12]。
侵袭性绒毛外滋养细胞重建子宫螺旋动脉可增加血管直径,使胎盘血流灌注增加,这一过程异常可引起胎盘缺氧,导致滋养细胞功能紊乱诱发子痫前期。此次研究通过对重度子痫前期组及对照组microRNA表达谱进行对比,筛选出了41个差异表达的microRNA。其中大部分microRNA是否与子痫前期发生、发展相关尚未见报导,需进一步研究证实。此次研究发现在重度子痫前期胎盘中hsa-let-7b-5p和hsa-let-7e-5p表达水平下调。目前已有关于let-7家族的研究表明其与子痫前期相关,但具体机制有待进一步研究。Xu Dai等人[13]研究发现低表达水平的miR-let-7d除了可促进子痫前期滋养细胞的增殖、分化和侵袭能力,在抑制细胞凋亡方面起着重要作用,miR-Let-7d可能成为子痫治疗方法的研究中的潜在靶基因。目前研究发现Let-7是一种低氧反应性miRNA,低氧条件下let-7水平升高,通过其靶基因AGO1(argonaute 1)上调血管内皮生长因子(VEGF)促进血管生成[14, 15]。同时研究发现let-7c与抗凋亡基因Bcl-xLmRNA结合,通过抑制Bcl-x L转录,从而诱导细胞凋亡[16]。缺氧和细胞凋亡都与子痫前期的发生相关,hsa-let-7b-5p和hsa-let-7e-5p是否参与子痫前期的发生、发展有待进一步研究。
研究发现胎盘可通过称为外泌体的小纳米囊泡与母体生理学进行交流,胎盘细胞分泌的外泌体在妊娠6周就可从母体循环中被鉴定出来,并且它们的浓度随着胎龄的增加而增加[17]。这些信号分子被认为在多泡体与细胞膜进行胞外融合后从母细胞释放到外泌体中。一旦外泌体被释放到细胞外空间,一些外泌体就有能力沿着体循环以非激素信号或通信的形式与体内的远处组织相互作用。由于外泌体在体循环,它们为起源组织的无创活检的发展提供了机会,这为筛选和诊断相关疾病标志物提供了新的途径[18]。已有研究证实了组织特异性外泌体在子痫前期诊断中的应用价值,可作为子痫前期潜在的生物标记物[19]。Carlos Salomon等人[20]对无症状的妇女外泌体进行检测,发现随后发展为子痫前期的孕妇血浆中的外泌体浓度明显大于对照组,认为对母血中存在的胎盘衍生外泌体进行定量,并通过对标记物miR-486-1-5p和miR-486-2-5p表达量检测,可以及早发现有子痫前期风险的无症状妇女。Lauren Anton等人的研究发现血清miR-210在子痫前期临床症状出现前数月就已升高,miR-210有望成为子痫前期新的预测性血清生物标志物,有助于识别高危孕妇[21]。此次研究中差异表达的microRNA尚未行外泌体研究验证,尚需进一步研究证实它们是否是子痫前期潜在的生物标记物。
子痫前期发病机制是十分复杂的,发病过程远在临床体征出现之前,因此很难找到识别早期的生物标志物。目前重度子痫前期管理多通过类固醇来诱导胎儿肺成熟和及时分娩结束妊娠,若能及早预测子痫前期发生,并提出有效的方法来阻止这一过程,将有助于减少子痫前期及其相关并发症的发生。通过对子痫前期胎盘组织中差异性表达的microRNA的检测研究,筛查出差异表达的microRNA并通过进一步研究探索差异表达microRNA与子痫前期发病的相关性,通过检测相应外泌体水平作为标记物。为妊娠期及早筛查出子痫前期的高危孕妇,进而对其进行干预,改善妊娠结局提供可能性。通过此方法筛选出子痫前期相关 microRNA有望成为子痫前期预测、诊断的标志物及治疗的靶点。

