砂生槐根瘤内生细菌多样性及其促生潜力研究
何建清 张格杰 赵伟进
摘要:以珍稀植物砂生槐为材料,对该植物根瘤内生细菌种群组成及其促生潜力进行研究,为砂生槐在荒漠化地区生态恢复与重建中的应用提供理论依据。采用YMA培养基通过平板涂布分离法分离内生细菌,通过16S rDNA序列同源性分析其遗传多样性,采用溶磷圈和钼锑抗比色法测定溶磷能力,Salkowski比色法测定IAA分泌量,微量凯氏定氮法测定固氮量。结果表明,从砂生槐根瘤中分离到19株代表性内生细菌,分别属于芽孢杆菌属(Bacillus)、解糖假苍白杆菌(Pseudochrobactrum)、类芽孢杆菌属(Paenibacillus)、沙雷氏菌属(Serratia)和普罗威登斯菌属(Providencia)等5个属,其中芽孢杆菌属为优势菌属。在19株供试细菌中,7株具有良好的溶解无机磷能力,溶磷量达到 100 mg/L 以上;6株菌株具有良好的溶解有机磷能力,溶磷量达到42 mg/L以上;5株菌株具有良好的固氮能力,固定氮量达 44 mg/L 以上;3株菌株具有良好的IAA分泌能力,IAA分泌量达45 μg/mL以上。利用种子发芽指标测定高溶磷菌株的促生能力,其中菌株R24能明显提高砂生槐种子的萌发率。综上,西藏砂生槐根瘤内生细菌遗传多样性丰富,且具有良好促生能力,是重要的生物资源。
关键词:砂生槐;根瘤;内生细菌;16S rDNA;促生能力
中圖分类号: S182 文献标志码: A 文章编号:1002-1302(2019)12-0297-05
在研究根瘤菌与豆科植物共生关系的过程中,人们发现根瘤中同时定居着许多与根瘤菌不同的内生菌,这些非共生细菌生活在根瘤中,但不引起植物产生明显的病害,为根瘤内生细菌[1-2]。植物内生细菌不仅将植物作为其栖息场所,而且对宿主植物有促生、防病、内生联合固氮等广泛的生物学作用[3-6],根瘤内生细菌也有类似的作用[7-9]。植物内生细菌因具有多方面的生物学和生态学功能,成为潜力巨大、尚待开发的微生物新资源,受到广泛重视[10-11]。相对于植物其他组织部位的内生细菌而言,关于根瘤内生细菌的研究相对较少。
砂生槐(Sophora moorcroftiana),别称西藏狼牙刺、刺柴、金雀花等,藏语名吉瓦,为豆科槐属多年生矮灌木,是青藏高原特有种[12-13]。砂生槐灌丛主要分布在雅鲁藏布江流域中段的宽谷、两侧低山及拉萨河、年楚河等主要支流的宽谷内。作为典型的河谷灌丛,砂生槐具有良好的防风固沙、涵养水源等重要生态作用[14-15]。目前关于砂生槐的研究主要集中在种群和群落结构、繁殖特性、固沙特性和物种多样性等方面[16-18],迄今未见关于砂生槐根瘤内生细菌及其促生性的研究报道。鉴于此,本研究以西藏砂生槐根瘤为研究材料,探讨砂生槐根瘤内生细菌资源多样性及其促生潜力,为其在西藏荒漠化地区生态恢复与重建中的应用提供理论依据。
1 材料与方法
1.1 根瘤的采集
2017年5—7月分别从西藏米林县、朗县、加查县、林周县、白朗县、拉萨市、日喀则市、贡嘎县、扎囊县等地采集盛花期和结荚期砂生槐根瘤样品。将采集的结瘤砂生槐根部装入无菌自封袋中,并置于装有冰袋的塑料泡沫箱内,带回实验室备用。
1.2 培养基及试剂
本研究所用的培养基参照文献[19]配制,其中甘露醇酵母汁(YMA)培养基用于根瘤内生细菌的分离与纯化;营养琼脂(NA)培养基用于细菌的活化培养与保存;阿须贝(Ashby)无氮培养基用于固氮菌的分离及固氮能力的测定;磷酸三钙无机磷(PKO)培养基和蒙金娜有机磷(PVK)培养基用于溶磷菌的分离及溶磷量的测定;无色氨酸King培养基[20]用于生长素分泌量的测定。S2比色液[21]。
1.3 砂生槐根瘤内生细菌的分离与纯化
砂生槐根瘤内生细菌的分离与纯化参照文献[22]。首先用自来水将附着于砂生槐根瘤上的泥土冲洗干净,放入75%乙醇中浸泡3 min,取出放入0.1%氯化汞溶液中进行表面灭菌3 min,再用无菌水洗涤5~6次,并将最后1次洗液涂布于YMA培养基上,置于28 ℃培养箱中培养2 d,若无菌落生成则表明根瘤表面消毒合格。将表面消毒合格的根瘤依次装入盛有 0.5 mL 0.85% NaCl的离心管中,用已灭菌枪头将其压碎。吸取0.5 mL根瘤汁液均匀涂布于YMA培养基上,将培养皿倒置,28 ℃培养3~7 d。用划线法进行纯化,并将纯化后的细菌转接于NA斜面培养基上,4 ℃保存备用。
1.4 砂生槐根瘤内生细菌遗传多样性分析
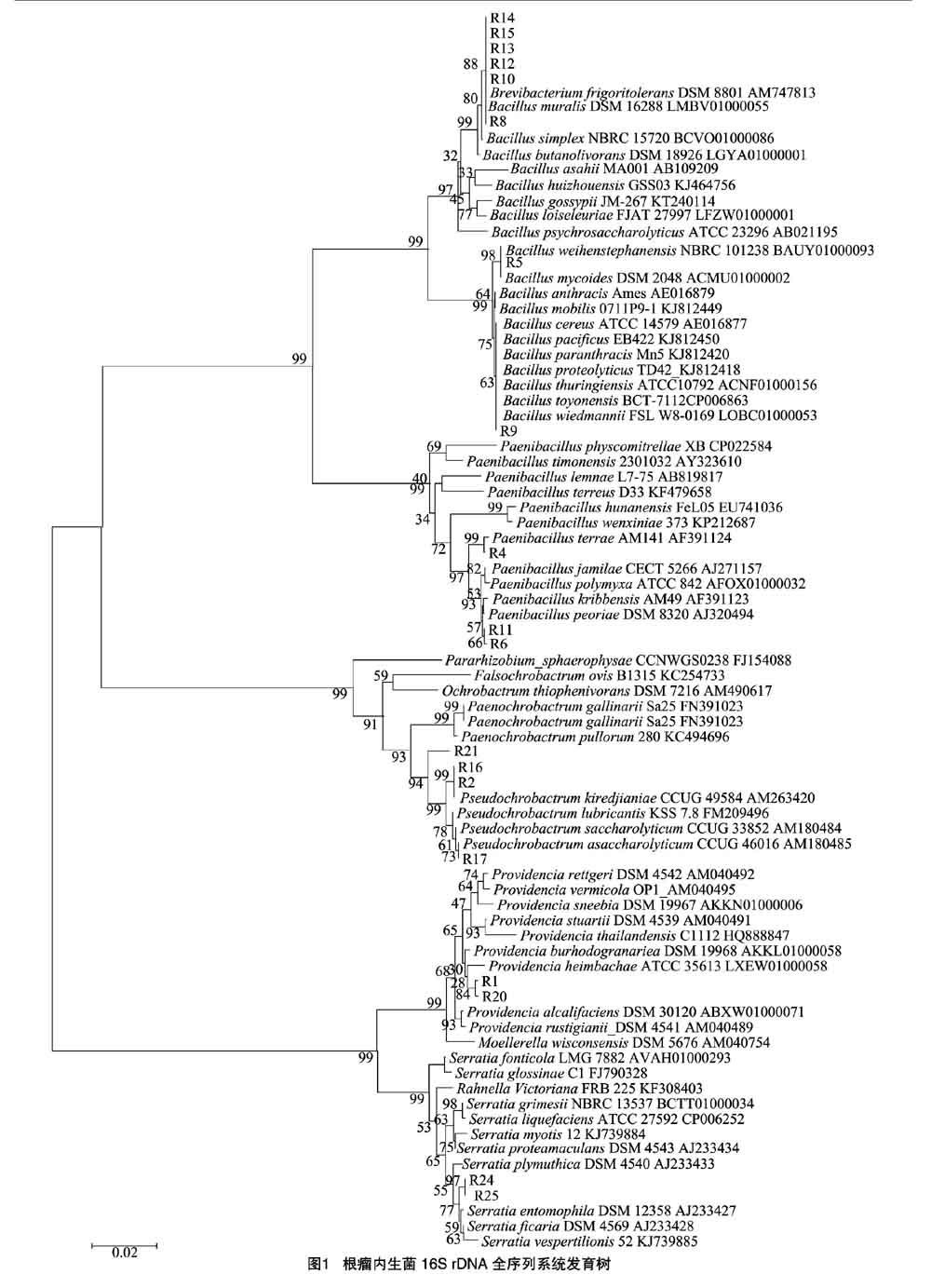
用NA液体培养基将菌株培养至对数生长期,离心收集菌体,按照黄宝灵等的方法[23]提取菌株总DNA,采用16S rDNA通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和 1 492R:5′-GGTTACCTTGTTACGACTT-3′[24]进行PCR扩增。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸10 min,共30个循环。取PCR产物在 0.7%的琼脂糖凝胶上进行电泳。PCR产物经琼脂糖凝胶电泳后回收纯化测序(上海英骏生物技术有限公司),将所测得的基因序列与GenBank中的相关数据进行Blast相似性比对分析,然后用DNA分析软件ClustalX 1.8进行多重序列比较,再用MEGA 5.0软件通过邻接法(neighbour-joining)建立系统进化树。
1.5 砂生槐根瘤内生细菌促生能力研究
1.5.1 溶磷能力测定 定性测定:采用溶磷圈法测定待测菌株的溶磷能力。定量测定:采用钼锑抗比色法定量测定上清液中有效磷的含量和pH值[25]。
1.5.2 固氮能力 定性测定:将待测菌株菌悬液涂布在Ashby无氮固体培养基上,28 ℃培养48 h后观察生长情况。定量测定:采用微量凯氏定氮法测定菌株的固氮量。固氮量根据以下公式[26]进行计算:
N=[(V1-V2)×14×1 000]/V。
式中:V1为样品滴定时所用的0.005 mol/L标准硫酸溶液体积,mL;V2为空白滴定时所用的0.005 mol/L标准硫酸溶液体积,mL;14为1 mmol氮的质量,mg;V为菌株培养液样品体积,mL。
1.5.3 产IAA能力 采用Salkowski比色法[21]测定菌株分泌植物生长激素(IAA)的性能。Salkowskis(S2)比色液配制:FeCl3 4.5 g,溶于1 L 10.8 mol/L浓硫酸中。将0.3 mL菌悬液接种于盛有30 mL已灭菌无色氨酸King培养基中,在 28 ℃、150 r/min 恒温摇床上振荡培养7 d,12 000 r/min离心 10 min,每菌株取0.1 mL上清液滴至检测板上,加等量S2比色液,另取比色液0.1 mL,分别加入50、30、10 mg/L标准植物生长激素0.1 mL作梯度对照,室温静置15 min后观察颜色变化,确定菌株是否具有分泌IAA的能力。取能够分泌IAA菌株的上清液1 mL加入等量S2比色液中,于黑暗中静置30 min后用紫外分光光度计在530 nm处测定吸光度,根据标准曲线计算各菌株的IAA分泌量。
1.5.4 溶磷菌对砂生槐种子萌发的影响 将溶磷能力较高的菌株接种于PVK液体培养基中,28 ℃ 200 r/min振荡培养3 d,备用。种子在处理前先用75%乙醇溶液浸泡3 min,再用0.1% HgCl浸泡5 min,然后用无菌水冲洗5~6次。用各菌株液体浸没砂生槐种子(标准为刚好浸没),处理4 h后倒掉处理液,阴干。将各处理的60粒种子(每皿20粒,3次重复)均匀放入铺有3层无菌湿润滤纸的培养皿(直径9 cm)中,于 25 ℃ 条件下暗培养7 d。发芽期间每天定时喷洒无菌水2次并检查种子发芽情况,以胚根伸出种壳长度达1/2种长为发芽标准,按下列公式计算发芽率:
发芽率=7 d种子发芽数/供试种子数×100%。
2 结果与分析
2.1 内生细菌的分离纯化
通过划线分离、革兰氏染色镜检、菌落形态观察等方法,从经表面灭菌处理的砂生槐根瘤样品中分离纯化获得45株砂生槐根瘤内生细菌,通过形态特征和培养特征去重复后获得19株代表菌株。
2.2 砂生槐根瘤内生细菌的遗传多样性分析
对19株代表性菌株的16S rDNA基因片段进行序列测定,利用NCBI中的Blast对测序结果进行同源性比对搜索,运用MEGA 5.0构建系统发育树。从系统发育树(图1)可以看出,砂生槐根瘤内生细菌属于5个不同的属,分别为芽孢杆菌属(Bacillus)8株、解糖假苍白杆菌(Pseudochrobactrum)4株、类芽孢杆菌属(Paenibacillus)3株、沙雷氏菌属(Serratia)2株和普罗威登斯菌属(Providencia)2株,其中,芽孢杆菌属为优势菌种,占所分离菌株的42.1%,与前人报道结果[27-28]相一致。
2.3 砂生槐内生细菌体外促生指标测定结果
2.3.1 溶磷能力测定 本试验测定了19株在无机磷和有机磷固体培养基上培养7 d的砂生槐根瘤内生细菌的溶磷圈直径(D)和菌落生长直径(d),并计算了相应的D/d值。在PKO培养基上,供试的19株菌株中有7株菌株能够产生溶磷圈,占供试菌株的36.8%,由表1可知,7株菌株的D/d值大小差异显著,D/d值分布在1.3~3.3之间,其中菌株R1的D/d值最大,为3.3。在蒙金娜有机磷培养基上,6株菌株能够产生溶磷圈,占供试菌株的31.6%,菌株的D/d值为 1.2~2.6(表2),其中菌株R2的D/d值最大,为2.6。为进一步确定各菌株溶磷能力的强弱,本研究利用钼锑抗比色法定量检测菌株溶磷能力。数据分析结果(表1、表2)显示,在以磷酸钙作为磷源的液体培养条件下,培养7 d后7个菌株的溶磷量为100.06~128.71 mg/L,其中菌株R1的溶磷能力最强,达128.71 mg/L,其次是菌株R21,溶磷量为 122.80 mg/L,两者溶磷量均与菌株R8溶磷量(最小溶磷量)之间差异显著(P<0.05)。在以卵磷脂为唯一有机磷源的液体培养条件下,6株菌株的溶磷量范围为42.60~92.70 mg/L,其中R24具有良好的溶解有机磷能力,溶磷量达 92.70 mg/L,其次是菌株R2,溶磷量为56.72 mg/L,两者溶磷量均与菌株R7溶磷量(最小溶磷量)之间差异显著(P<0.05)。通过上述分析得出,R7、R8和R10能同时降解无机磷和有机磷。
从表1、表2可以看出,在溶磷培养过程中,各菌株培养液的pH值均呈下降趋势,由最初的7.00下降到4.7~5.3之间,下降了1.7~2.3个单位。
2.3.2 固氮能力测定 利用微量凯氏定氮法测定固氮菌株的固定氮量,部分菌株表现较强的固氮能力,培养7 d固定氮量达到44 mg/L以上,菌株间的固氮能力存在显著差异(表3)。
2.3.3 IAA分泌特性 定性檢测结果(表4)显示,有7株菌株呈现出色泽不同的红色显色反应。从定量测定的结果看,菌株R17分泌IAA的能力最大,分泌量达49.22 μg/mL,与其余菌株的IAA分泌量之间具有显著差异(P<0.05);其次为菌株R20,IAA分泌量为48.40 μg/mL,与其余菌株的IAA分泌量之间均达到显著差异水平(P<0.05)。IAA分泌能力的定性和定量分析结果基本一致,即在定性测验中显色效果明显的菌株,对应的IAA分泌量也比较高。
2.3.4 种子发芽结果 从图2可以看出,除菌株R2、R10处理的发芽率小于对照外,菌株R7、R8、R16、R24均具有一定的促生效应,和对照相比,对应种子发芽率分别提高了20%、40%、40%和80%。
3 结论与讨论
本研究通过YMA培养基从砂生槐根瘤内分离到代表性内生细菌19株,16S rDNA序列分析结果显示,分离自砂生槐根瘤的內生细菌分别属于芽孢杆菌属(Bacillus)、解糖假苍白杆菌(Pseudochrobactrum)、类芽孢杆菌属(Paenibacillus)、沙雷氏菌属(Serratia)和普罗威登斯菌属(Providencia),其中Bacillus属为优势菌群,这与代金霞等关于根瘤内生细菌的研究结果[11,28]一致。在19株内生细菌中存在一些具有高效促进植物生长的特异菌株,这些菌株及菌株组合可用于西藏荒漠化地区的土壤改良和生态恢复等。
对比定量与定性测定数据发现,溶磷圈法的准确度远不及摇瓶复筛法,试验中,在解无机磷细菌筛选过程中,很多在使用溶磷圈法测定时没有溶磷能力的菌株,在复筛的过程中,发现其解磷能力较强。在解有机磷细菌筛选过程中发现,在卵磷脂平板上生长很好的菌株,放到摇瓶复筛时,其解磷能力很差,甚至没有解磷能力,这与朱培淼等的报道[29-30]一致,因此,建议在菌株筛选过程中,通过D/d值筛选出的溶磷菌株必须通过液体培养法来进一步判断其真实溶磷能力。
许多研究结果表明,影响根瘤菌与其宿主共生固氮的因素较为复杂,除遗传因素起主导作用外,生态环境也有可能成为生物生存的重要调节因素[2,31-32]。陈文新等认为,根瘤菌与豆科植物之间的共生结瘤关系比较复杂,受多种因素影响,根瘤菌与豆科植物的共生关系涉及细菌、植物及环境3方面的相互作用[33]。在调查采样中发现,并非所有地区的砂生槐都能够结瘤,只在米林县、朗县和山南地区水分条件较好、由地表径流冲刷形成的冲积沟底和两旁滩地上的砂生槐根系中发现根瘤,而其他地区的砂生槐根系中没有或极少着生有根瘤。这可能与青藏高原降水量少、蒸发强烈、气候干燥、温度较低等因素有关系,也可能与采样时间对砂生槐不适宜有关,因此对影响砂生槐能否结瘤的因素还需进一步研究。
参考文献:
[1]邱并生. 根瘤内生细菌[J]. 微生物学通报,2013,40(3):544.
[2]赵龙飞. 我国大豆根瘤内生菌资源多样性研究[J]. 广东农业科学,2014(9):15-19.
[3]Schulz B J,Boyle C.The endophytic continuum[J]. Mycological Research,2005,109(6):661-686.
[4]饶小莉,沈德龙,李 俊,等. 甘草内生细菌的分离及拮抗菌株鉴定[J]. 微生物学通报,2007,34(4):700-704.
[5]邱服斌,李雁津,张晓霞,等. 人参内生细菌ge21菌株的鉴定及抑菌活性测定[J]. 微生物学通报,2010,37(1):43-47.
[6]Zakhia F,Jeder H,Willems A,et al. Diverse bacteria associated with root nodules of spontaneous legumes in Tunisia and first report for nifH-like gene within the fenera Microbacterium and Starkeya[J]. Microbial Ecology,2006,51(3):375-393.
[7]Li J H,Wang E T,Chen W F,et al. Genetic diversity and potential for promotion of plant growth detected in nodule endophytic bacteria of soybean grown in Heilongjiang Province of China[J]. Soil Biology and Biochemistry,2008,40(1):238-246.
[8]Ibàez F,Angelini J,Taurian T,et al. Endophytic occupation of peanut root nodules by opportunistic Gammaproteobacteria[J]. Systematic and Applied Microbiology,2009,32(1):49-55.
[9]龚明福,韩 松,李 超,等. 苦豆子根瘤内生细菌分离及其对棉花枯萎病的生物防治效果测定[J]. 微生物学通报,2011,38(6):865-870.
[10]姜 怡,杨 颖,陈华红,等. 植物内生菌资源[J]. 微生物学通报,2005,32(6):146-147.
[11]代金霞,王玉炯,吴雪娟,等. 柠条根瘤内生细菌的抗逆性及遗传多样性[J]. 应用生态学报,2012,23(2):519-524.
[12]中国科学院中国植物志编辑委员会. 中国植物志:第40卷[M]. 北京:科学出版社,1994:77-78.
[13]张艳福,姚卫杰,郭其强. 干旱胁迫对砂生槐种子萌发和幼苗生长的影响[J]. 西北农林科技大学学报(自然科学版),2015,43(10):45-56.
[14]彭跃明. 西藏雅鲁藏布江中部流域砂生槐固沙作用研究[J]. 林业科技,1997,22(6):6-8.
[15]赵垦田,杨小林,马和平,等. 拉萨半干旱河谷砂生槐灌丛生态恢复过程的群落特征与土壤微生物动态分析[J]. 林业科学,2013,49(2):15-20.
[16]王文娟,贺达汉,唐小琴,等. 不同温度和沙埋深度对砂生槐种子萌发及幼苗生长的影响[J]. 中国沙漠,2011,31(6):1437-1442.
[17]杨兆平,沈渭寿,孙 明,等. 雅鲁藏布江中游河谷风沙化土地砂生槐群落结构特征[J]. 应用生态学报,2011,22(5):1121-1126.
[18]崔光帅,张 林,沈 维,等. 西藏雅鲁藏布江流域中段砂生槐灌丛生物量分配及碳密度[J]. 植物生态学报,2017,41(1):53-61.
[19]李振高,骆永明,滕 应. 土壤与环境微生物研究法[M]. 北京:科学出版社,2008:52-125.
[20]张 英,朱 颖,姚 拓,等. 分离自牧草根际四株促生菌株(PGPR)互作效应研究[J]. 草业学报,2013,22(1):29-37.
[21]曾庆飞,王 茜,陆瑞霞,等. 大豆根际促生菌的分离筛选及其对大豆和百脉根生长与品质的影响[J]. 草业学报,2017,26(1):99-111.
[22]丁雅迪,熊 智,王明月,等. 文山石漠化地区豆科植物根瘤内生细菌多样性分析[J]. 南方农业学报,2015,46(4):602-608.
[23]黄宝灵,吕成群,武 波,等. 一株分离自裸子植物罗汉松根瘤的根瘤菌[J]. 中国科学(C辑:生命科学),2007,37(1):52-57.
[24]Monis P T,Glglio S,Saint C P.Comparison of SYTO9 and SYBR Green I for real-time polymerase chain reaction and investigation of the effect of dye concentration on amplification and DNA melting curve analysis[J]. Analytical biochemistry,2005,340(1):24-34.
[25]Liu X X,Wang X L,Lu R X. Phosphorus solubilizing capability,IAA secretion and characteristics of phosphorus-solubilizing bacteria in rhizosphere of alfalfa in Guizhou Province[J]. Agricultural Science & Technology,2012,13(12):2554-2559,2576.
[26]胡春锦,林 丽,史国英,等. 广西甘蔗根际高效联合固氮菌的筛选及鉴定[J]. 生态学报,2012,32(15):4745-4752.
[27]龔明福,马玉红,李 超,等. 苦豆子根瘤内生细菌分离及表型多样性分析[J]. 西北植物学报,2009,29(2):408-411.
[28]钟宇舟,余秀梅,陈 强,等. 四川盆地大豆根瘤内生细菌的分离鉴定及促生效果[J]. 应用与环境生物学报,2017,23(1):46-53.
[29]朱培淼,杨兴明,徐阳春,等. 高效解磷细菌的筛选及其对玉米苗期生长的促进作用[J]. 应用生态学报,2007,18(1):107-112.
[30]郭艺鹏,王海儒,孙林琦,等. 枣根际解磷细菌的分离筛选及16S rDNA鉴定[J]. 河南农业大学学报,2015,49(6):811-816,837.
[31]赵龙飞,邓振山,杨文权,等. 我国西北部分地区豆科植物根瘤菌资源调查研究[J]. 干旱地区农业研究,2009,27(6):33-39.
[32]何恒斌,贾昆峰,贾桂霞,等. 沙冬青根瘤菌的抗逆性[J]. 植物生态学报,2006,30(1):140-146.
[33]陈文新,汪恩涛,陈文峰. 根瘤菌-豆科植物共生多样性与地理环境的关系[J]. 中国农业科学,2004,37(1):81-86.

