土壤化学性质和微生物群落结构与姜瘟发生相关性分析
陈艳丽 姚爱梅 徐义


摘要:受土壤酸化及集约化连作种植的影响,姜瘟成为制约生姜产业发展的重要因子,但在重庆市荣昌区发现一些连续种植10年以上的姜田姜瘟发生较轻或不发生。为了解土壤因子对姜瘟的影响,采集该地区易发与不易发姜瘟22个田块的土壤样品,测2组土样的理化性质和微生物群落结构[磷脂脂肪酸(phospholipid fatty acid,简称PLFA)法],以探究其与姜瘟发生的相关性。结果表明,姜瘟的发生与土壤生物及非生物因子有密切关系,其中土壤含水量、酸碱度、微生物群落是影响姜瘟发生的主要因素,且有效磷、缓效钾、有效硼、全氮可促进土壤中有益菌群及抑制有害菌群数量。
关键词:土壤化学性质;微生物群落;生姜;土壤因子;微生物群落结构;改良土壤;防控姜瘟
中图分类号: S153;S154.3 文献标志码: A 文章编号:1002-1302(2019)12-0152-05
生姜(Zingiber officinale Rosc.)是我国重要的经济作物,随着种姜产业规模扩大和集约化连作种植模式的推广,姜产区病害尤其是姜瘟病日益加重,发病较轻田块损失20%~30%,重者损失达50%以上,甚至绝产[1-3]。尽管生产中常采用化学、农业等防治方法[2],但总体防效较差,并易出现农药残留、环境污染、病原菌抗药耐药等问题。
姜瘟是由青枯雷尔氏菌(Ralstonia solanacearum)引起的毁灭性土传病害[4],该病原菌可在土壤中长期存活并成为次年病害的主要侵染源,其侵染途径主要通过地下茎基部及根部的自然孔口和伤口,因此该病原菌的生长受土壤生物及非生物因素的影响。Huet等报道称,一些土壤可抑制青枯病害的发生,并发现该类土壤均可抑制病原菌在土壤中的数量[5-7],在重庆市荣昌地区也存在连续种植生姜田块不易发病现象。有报道称这与土壤抑制病原菌[8]和诱导植物产生抗性[9-10]有关。本研究发现,单一矿物钙(Ca)、硼(B)、镁(Mg)等对青枯菌的生长及致病性有显著的抑制作用[8,11],且土壤根际微生物群落和病原菌相对平衡[12]及微生物之间的竞争关系,对病原菌大量积累有显著的抑制作用[13-14]。然而土壤因素与姜瘟发生之间关系的研究相对甚少,从而阻碍了从土壤角度对姜瘟的防控。因此,本研究选择姜瘟连年发生严重和不易发姜瘟的多个田块,取样分析各田块土壤理化性质,并利用磷脂脂肪酸(phospholipid fatty acid,简称PLFA)法[15]分析微生物群落结构的关系,旨在为改良土壤防控姜瘟提供指导。
1 材料与方法
1.1 试验区概况、采集与分析
试验土样采自重庆市荣昌区盘龙镇(105°33′E,29°33′N),该地区海拔约600 m,属于中亚热带湿润季风气候,夏季平均气温在35 ℃左右,雨量也较为充足。该地区主要经济作物为生姜,经调研发现,该地区随着植姜面积的不断扩大,姜瘟也日益加重,且每年7—9月气温及降水量较高时是姜瘟发生高峰期,但有些地块连续种植生姜10年以上发病仍较轻;即使同一品种的生姜,在不同田块间发病较为明显,因此推测姜瘟的发生与土壤状况有一定的关系。2015年7月15日在种植户介绍下分别采集11份不易发病的土壤和连年发病较重的2类土壤,不易发病姜田土壤命名为B1、B2、B3、B4、B5、B6、B7、B8、B9、B10、B11;易发病姜田土壤命名为Y1、Y2、Y3、Y4、Y5、Y6、Y7、Y8、Y9、Y10、Y11。供试土壤为酸性紫色土,每个田块采集5~15 cm土层土壤用多点混合法[16]形成1个土壤样品,共22个土壤样品。采集的土壤样品经去除根系等杂物后,一部分过2 mm筛、混合均匀用于土壤微生物PLFA分析,另一部分土壤样品风干、过筛、混合均匀,用于土壤化学性质测定。
1.2 土壤化学性质测定
土样中钙含量、镁含量、pH值、有效磷(P)含量、全氮(TN)含量、有效硼含量、缓效钾(K)含量、有机质(SOM)含量、碱解氮(N)含量、土壤含水量(soil moisture,简称SM)均参照杨剑虹等编著的《土壤农化分析》中的方法[16]进行测定。
1.3 土壤微生物PLFA分析
土壤过2 mm筛,去除石砾和植物残体等杂物,称取8 g土样进行提取、皂化、甲基化、萃取以及碱洗涤后获得上机样品,用Agilent 6850气相色谱仪分析磷脂脂肪酸的成分,色谱条件为HP-5(25.0 m×200 μm×0.33 μm),进样量为 1 μm,分流比为10 ∶ 1,载气为H2,尾吹气为高纯N2,助燃气为空气,流速为0.8 mL/min。汽化室温度为250 ℃,检测器温度为300 ℃,柱前压为68.95 kPa,质谱全扫描范围为30~600质荷比(m/z);二阶程序柱温从170 ℃起始,5 ℃/min升至260 ℃,然后以40 ℃/min升至310 ℃,维持1.5 mim。各成分脂肪酸通过MIDI Sherlock微生物检定系统进行,数据处理中PLFA的绝对含量用C19 ∶ 0做内标进行换算。
1.4 数据分析
采用Origin Pro 8.6、SPSS 19.0和Canoco 5.0软件对试验结果进行统计分析和作图。
2 结果与分析
2.1 土壤酸碱度及含水量与姜瘟发生的相关性
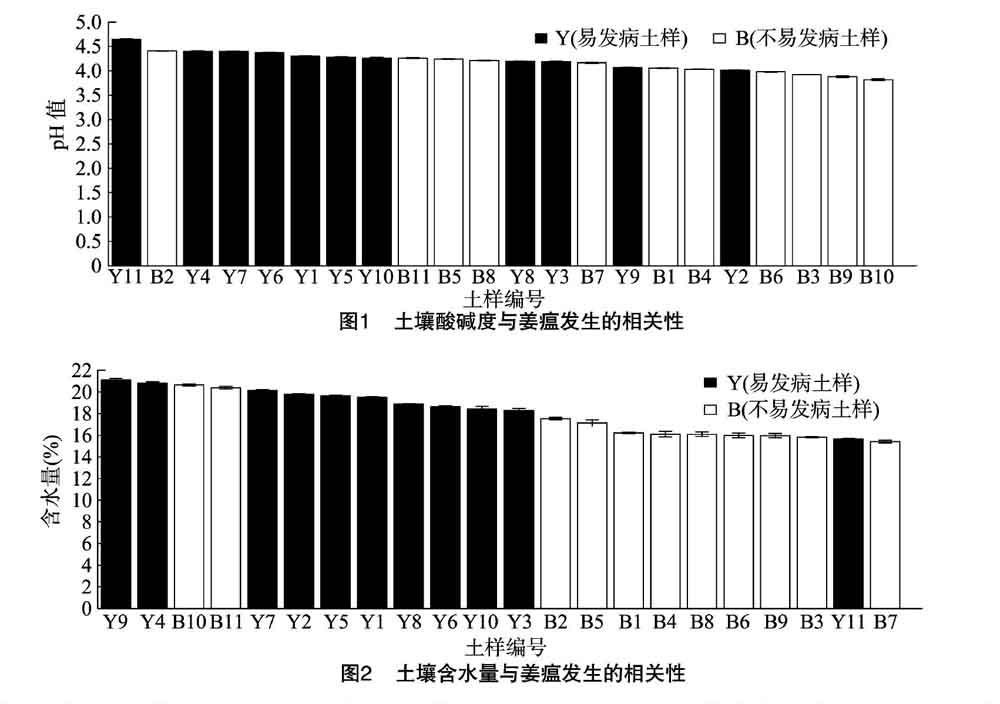
土壤酸碱度及水分对生姜的正常生长和病原菌的生长及侵染有一定的影响。由图1可知,本研究土样pH值范围为3.8~4.7,不易发病土壤pH值小于4.0的土样占83.3%。由图2可知,土壤含水量范圍为15.42%~21.12%,易发病土壤含水量高于18.29%的土壤占83.3%,表明姜瘟在偏酸及偏干燥的土壤中不易发病。推测在较干的强酸性土壤中青
枯菌的生长可能受到抑制。刘铭发现,姜瘟病原菌仅在中性或微酸性条件下进行侵入和增殖,发病较重[17];而Ho等发现,强酸性土壤对青枯菌的生长不利[6]。大量研究也表明,生姜通常在多雨季节、黏重潮湿、低洼的田块易发病,而在透气保肥较好的沙壤土中发病较轻[5]。
2.2 生姜易发与不易发姜瘟根际土壤矿质元素及微生物群落状况差异分析
重庆市荣昌区盘龙镇姜田土壤为酸性紫色土,其养分含量如表1所示,姜田土壤矿质元素普遍含量较低,这与酸性土壤的强烈淋溶现象有关。在不易发姜瘟土壤中,K含量和P含量除外,Ca、Mg、B这些指标均低于易发病土样指标,且2组土样中Ca含量、Mg含量、P含量之间的差异达到显著水平。缓效钾作为土壤有效钾的直接补充来源,两者之间存在动态平衡关系,且土壤中的含钾量可相互反映,姜田缓效钾含量低于58 mg/kg,说明该土壤处于缺钾状态且供钾能力不强,但生姜对钾的需求较高,因此该地区生姜的正常生长发育受到钾含量的影响。
2.3 姜瘟易发与不易发土壤化学性质及优势菌群的主成分分析
每种标记性脂肪酸代表不同类群的微生物,通过聚类及主成分分析可知,荧光假单孢杆菌(i16 ∶ 0)、腐生真菌(18 ∶ 1w9c)、伯克霍尔德菌(18 ∶ 0、Cy19 ∶ 0ω8c)、雷尔氏菌属(16 ∶ 1 2OH)、丛枝菌根真菌(16 ∶ 1w5c)、优势放线菌(10Me17 ∶ 0、10Me 18 ∶ 0)属于该土壤中的主要菌群。
结合以上原则,通过2组土壤生物及非生物因子共提取出6个主成分,累计贡献率为87.57%,第1、第2主成分分别为41.74%、19.22%,解释了土壤因子影响姜瘟发生现象。由图3可知,2组土样中大部分土样表现出较为明显的差异,但小部分土壤不能清楚地区分,这与正常和患病生姜根际细菌群落种群相似度高达70%有关[18]。
土传病害的发生与土壤微生态环境恶化、微生物群落结构失衡有紧密的联系[11]。不易发病土壤中真菌PLFAs/细菌PLFAs比值较低,且低于0.07的土样占75.0%(图4);放线菌PLFAs/真菌PLFAs较高,大于0.95的土样占87.5%,易发姜瘟土壤中放线菌数量明显减少(图5)。Wang等研究也表明,随着番茄青枯病发病加重,土壤中真菌数量/细菌数量比例增加,土壤微生物由细菌型积累向真菌型转化,土壤营养类型从富营养型向贫瘠方向转变[19]。
2.4 姜瘟易发与不易发土样化学性质及优势菌群的主成分分析
由表2、表3可知,不易发病土壤理化性质、优势菌指标分别有4、2个主要成分,即{K、SM},{pH值、Ca},{SOM},{B}和{a17 ∶ 0、cy17 ∶ 0、i16 ∶ 0、i17 ∶ 0、a15 ∶ 0},{10Me17 ∶ 0、10Me18 ∶ 0、16 ∶ 1 2OH}类, 解释了土壤化学性质及土壤优势菌对姜瘟发生的影响,其方差累积贡献率分别占原变量总方差的90.73%、75.46%,分别保留了原变量的特征、差异和相关性。
由表4可知,易发姜瘟土壤非生物、生物指标分别有3、2个主要成分,即{Mg、TN、Ca、SM},{P},{N}和{ i16 ∶ 0、i17 ∶ 0、18 ∶ 0、a17 ∶ 0、cy19 ∶ 0w8c、16 ∶ 1 2OH、i15 ∶ 0、a15 ∶ 0、18 ∶ 1w9c},{10Me18 ∶ 0}类,其方差的累积贡献率分别占原变量总方差的78.22%、80.40%。
结合表1,将表2、表3中的因子分析结果进行比较,表明2组土样之间主成分有明显差异。且在2组土样中SM的第1主成分的值较高, 分别为0.851和0.849,因此说明姜瘟是否发生与土壤含水量有很大关系。在不易发病土壤中,K、pH值、B的值均加,说明在不易发病土壤中,它们的作用增加。研究表明硼酸钠可以抑制青枯菌的生长,减少土壤中青枯菌的残存量, 且钾肥可提高生姜的抗性[20], 因此推测姜瘟不易由表3、表4、表5可知,在不易发病土壤中优势放线菌的作用增大;在易发病土壤中有害菌群Cy19 ∶ 0ω8c和16 ∶ 1 2OH及18 ∶ 1w9c中的值增加,这些菌在易发病土壤中的作用增加,说明该土样中有害菌和土壤中的植株残渣较多,病株残渣成为次年病原菌的主要来源。
2.5 土壤各菌群及优势菌与土壤化学性质的相关性分析
土壤微生物直接参与土壤养分的释放和固定过程,对土壤肥力的演变、有害生物的防治[12,21]、生态环境恶化的缓冲能力及土壤的修复起重要作用[13]。由表6可知,土壤理化性质会影响土壤微生物群落结构,K含量与各类菌群的PLFAs均呈显著或极显著正相关关系;TN含量与除放线菌外的其他菌PLFAs均呈显著或极显著正相关关系;这可能与K含量、TN含量能影响微生物生长及数量有关[29]。因此推测K含量、TN含量影响病害的原因与土壤微生物群落结构有关。
由图6冗余分析(gradient length<3)可知,易发病土壤主要分布在一、二象限,不易发病土壤主要分布在三、四象限,pH值主要分布在易发病区域,P含量主要分布在不易发病区域,因此pH值和P含量对姜瘟的发生影响较大,随着pH值的 增大、P浓度的减少姜瘟易发生。P含量与 16 ∶ 1w5c、10Me18 ∶ 0;K含量与i16 ∶ 0、16 ∶ 1w5c、18 ∶ 1w9c;TN与 i16 ∶ 0、10Me17 ∶ 0的夹角较小,说明荧光假单胞菌、丛枝菌根真菌、腐生真菌和优势放线菌的丰度随着TN、P、K含量的增加而递增;pH值、B含量与 16 ∶ 1 2OH、Cy19 ∶ 0ω8c夹角大于90°,說明雷尔氏菌属和伯克霍尔德菌的量随着pH值、B含量的增加而递减。
大量研究表明,土著有益菌对土壤病原菌的定殖、生长、繁殖有抑制作用,如荧光假单胞菌对姜瘟[22]和番茄青枯病有抑制作用[9],且几种拮抗菌共同作用时防治效果更好[12]。丛枝菌根真菌能降低土壤中青枯菌的数量[23],增加根际其他微生物数量,具有改良土壤的能力[24],P含量可提高丛枝菌根真菌在植物根部的定殖能力[25]。
3 结论与讨论
综上可知,土壤放线菌及土壤有益菌含量较高,由于连作及酸性土壤强烈淋溶作用的影响,不易发生姜瘟土壤矿质元素普遍偏低。且在易发病土壤中虽然土壤矿物质元素含量大多较高,如对大多数病害具有抑制作用的钙、镁的含量显著高于不易发姜瘟土壤,但是在该类土壤中土壤有害菌群如雷尔氏菌属、伯克霍尔德菌等含量较高,因此可推测出在种植生姜的酸性紫色土壤中微生物群落对姜瘟土传病害的影响作用稍大于土壤营养元素。但土壤微生物的组成及活性也受到土壤理化性质的影响[26-27],由表6可知,K含量与土壤微生物均呈显著或极显著正相关关系,说明K含量可提高土壤群落微生物的数量,且K含量对提高植物抗性有一定的促进作用。由图6可知,P、TN、K含量与拮抗菌群荧光假单胞杆菌、丛枝菌根真菌等之间的夹角小于90°,说明P、TN、K含量对这些菌有一定的促进作用,B含量对有害菌群雷尔氏菌属和伯克霍尔德菌有一定的抑制作用。因此可适当提高钾、有机肥及硼肥的含量来改善土壤的微生态环境,从而对提高生姜产量有更明显的作用。
大量研究表明,微肥在修复土壤和防治土传病害中起重要作用[12],但在姜瘟土传病害中结合土壤理化性质及微生物群落结构调节土壤的方法方面,参考数据较少,研究发现通过生物炭和熏蒸措施改变土壤微生物群落防病的同时,提高了土壤中TN、P、K含量[14,28],而在不易发病土壤中元素主成分分析可知,TN、P和K含量均有增加,因此TN、P、K含量对不易发病土壤的影响作用较大,由此说明这些元素在防治青枯病害的同时改善了土壤的理化性质,从而增强土壤的抗病能力。因此,在改土防病时从土壤的生物及非生物因素着手,效果可能更为明显。
参考文献:
[1]Yang W,Xu Q,Liu H X,et al. Evaluation of biological control agents against Ralstonia wilt on ginger[J]. Biological Control,2012,62(3):144-151.
[2]Stirling A M. The causes of poor establishment of ginger (Zingiber officinale) in Queensland,Australia[J]. Australasian Plant Pathology,2004,33(2):203-210.
[3]刘 铭,张 敏,戢俊臣,等. 中国姜瘟病的进展[J]. 2005,21(6):447-340,357.
[4]Elsas J D V,Kastelein P,Bekkum P V,et al. Survival of Ralstonia solanacearum Biovar 2,the causative agent of potato brown rot,in field and microcosm soils in temperate climates[J]. Phytopathology,2000,90(12):1358-66.
[5]Huet G. Breeding for resistances to Ralstonia solanacearum[J]. Front Plant Sci,2014,5(715):715.
[6]Ho W C,Chern L L,Ko W H . Pseudomonas solanacearum-suppressive soils in Taiwan[J]. Soil Biology & Biochemistry,1988,20(4):489-492.
[7]Masaya N,Yoshitaka S,Sae S,et al. Suppression of growth of Ralstonia solanacearum,tomato bacterial wilt agent,on/in tomato seedlings cultivated in a suppressive soil in Japan[J]. Plant Nutr,1999,45(1):79-87.
[8]楊笑笑. 矿质元素对番茄青枯病菌生长、致病的影响[D]. 重庆:西南大学,2014.
[9]Jiang J F,Wan X,Li J G,et al. Effect of boron nutrition on resistance response of tomato against bacterial wilt caused by Ralstonia solanacearum[J]. European Journal of Plant Pathology,2013,136(3):547-555.
[10]Diogo R V C,Wydra K . Silicon-induced basal resistance in tomato against Ralstonia solanacearum is related to modification of pectic cell wall polysaccharide structure[J]. Physiological & Molecular Plant Pathology,2007,70(4):120-129.
[11]吴卫玲. 土壤烟草青枯病菌的分离鉴定及硼酸钠对该菌的影响[D]. 重庆:西南大学2012.
[12]Berendsen R L,Pieterse C M,Bakker P A. The rhizosphere microbiome and plant health[J]. Trends Plant Sci,2012,17(8):478-486.
[13]Messiha N A S,Bruggen A H C V,Franz E,et al. Effects of soil type,management type and soil amendments on the survival of the potato brown rot bacterium Ralstonia solanacearum[J]. Applied Soil Ecology,2009,43(2):206-215.
[14]Zhang C S,Lin Y,Tian X Y,et al. Tobacco bacterial wilt suppression with biochar soil addition associates to improved soil physiochemical properties and increased rhizosphere bacteria abundance[J]. Applied Soil Ecology,2017,112:90-96.
[15]Vestal J R,White D C. Lipid analysis in microbial ecology:quantitative approaches to the study of microbial communities[J]. BioScience,1989,39(8):535.
[16]杨剑虹,王成林,代亨林,等. 土壤农化分析与环境监测[M]. 北京:中国大地出版社,2008.
[17]刘 铭. 拮抗细菌对姜瘟病的生物防治研究[D]. 成都:四川农业大学,2005.
[18]张 伟. 犍为县生姜连作土壤微生物特性研究[D]. 成都:四川 农业大学,2010.
[19]Wang L,Cai K Z,Chen Y T,et al. Silicon-mediated tomato resistance against Ralstonia solanacearumis associated with modification of soil microbial community structure and activity[J]. Biological Trace Element Research,2013,152(2):275-283.
[20]Brennan R F. Effect of levels of take-all an on the dry matter and grain yield of wheat[J]. Journal of Plant Nutrition,1995,18(6):1159-1170.
[21]Murugesan C,Dharaneedharan S,Ee Y,et al. Meta-analysis reveals that the genus pseudomonas can be a better choice of biological control agent against bacterial wilt disease caused by Ralstonia solanacearum[J]. Plant Pathology Journal,2016,32(3):216-227.
[22]Vijayaraghavan R,Abraham K. Selection of potential rhizobacterial isolates from ginger rhizosphere against bacterial wilt caused by Ralstonia solanacearum[J]. International Journal of Plant Protection,2012,5(1):20-27.
[23]朱紅惠,姚 青,李浩华,等. AM真菌对青枯菌的抑制和对酚类物质的影响[J]. 微生物学通报,2004,31(1):1-5.
[24]Vanitha S C,Umesha S. Pseudomonas fluorescens mediated systemic resistance in tomato is driven through an elevated synthesis of defense enzymes[J]. Biolgia Plantarum,2011,55(2):317-322.
[25]Wang P,Wu S H,Wen M X,et al. Effects of combined inoculation with Rhizophagus intraradices and Paenibacillus mucilaginosus on plant growth,root morphology,and physiological status of trifoliate orange (Poncirus trifoliata L. Raf.) seedlings under different levels of phosphorus[J]. Scientia Horticulturae,2016,205:97-105.
[26]Urea addition and litter manipulation alter plant community and soil microbial community composition in a Kobresia humilis meadow[J]. European Journal of Soil Biology,2015,70:7-14.
[27]Yoshitake S,Uchida M,Nakatsubo T,et al. Characterization of soil microflora on a successional glacier foreland in the high Arctic on Ellesmere Island,Nunavut,Canada using phospholipid fatty acid analysis[J]. Polar Bioscience,2006,19:73-84.
[28]Wang Q J,Ma Y,Yang H,et al. Effect of biofumigation and chemical fumigation on soil microbial community structure and control of pepper Phytophthora blight[J]. World Journal of Microbiology and Biotechnology,2014,30(2):507-518.

