丹参叶片离体培养体系的建立与优化
申顺先 李学慧 梁明勤

摘要:以丹参叶片为外植体,利用正交试验等方法筛选优化丹参叶片不定芽诱导、不定芽丛增殖及壮苗生根、不定根毛状根诱导的适宜方案。结果表明:适宜叶片不定芽诱导的配方是MS+0.5 mg/L 6-BA+30 g/L蔗糖+琼脂 6.5 g/L;不定芽丛增殖的最适配方是2/3 MS+0.5 mg/L 6-BA+0.2 mg/L GA3+30 g/L蔗糖+6.5 g/L琼脂,平均芽增殖系数达12.00;适宜幼苗产生根的配方是1/2 MS+0.05 mg/L 2,4-D+0.1 mg/L IBA+20 g/L蔗糖+7 g/L琼脂,生根率达100%;适宜叶片诱导不定根毛状根的配方是MS+0.5 mg/L 2,4-D+30 g/L蔗糖+6.5 g/L琼脂。
关键词:丹参;叶片离体培养;不定芽;毛状根
中图分类号: S567.5+30.43 文献标志码: A 文章编号:1002-1302(2019)12-0070-04
丹参(Salvia miltiorrhiza Bunge)为唇形科鼠尾草属的多年生草本植物,以根和根茎入药[1],能活血祛瘀,养血安神,具有扩张血管、降脂、降压从而改善微循环等作用,现常用于心、脑血管等疾病的治疗和保健预防[2],是我国十分重要的中药材。然而由于丹参产地较多[3-4],加上其为常异花授粉植物[5-6],种子繁殖中的天然异交引起一定的种性变异,分根或芦头繁殖易携带病菌引起种性退化[7],导致丹参原药质量不一,甚至影响临床疗效。丹参组织培养技术既可以获得种性一致的脱毒种苗加快优质种苗的繁殖速度[8],又可以通过愈伤组织及毛状根进行药物有效成分的生产[9-10],从而避免品种混乱导致药效下降,为生产大量“血统纯正”的丹参原药奠定基础。本试验以丹参无菌叶片为外植体从不定芽诱导、不定芽丛增殖培养、不定根及毛状根诱导培养等方面进行探索,建立并优化了丹参叶片离体培养体系,为丹参优质种苗工厂化生产及毛状根培养提供技术支持。
1 材料与方法
1.1 试验材料
供试材料为无菌丹参叶片,取自2014年初代培养获得的紫花丹参无菌组培苗。
1.2 试验方法
1.2.1 叶片诱导培养 2015年10月至2016年1月期间,采用预先培養在MS+30 g/L蔗糖+7 g/L琼脂培养基(pH值6.0,下同)上的旺盛生长、健壮一致的丹参无菌绿苗,取宽 1.5~2.0 cm平展、健康带叶柄的叶片,从中间主脉附近纵向一剪为二, 接种在MS+30 g/L蔗糖+6.5 g/L琼脂为基本培养基附加不同浓度6-BA、2,4-D的培养基进行诱导培养,初步探索叶片离体培养诱导培养基配方。培养条件(下同)为温度(25±2) ℃,光照强度3 000 lx,每天光照10 h,培养室空气相对湿度70%。第3周统计愈伤组织诱导率,第6周统计不定芽(根)分化率[11],具体计算公式如下:
愈伤组织诱导率=(产生愈伤组织的叶片块数/接种的叶片块数)×100%;
不定芽(根)分化率=[产生不定芽(根)的叶片块数/接种的叶片块数]×100%。
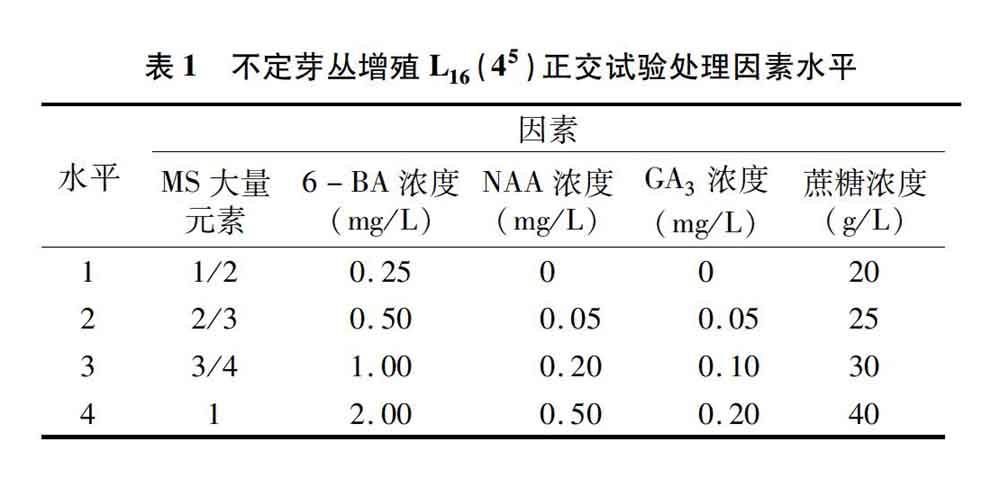
1.2.2 不定芽丛增殖配方的筛选 2016年5月,以MS培养基的微量铁盐和有机物为培养基基本成分(附加琼脂 6.5 g/L),对MS大量元素、6-BA、NAA、GA3和蔗糖浓度进行5因素4水平正交试验(表1)。采用预先在MS+30 g/L蔗糖+7 g/L琼脂培养基上培养4周的旺盛生长、健壮一致的丹参无菌绿苗,取宽1.5~2.0 cm平展、健康带叶柄的叶片,从中间主脉附近纵向一剪(并不分开),正面向上接种于16个培养基配方上培养,每个配方接种4瓶,每瓶接种4张叶片。6周后统计不定芽丛增殖系数,计算公式如下:
不定芽丛增殖系数=有效芽苗数/接种叶片数,注意有效芽苗是指苗高不低于0.5 cm的芽苗。
1.3 数据分析
各项平均值、方差分析采用Microsoft Office Excel软件进行。
2 结果与分析
2.1 叶片诱导培养配方的筛选
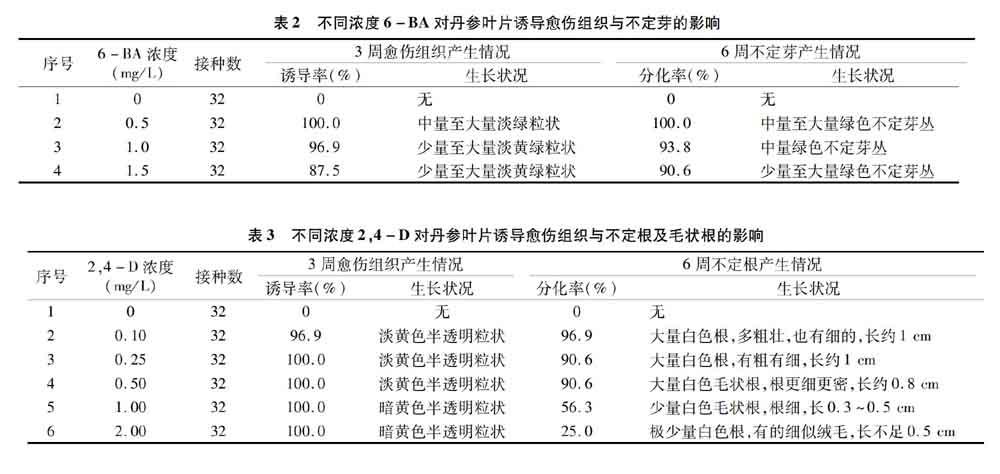
2.1.1 叶片诱导培养中6-BA对不定芽产生的影响 丹参无菌叶片在附加不同浓度6-BA的MS培养基上培养,除 6-BA 浓度为0的配方外,大都在1周前后启动细胞分裂,1~2周形成愈伤组织,2~3周出现绿色芽体,3周后愈伤组织不再明显增长,不定芽分化明显。由表2可知,不附加生长调节物质的基本培养基MS不能诱导丹参叶片产生愈伤组织,更不会出现不定芽的分化。当仅附加适当浓度的6-BA时就能诱导叶片切口处产生愈伤组织,并分化出不定芽;但愈伤组织诱导率与不定芽分化率却随着6-BA浓度的增高反而降低。因此,丹参叶片诱导不定芽以采用配方MS+0.5 mg/L 6-BA+30 g/L蔗糖+6.5 g/L琼脂为好(图1-A)。
试验中还发现,在叶柄切口处也易产生愈伤组织,并进一步分化出不定芽,但当叶柄插入培养基内部时却很难产生;当叶片正面向下背面向上放在培养基上时,也很难产生愈伤组织。此外,有的芽不经愈伤组织阶段而直接产生于叶片上。
2.1.2 叶片诱导培养中2,4-D对不定根及毛状根产生的影响 丹参无菌叶片在附加不同浓度2,4-D的MS培养基上培养,除2,4-D浓度为0的配方外,大都能在叶片、叶柄切口处产生愈伤组织,并进行根的分化产生根突,快的3周内就已经产生大量的根。由表3可知,不附加生长调节物质的MS不能诱导丹参叶片出现不定根的分化;当仅附加适当浓度的2,4-D时就能诱导叶片产生愈伤组织,并分化出不定根;但不定根分化率却随着2,4-D浓度的增高反而降低。说明2,4-D可以诱导丹参叶片产生愈伤组织并分化出不定根,但当2,4-D浓度过高时抑制不定根的分化。可见,丹参叶片诱导不定根以附加2,4-D 0.1~0.5 mg/L为佳。试验中发现当2,4-D浓度升高至0.25 mg/L及其以上时会分化出毛(发)状根,0.50 mg/L时能产生大量毛(发)状根(图1-B)。因此,适宜丹参叶片诱导不定根毛状根的配方是MS+0.5 mg/L 2,4-D+30 g/L蔗糖+6.5 g/L琼脂。
综合以上试验表明,6-BA与2,4-D都能使丹参叶片发生脱分化产生愈伤组织,但6-BA会促使愈傷组织进一步分化为不定芽,而 2,4-D会促使愈伤组织进一步分化为不
2.2 不定芽丛增殖培养基配方筛选与优化
2.2.1 不定芽丛增殖培养正交试验结果分析 第2周,培养在16个配方上的丹参叶片均已产生淡绿色粒状松散愈伤组织,愈伤组织主要产生于叶片及叶柄切口与培养基接触部位;配方1、2、5、7、9、14、15上的愈伤组织出现绿色芽点。第4周,除配方4、8、12、16上愈伤组织刚开始或正在分化芽外,其他配方均已产生不定芽;此外,配方1、4、10、13上均有一块愈伤组织产生了1或2条根。第6周,丹参叶片不定芽丛增殖系数和生长状况见表4,可见丹参不定芽分化率除配方4为75%外,其他配方均达100%;除配方4、8外,其他配方都或多或少地分化出了不定芽丛;增殖系数除配方3、4、8、12、13、16外,其他配方均不低于10.00倍;增殖系数最高的是配方6,达12.00倍,次之的是配方7,达11.75倍;增殖系数最低的是配方4,仅为3.56倍。对不定芽丛增殖系数高低的影响效应由主到次的排序是6-BA、MS大量元素、NAA、GA3、蔗糖(方差分析表明,6-BA、MS大量元素、NAA浓度均差异极显著,GA3、蔗糖浓度差异显著),五者引起平均芽增殖系数最高的水平分别是第2、2、1、1、2水平,即丹参叶片不定芽丛增殖比较适宜的配方是2/3 MS+0.5 mg/L 6-BA+25 g/L蔗糖+6.5 g/L琼脂。
2.2.2 不定芽丛增殖培养基配方对比试验结果分析 因正交试验筛选的适宜配方并不在16个配方中,故将该配方与正交试验中增殖系数最高的6号配方、次高的7号配方等同时接种,进行对比试验(表5,各配方附加琼脂6.5 g/L)。6周后对比试验结果表明,此配方的增殖系数(9.56)明显低于原6号配方(11.85)与原7号配方(11.90)。综合正交试验、对比试验结果,并兼顾不定芽苗的健壮程度,认为丹参叶片不定芽丛增殖最适的培养基配方是原6号配方,即2/3 MS+0.5 mg/L 6-BA+0.2 mg/L GA3+30 g/L蔗糖+6.5 g/L琼脂(图1-C)。
2.3 壮苗与生根培养
经丹参叶片离体培养产生的不定芽丛,苗高并不整齐,有的苗较大且健壮,有的苗较小且弱。对于健壮大苗,可以分切后直接接种在生根培养基上诱导生根。对于较小弱苗,可以分切后先接种在MS培养基上进行壮苗培养,待苗长高后可以再转接在生根培养基上诱导生根。生根培养接种于培养基1/2 MS+0.05 mg/L 2,4-D+0.1 mg/L IBA+20 g/L蔗糖+7 g/L琼脂,1周前后就产生白色根,2周生根率达100%(图1-D)。
表5 不定芽丛增殖培养对比试验结果
配方 增殖系数 不定芽丛生长状况
2/3 MS+0.5 mg/L 6-BA+25 g/L蔗糖 9.65 绿色不定芽丛,有的苗较高,但不整齐
2/3 MS+0.5 mg/L 6-BA+0.2 mg/L GA3+30 g/L蔗糖 11.85 绿色不定芽丛,苗高与上者持平,也不整齐
2/3 MS+1.0 mg/L 6-BA+0.5 mg/L NAA+25 g/L蔗糖 11.90 绿色不定芽丛,苗高不整齐,较多芽小而密,轻度玻璃化
3 讨论与结论
诱导丹参叶片、叶柄、花蕾等不含芽材料脱分化,经器官发生方式再分化出完整植株是比较容易实现的[12-14],但要将其作为丹参种苗生产途径就需要解决关键问题,即不定芽丛增殖最适培养基配方的获得。为了实现这个目的,本研究采用正交试验等方法从基本培养基大量元素与多种生长调节剂浓度组配着手,筛选并优化了丹参叶片不定芽丛增殖培养基配方。
丹参不定芽丛增殖正交试验中,MS基本培养基大量元素浓度差异极显著,在2/3 MS时更有利于不定芽丛的增殖。诱导试验中,丹参叶片在MS基本培养基上(无任何生长调节剂),既不会产生愈伤组织也不会产生不定芽和根,在添加0.5 mg/L 6-BA时,3周愈伤组织诱导率与6周不定芽分化率都达到了100%,然而这2个指标却随着6-BA浓度的进一步增高(0.5→1.5 mg/L)反而降低。正交试验中,6-BA浓度差异极显著,在第2周、第4周、第6周的动态观察中发现了有类似的现象,在6-BA浓度由0.25增至0.50 mg/L时平均芽增殖系数也随着增大,而由0.50增至1.00 mg/L时开始减小,再增至2.00 mg/L时明显减小,6-BA浓度均为 2.00 mg/L 的配方4、8、12、16愈伤组织分化不定芽反而较慢;这说明低浓度的6-BA会促进芽的分化,而高浓度反而有一定的抑制作用。NAA浓度差异极显著,平均芽增殖系数随着NAA浓度的增高反而减小,这说明NAA对分化芽有一定的抑制作用。这些现象与梁红等[11]、解晓红等[15]、蔡朝晖等[16]的发现是一致的。结合丹参叶片诱导试验、正交试验、对比试验的筛选与优化结果,丹参叶片诱导不定芽丛增殖最适配方是2/3 MS+0.5 mg/L 6-BA+0.2 mg/L GA3+30 g/L蔗糖+6.5 g/L琼脂,其可以次序有效地诱导出愈伤组织与不定芽丛,甚至直接诱导出不定芽丛,增殖系数达12.00倍。增殖培养产生的不定芽苗,经壮苗培养后转接在生根培养基1/2 MS+0.05 mg/L 2,4-D+0.1 mg/L IBA+20 g/L 蔗糖+7 g/L琼脂上,1周前后就产生白色根,2周生根率达100%。
诱导丹参毛状根培养系统逐渐成为生产丹参药理活性物质的良好体系[17],而大多数研究者是利用发根农杆菌转化丹参外植体诱导毛状根的[18-19],不仅需菌株培养、外植体侵染,而且成功后还要多次转接进行除菌培养,费时费力;就不如本研究通过2,4-D直接诱导叶片产生毛状根更便利。本研究发现,MS附加2,4-D 0.1~0.5 mg/L适宜诱导丹参叶片产生愈伤组织并分化出不定根,当2,4-D浓度升高至 0.25 mg/L 及其以上时分化出不定根毛状根,0.50 mg/L时产生大量毛状根,但当2,4-D浓度过高时却抑制不定根的分化;MS+0.5 mg/L 2,4-D+30 g/L蔗糖+6.5 g/L琼脂就是丹参叶片诱导不定根毛状根的适宜配方,无疑这为利用毛狀根培养生产丹参活性成分开辟了一条新途径。
参考文献:
[1]国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社,2010:70-71.
[2]王冰瑶,吴晓燕,樊官伟. 丹参素保护心血管系统的药理作用机制研究进展[J]. 中草药,2014,45(17):2571-2575.
[3]赵宝林. 丹参药材道地性探讨[J]. 时珍国医国药,2009,20(12):3101-3102.
[4]赵 魁,郭晓恒,宋 杰,等. 全国丹参生产现状的调查和分析[J]. 时珍国医国药,2010,21(9):2307-2310.
[5]李 今. 药用植物丹参传粉因子的研究[J]. 首都师范大学学报(自然科学版),2001,22(2):58-61.
[6]宋振巧,王建华,王洪刚,等. 丹参开花与繁育特性研究[J]. 园艺学报,2009,36(6):905-910.
[7]李天祥,常广璐,李国辉,等. 丹参培育中的关键问题和对策[J]. 时珍国医国药,2015,26(12):3008-3010.
[8]温春秀,谢晓亮,吴志明,等. 丹参脱病毒及组培快繁技术研究[J]. 中草药,2004,35(9):1057-1059.
[9]刘慧敏,刘艳军,黄俊轩,等. 丹参愈伤组织快速生长培养方法[J]. 天津农业科学,2017,23(7):14-16.
[10]毛 莹,袁 媛,何希荣,等. 不同元素对丹参毛状根生长及丹参酮类成分积累的影响[J]. 中国实验方剂学杂志,2009,15(11):6-8.
[11]梁 红,何宇清,赵 洁. 生长调节物质对丹参叶片脱分化及根芽分化的效应[J]. 华中师范大学学报(自然科学版),1997,31(3):328-331.
[12]王建英,刘 涤. 丹参的器官发生[J]. 植物生理学通讯,1987(6):46.
[13]房师梅,雷世俊,王洪波,等. 丹参组培快繁技术研究[J]. 北方园艺,2013(21):123-126.
[14]王维婷,单成钢,房翠萍,等. 丹参组织培养及再生体系的建立与优化[J]. 现代中药研究与实践,2011,25(4):21-23.
[15]解晓红,李江辉,冯文龙,等. 丹参组培快繁技术研究[J]. 中药材,2004,27(7):474-475.
[16]蔡朝晖,高山林,徐德然. 丹参组织培养快速繁殖技术的研究[J]. 中国药科大学学报,1991,22(2):65-68.
[17]晏 琼,胡宗定,吴建勇. 生物和非生物诱导子对丹参毛状根培养生产丹参酮的影响[J]. 中草药,2006,37(2):262-265.
[18]周 伟,姚倩雯,钱忠英,等. 丹参毛状根诱导条件的优化[J]. 上海师范大学学报(自然科学版),2007,36(2):93-98.
[19]谈荣慧,张金家,赵淑娟. 丹参毛状根的诱导及培养条件的优化[J]. 中国中药杂志,2014,39(16):3048-3053.文 凤,孙 亮,刘 峰,等. 陆地棉脂肪酸去饱和酶基因GhFAD2-1的克隆与表达分析[J]. 江苏农业科学,2019,47(12):74-78.

