红茶及其发花红砖茶对高血糖模型小鼠的降血糖作用
周阳,肖文军,3,林玲,袁冬寅,彭影琦,谭春波,张强,龚志华,3*
红茶及其发花红砖茶对高血糖模型小鼠的降血糖作用
周阳1,肖文军1,3,林玲1,袁冬寅1,彭影琦1,谭春波2,张强2,龚志华1,3*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2.湖南武陵秀峰茶业有限公司,湖南 常德 415000;3. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
以相同鲜叶加工而成的红茶及其发花红砖茶为原料,在应用链脲佐菌素腹腔注射并成功建立高血糖模型小鼠方法的基础上,将90只KM雄性小鼠按每组10只,随机分为正常组、模型组、红茶及发花红砖茶高、中、低剂量组和盐酸二甲双胍片组,连续灌喂28天,探讨了红茶及其发花红砖茶对高血糖模型小鼠的降血糖作用。结果表明,与正常组相比,模型组小鼠体重、饮水、饮食、血糖水平均有极显著差异(<0.01),且血糖水平达到高血糖标准,说明造模成功;与模型组相比,红茶及发花红砖茶高剂量组的肝脏指数显著下降(<0.05)、胰腺指数显著上升(<0.05);中、高剂量组的总胆固醇显著下降(<0.05),过氧化氢酶、超氧化物岐化酶显著上升(<0.05);各剂量组的血糖、甘油三酯、丙二醛含量水平显著下降(<0.05),口服耐糖量、谷胱甘肽过氧化物酶活性及胰岛素含量水平则显著上升(<0.05),除红茶低剂量组外各剂量组肝糖原含量水平均显著上升(<0.05),同时可修复受损胰岛;与红茶组相比,发花红砖茶高剂量组在改善胰岛素水平、血糖水平、口服耐糖量、丙二醛水平及肝糖原水平上显著优于红茶高剂量组(<0.05),中、高剂量组在提高过氧化氢酶、超氧化物岐化酶及谷胱甘肽过氧化物酶的酶活性上显著优于红茶中、高剂量组(<0.05)。由此表明,红茶及其发花红砖茶均具有降低高血糖模型小鼠血糖的作用,且在作用效果上发花红砖茶优于红茶,但其机制有待进一步探究。
红茶;发花红砖茶;高血糖症;模型小鼠;降血糖作用
糖尿病是一种以高血糖为特征的慢性、非传染性、代谢性疾病[1],是由T细胞介导的胰岛细胞功能受损而引起机体胰岛素缺乏或胰岛素利用率降低,进而导致机体葡萄糖、蛋白和脂肪代谢紊乱而产生的自身免疫性疾病[2-6]。促胰岛素分泌剂类、二甲双胍类、-糖苷酶抑制剂类、噻唑烷二酮衍生物、DDP-4酶抑制剂等常用口服降血糖药虽具有较好的降血糖效果,但多为化学合成,存在一定毒副作用,难以有效预防并发症[7]。开发利用天然、安全、有效的降血糖药物或辅助降血糖功能食品将是防治糖尿病的发展趋势,也是膳食营养干预的重要发展方向。茶叶作为一种传统健康饮品,含有茶多酚、茶多糖等多种具有降血糖作用的天然生物活性成分[8-14],同时研究表明,绿茶、红茶、黑茶、乌龙茶、黄茶等茶产品均具有降血糖作用[15-20],但相关研究主要局限于某种茶类或者茶中某一类物质是否具有降血糖作用,而鲜见以相同茶鲜叶为原料经不同工艺加工而具有不同品质特色的同一茶类的降血糖作用研究。发花红砖茶是在红茶的基础上增加了汽蒸、压制、发花、干燥等工艺的一种红茶新产品,但是否具有较好的降血糖作用尚有待进一步探究。本研究以高血糖模型小鼠为试验对象,以相同的茶鲜叶加工而成的红茶及其发花红砖茶为原料,参照国家食品药品监督管理局《辅助降血糖功能评价方法》,比较研究了红茶及其发花红砖茶的降血糖效果,以期为发花红砖茶的生产与消费提供参考。
1 材料与方法
1.1 材料、试剂与仪器设备
1.1.1 试验动物
SPF级KM小鼠90只,雄性,(20±2) g,购于湖南斯莱克景达试验动物有限公司,试验动物生产许可证号:SCXK(湘)2016-0002。
1.1.2 材料
红茶及发花红砖茶均由湖南武陵秀峰茶业有限公司生产加工。红茶是由碧香早一芽三四叶经萎凋、揉捻、发酵、干燥等工艺加工而成;发花红砖茶是在红茶的基础上增加了汽蒸、压制、发花、干燥等工艺加工而成。两种样品的直观图如图1所示,感官品质特点如表1所示。
1.1.3 试剂
盐酸二甲双胍片,购于中美上海施贵宝制药有限公司;链脲佐菌素STZ(S0130),购于美国Sigma公司;总胆固醇(TC)、甘油三酯(TG)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)试剂盒购于南京建成生物工程研究所;超氧化物岐化酶(SOD)、丙二醛(MDA)、肝糖原试剂盒购于苏州科铭生物有限公司;其他试剂均为分析纯。

图1 红茶及发花红砖茶试验原料直观对比图

表1 红茶及发花红砖茶试验原料感官品质特点
1.1.4 仪器设备
多功能酶标仪(赛默飞世尔上海仪器有限公司)、MIKRO 22R型台式冷冻离心机(德国Hettich公司)、电子天平(梅特勒-托利多仪器上海有限公司)、电热恒温水浴锅(上海精宏实验设备有限公司)、冷冻干燥机(广州三元科技有限公司)、PowerGen 125高速匀浆机(中国赛默飞世尔科技公司)、旋转蒸发器(上海荣亚生化仪器厂)、高效液相色谱仪(美国安捷伦公司)、紫外分光光度计UV-2550(日本岛津公司)。
1.2 试验方法
1.2.1 茶样前处理方法
称取红茶和发花红砖茶各600 g,分别粉碎后,按茶水比1∶10在沸水浴中提取30 min,浸提2次,过滤,合并滤液于55℃下旋转蒸发仪浓缩至固形物含量约30%后,冷冻干燥分别得干粉143.50 g与147.70 g,铝箔袋收集干粉,放入冰箱保存。经检测,红茶干粉中茶多酚、咖啡碱、简单儿茶素、酯型儿茶素、儿茶素总量、茶黄素、茶红素、茶褐素含量分别为31.30%、10.24%、1.30%、1.69%、3.29%、1.55%、19.61%、22.67%;发花红砖茶干粉中茶多酚、咖啡碱、简单儿茶素、酯型儿茶素、儿茶素总量、茶黄素、茶红素、茶褐素的含量分别为30.90%、11.44%、1.61%、1.19%、2.80%、1.22%、19.18%、29.70%。
1.2.2 高血糖小鼠模型的方法建立
购买SPF级KM雄性小鼠,20只,20 g左右,自由饮食,适应性喂养3~5 d。禁食16 h,测其空腹血糖值和体重,按照体重值确定所需链脲佐菌素量,配置溶液,腹腔注射50 mg·kg-1,连续注射5 d,每天1次。最后一次注射结束后,禁食16 h,测定血糖值,血糖值高于11.1 mmoL·L-1视为造模成功;同时观察记录小鼠的体重、饮水、饮食等生理变化。
1.2.3 动物试验设计
以建立的高血糖小鼠模型方法为基础,将90只SPF级KM小鼠在22~25℃条件下适应性饲养7 d后,称重,随机取10只作为正常组(NC),其余小鼠进行造模,将80只造模成功小鼠随机分为模型组(MC)、红茶高剂量组(BH)、红茶中剂量组(BM)、红茶低剂量组(BL)、发花红砖茶高剂量组(FBH)、发花红砖茶中剂量组(FBM)、发花红砖茶低剂量组(FBL)、盐酸二甲双胍片组(MHT),每组10只。参照文献[21-22],确定盐酸二甲双胍片剂量为250 mg·kg-1·d-1,按照1.2.1章节处理所得红茶和发花红砖茶的茶粉高、中、低剂量分别为1 000、500、300 mg·kg-1·d-1。正常组与模型组均灌喂等体积水,灌喂体积为10 mL·kg-1·d-1,连续灌喂28 d,在7、14、21、28 d分别测定各组小鼠体重和血糖值;同时在第28天,进行口服耐糖量测试。第29天,各组小鼠注射2%戊巴比妥钠麻醉,摘眼球取血,每组采血时间不超过5 min,并解剖肝脏、肾脏、胰腺组织,测定其质量。
1.3 检测方法
1.3.1 小鼠体重与器官指数测定
体重:每天称每组小鼠总体重,隔日称每只小鼠体重。
器官指数:将小鼠肝脏和肾脏于4℃的生理盐水洗净血渍,滤纸吸干表面水分后称其湿重。
器官指数=器官质量/小鼠体质量×100%。
1.3.2 小鼠口服耐糖量曲线下面积测定
在各组小鼠灌喂第28天时,禁食5 h,各给茶剂量组均给予相应剂量受试样品,正常组、模型组给予同体积生理盐水,20 min后经口灌喂剂量为2.0 g·kg·d-1的葡萄糖,0、0.5、2 h后测定各组小鼠血糖值,分析正常组、模型组与各给茶剂量组各时间点血糖曲线下面积的变化。血糖曲线下面积计算方法如下:
血糖=1/2×(0 h血糖值+0.5 h血糖值)×0.5+1/2×(2 h血糖值+0.5 h血糖值)×1.5=0.25×(0 h血糖值+4×0.5 h血糖值+3×2 h血糖值)
1.3.3 血浆中TC、TG、CAT、INS含量测定
采血后室温静置1 h,4℃下3 000 r·min-1离心10 min,取血清,按试剂盒操作说明测定TC、TG、CAT、INS含量。
1.3.4 肝脏组织中SOD、GPx、MDA、肝糖原含量测定
按肝脏组织质量(g)∶试剂盒里的试剂体积(mL)=1∶(5~10)的比例进行冰浴匀浆,8 000 r·min-1,4℃离心10 min,取上清液按试剂盒操作说明测定SOD、GPx、MDA活性。
称取0.1~0.2 g小鼠肝脏组织,加入0.75 mL试剂盒中的提取液充分匀浆;转移至10 mL试管中;95℃水浴20 min,每隔5 min振摇试管1次,使充分混匀;待组织液全部溶解后,取出试管冷却后,用蒸馏水定容到5 mL,混匀,8 000 r·min-125℃离心10 min,取上清液测定肝糖原。
1.3.5 胰腺组织切片及HE染色观察
按以下步骤依次进行:(1)60℃下烘烤载玻片1~2 h;(2)切片脱蜡至水化,先将切片置于二甲苯中10 min,重复2次,然后将切片依次放入100%、95%、85%和75%乙醇中,每级放置5 min,再用蒸馏水浸洗5 min;(3)将切片用苏木素染色5~10 min,蒸馏水冲洗,再用PBS返蓝;(4)用伊红染色3~5 min,蒸馏水冲洗;(5)酒精梯度(95%~100%)脱水,每级5 min,然后取出后置于二甲苯10 min,重复2次,用中性树胶封片后于显微镜下观察。
1.4 数据处理
2 结果与分析
2.1 高血糖小鼠模型的方法建立
由表2可知,造模后的小鼠血糖值高于11.1 mmoL·L-1,同时饮水、饮食明显增加,体重明显减少。通过观察小鼠喂养时笼子里的垫料发现,高血糖小鼠笼子里垫料湿的面积及程度均大于正常组,说明尿量增多;出现了明显的“三多一少”症状,说明造模成功。
2.2 红茶及其发花红砖茶对高血糖模型小鼠的降血糖作用
2.2.1 对高血糖模型小鼠器官指数的影响
表3表明,与正常组相比,模型组肝脏指数显著上升而肾脏、胰腺指数显著下降(<0.05);与模型组相比,给茶组肝脏指数降低、胰腺指数上升,且发花红砖茶高剂量组肝脏指数降低达显著水平(<0.05),给茶高剂量组胰腺指数上升达显著水平(<0.05),肾脏指数无显著变化,同时两种茶对应剂量组之间无显著差异;说明红茶及其发花红砖茶对高血糖小鼠均具有降低肝脏指数、升高胰腺指数的作用。

表2 应用链脲佐菌素腹腔注射建立高血糖模型小鼠结果
注:A:与正常组相比<0.01
Note: A: compared with NC<0.01

表3 红茶及其发花红砖茶对高血糖模型小鼠器官指数的影响
注:a:与正常组比较,<0.05;b:与模型组比较,<0.05
Note: a: compared with NC,<0.05. b: compared with MC,<0.05
2.2.2 对高血糖小鼠血糖(GLU)的影响
由表4可知,与正常组相比,造模前的各组小鼠血糖值均处于正常水平,造模后的各组小鼠空腹血糖含量极显著升高(<0.01),血糖值均高于11.1 mmoL·L-1,与前述建立高血糖小鼠模型方法的结果相符。灌喂28 d后,与模型组比较,给茶组和盐酸二甲双胍组的血糖水平显著降低(<0.05),其中给茶中剂量组达显著水平(<0.05)、高剂量组达极显著水平(<0.01),由此说明红茶与发花红砖茶均具有显著的降血糖效果;给茶组组间比较显示,两种茶的降血糖效果均随剂量的增大而增加,且发花红砖茶高剂量组血糖值显著低于红茶高剂量组,说明发花红砖茶的降血糖效果在一定程度上优于红茶。
2.2.3 对高血糖小鼠口服耐糖量(OGTT)的影响
表5显示,正常组小鼠的血糖值在口服葡萄糖1 h后达最大值,2 h后血糖值基本恢复到给药前水平,而高血糖小鼠2 h后恢复快慢有差异,通过与模型组比较曲线下面积,给茶组均能显著提高小鼠的耐糖量(<0.05),其中发花红砖茶高剂量组达极显著水平(<0.01);给茶组组间比较,两种茶在提高小鼠耐糖量的效果均随剂量的增大而增加,且发花红砖茶高剂量组曲线下面积达43.44,显著低于红茶高剂量组46.49(<0.05),说明红茶、发花红砖茶在一定程度上能够提高高血糖小鼠的耐糖量,且发花红砖茶效果优于红茶。

表4 红茶及其发花红砖茶不同灌喂时间对高血糖模型小鼠GLU的影响
注:A:与正常组比较,<0.01;b:与模型组比较,<0.05;B:与模型组比较,<0.01;c:与红茶组比较,<0.05
Note: A: compared with NC,<0.01. b: compared with MC,<0.05. B:compared with MC,<0.01. c: compared with black tea groups,<0.05
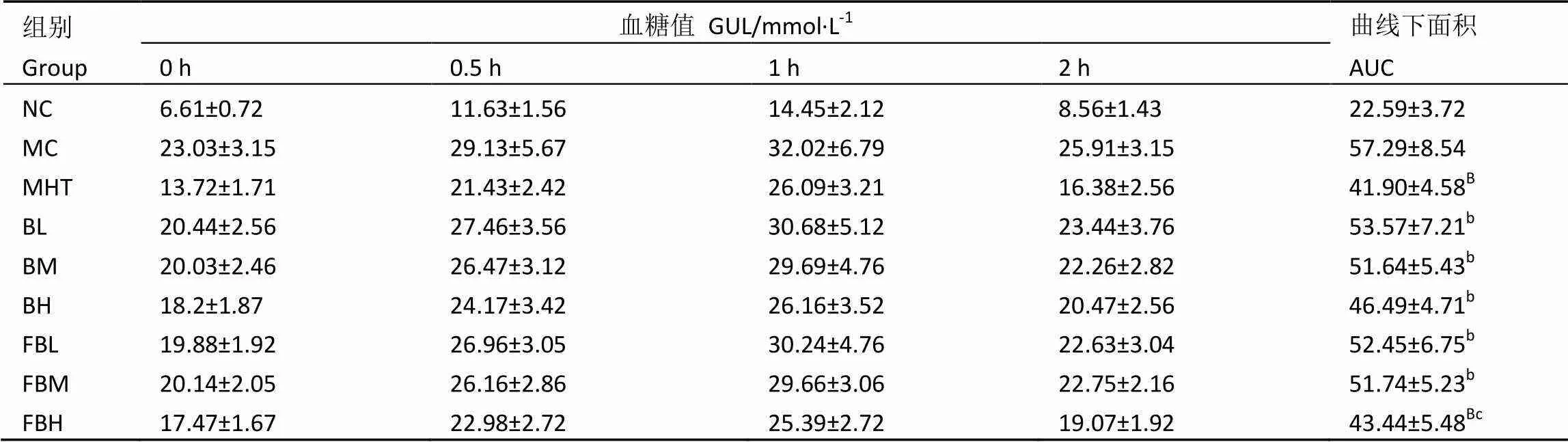
表5 红茶及其发花红砖茶对高血糖模型小鼠OGTT的影响
注:b:与模型组比较,<0.05;B:与模型组比较,<0.01;c:与红茶组比较,<0.05
Note: b: compared with MC,<0.05. B:compared with MC,<0.01. c: compared with black tea groups,<0.05
2.2.4 对高血糖小鼠血浆中CAT、TC、TG、INS的影响
表6表明,与模型组相比,给茶组均能显著降低高血糖小鼠血浆TG水平以及显著升高INS水平(<0.05),其中发花红砖茶高剂量组在升高INS水平上达极显著水平(<0.01);红茶与红砖茶中高剂量能显著降低高血糖小鼠血浆TC水平以及显著升高CAT水平(<0.05)。给茶组组间相比,两种茶在降低TC与TG水平、升高CAT与INS水平上均具有随剂量的增大而增加的趋势,其中在升高CAT水平上发花红砖茶中、高剂量组显著优于红茶中、高剂量组(<0.05),在升高INS水平上发花红砖茶高剂量组显著优于红茶高剂量组(<0.05)。
2.2.5 对高血糖小鼠肝脏中GPx、MDA、SOD、肝糖原的影响
表7表明,与模型组相比,给茶组均能显著提高GPx活性以及显著降低MDA含量(<0.05),其中发花红砖茶高剂量组达极显著水平(<0.01);给茶组中、高剂量组均能显著提高SOD活性(<0.05),其中发花红砖茶高剂量组达极显著水平(<0.01);除红茶低剂量组外,其他给茶组均能显著增加肝糖原含量(<0.05),其中发花红砖茶高剂量组达极显著水平(<0.01)。给茶组组间相比,两种茶在提高GPx与SOD活性、增加肝糖原含量、降低MDA含量上均随剂量的增大而增加,且在提高GPx与SOD活性上发花红砖茶中、高剂量组优于红茶中、高剂量组(<0.05),在改善MDA、肝糖原含量上发花红砖茶高剂量组优于红茶高剂量组(<0.05)。

表6 红茶及其发花红砖茶对高血糖模型小鼠TC、TG、CAT、INS的影响
注:b:与模型组比较,<0.05;B:与模型组比较,<0.01;c:与红茶组比较,<0.05
Note: b: compared with MC,<0.05. B: compared with MC,<0.01. c: compared with black tea groups,<0.05

表7 红茶及其发花红砖茶对高血糖模型小鼠GPx、MDA、SOD、肝糖原的影响
注:b:与模型组比较,<0.05;B:与模型组比较,<0.01;c:与红茶组比较,<0.05
Note: b:compared with MC,<0.05. B:compared with MC,<0.01. c: compared with black tea groups,<0.05
2.2.6 对高血糖小鼠胰腺的影响
图2表明,正常组胰岛呈椭圆形,结构完整,边界清晰;模型组胰岛体积缩小,形态不规则,结构被破坏,边界不清晰。给茶组与模型组相比,胰岛结构得到修复改善,胰岛形态较为完整,细胞排列较为规则,胞浆分布均匀,空泡变性较少,边界较为清晰,说明红茶及其发花红砖茶具有保护胰岛形态结构完整、辅助调节细胞分泌功能的作用,且发花红砖茶组的胰岛与周围腺泡组织界限比红茶组清晰,细胞排列、胞浆分布均优于红茶组,恢复程度高于红茶,从而说明发花红砖茶对受损胰岛的修复效果在一定程度上优于红茶。
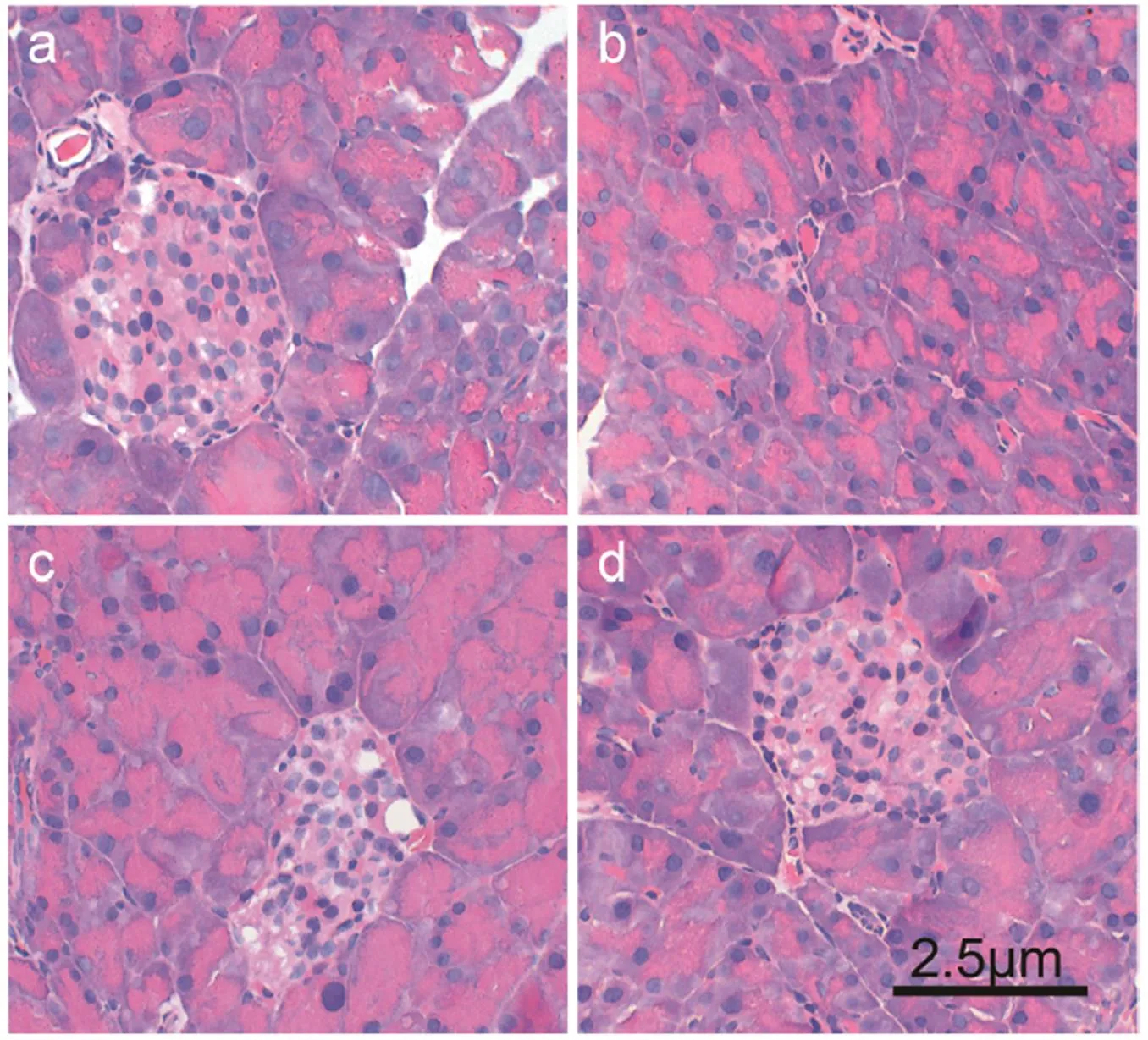
注:a:正常组;b:模型组;c:红茶组;d:发花型红砖茶组
3 结论与讨论
高血糖症主要是由T细胞介导的胰岛细胞功能受损而引起机体胰岛素缺乏或胰岛素利用率降低所致,是一种以高血糖为特征的慢性、非传染性、代谢性疾病[23]。随着人们生活方式、生活环境、饮食结构的变化,高血糖症已成为威胁人类健康的重要隐患,防治高血糖症已成为全世界共同关注的课题。本试验结果表明,与高血糖模型组相比,红茶及发花红砖茶高剂量组的肝脏指数显著下降(<0.05)、胰腺指数显著上升(<0.05);中、高剂量组的总胆固醇含量水平显著下降(<0.05),过氧化氢酶、超氧化物岐化酶的酶活性显著上升(<0.05);各剂量组的血糖、甘油三酯、丙二醛含量水平显著下降(<0.05),口服耐糖量、谷胱甘肽过氧化物酶酶活性及胰岛素含量水平则显著上升(<0.05),除红茶低剂量组外各剂量组肝糖原含量水平均显著上升(<0.05),且两种茶对受损的胰岛均具有一定的修复作用,推测红茶及其发花红砖茶可在一定程度上通过保护胰腺和肝脏、改善脂质代谢、缓减氧化应激以及减轻因糖脂代谢异常而造成胰腺负担加重等途径来促使血糖进入肝细胞,使葡萄糖合成肝糖原增加,肝糖原输出减少,葡萄糖氧化分解加快,从而达到调节糖脂代谢、降低血糖的作用[24-28]。同时,试验采用红茶及发花红砖茶提取物进行灌喂,其高剂量均为1 000 mg·kg-1,根据《药理实验方法学》[29]计算方法,小鼠的等效剂量相当于人的9.1倍,即相当于人的剂量为110 mg·kg-1。假设人的体重为60 kg,则一天需要喝6.6 g提取物,相当于喝26.4 g红茶或发花型红砖茶(提取率按25%计算),一般日常生活中人们每天仅喝2~4杯茶,这可能是日常饮茶很难达到显著降血糖效果的主要原因。
另一方面,研究结果显示,发花红砖茶组与红茶组相比,发花红砖茶高剂量组在改善胰岛素水平、血糖水平、口服耐糖量、丙二醛水平及肝糖原水平上显著优于红茶高剂量组(<0.05),中、高剂量组在提高过氧化氢酶、超氧化物岐化酶、谷胱甘肽过氧化物酶活性上显著优于红茶中、高剂量组(<0.05),说明发花红砖茶在降血糖作用效果上优于红茶。究其原因,可能主要是由于发花红砖茶在经历“发花”等后发酵工艺之后,健康品质发生了以下两个方面的变化:一是由“发花”工艺形成的“金花菌”本身就是一种有益于身体健康的益生菌,“金花”菌及其代谢产物与肠道菌群相互作用,具有调节糖脂代谢、调理肠胃等生物活性[30];二是“金花”菌以红茶原料为基质进行生长繁育过程中,可分泌淀粉酶、脂肪酶、纤维素酶、蛋白酶、果胶酶、氧化酶、单宁酶等多种酶,分泌的酶可参与到茶多酚、糖、有机酸、茶色素等物质的转化,从而引起发花红砖茶与红茶在生物活性成分含量上的差异[31]。资料表明,在普洱茶加工的后发酵过程中,茶褐素含量逐渐增加,而茶黄素、茶红素显著降低[32-33];从本试验两种茶的提取物内含成分分析结果来看,除发花红砖茶提取物中茶褐素含量明显高于红茶提取物外,其他成分相当,由此可推测发花红砖茶在降血糖作用效果上优于红茶可能主要由于茶褐素等生物活性物质所引起,但其机制还有待于从发花红砖茶加工品质化学以及与机体糖代谢相关的基因、蛋白、信号通路层面进行深入的探索。
[1] Amitani H, Asakawa A, Cheng K, et al. Hydrogen improves glycemic control in typeⅠdiabetic animal model by promoting glucose uptake into skeletal muscle [J]. Plos One, 2012, 8(1): e53913. DOI: 10.1371/journal.pone.0053913.
[2] Ichinose K, Kawasaki E, Eguchi K. Recent advancement of understanding pathogenesis of typeⅠdiabetes and potential relevance to diabetic nephropathy [J]. American Journal of Nephrology, 2007, 27(6): 554-564.
[3] Homo-Delarche F, Drexhage H A. Immune cells, pancreas development, regeneration and typeⅠdiabetes [J]. Trends in Immunology, 2004, 25(5): 222-229.
[4] 李甜, 张亚楼, 陈龙, 等. 链脲佐菌素诱导C57小鼠Ⅰ型糖尿病模型的研究[J]. 现代生物医学进展, 2014, 14(26): 5031-5033.
[5] 孙国鹏, 尹国安, 张艳芳. 低剂量链脲佐菌素诱导迟发性Ⅰ型糖尿病小鼠模型[J]. 黑龙江八一农垦大学学报, 2013, 25(3): 30-33, 41.
[6] 魏荣锐, 苗明三. 糖尿病动物模型及特点分析[J]. 中医研究, 2010, 23(2): 6-11.
[7] 尹纯, 孙艺红. II型糖尿病血脂异常及治疗[J]. 心血管病学进展, 2017, 38(5): 488-492.
[8] 于淑池, 苏涛, 杨建民, 等. 安吉白茶多糖对实验性糖尿病小鼠的降血糖作用研究[J]. 茶叶科学, 2010, 30(3): 223-228.
[9] 黄智璇, 欧阳蒲月. 灵芝多糖降血糖作用的研究[J]. 亚太传统医药, 2008, 31(8): 24-25.
[10] 张梅, 吴越, 慕春海, 等. 苍耳子水提取物对实验性糖尿病小鼠的降血糖作用研究[J]. 石河子大学学报(自然科学版), 2008, 26(5): 549-551.
[11] 梁燕, 王岳飞, 谢争珍, 等. 茶桑混合袋泡茶降血糖作用的实验研究[J]. 茶叶科学, 2008, 28(5): 358-362.
[12] 张元, 林强, 崔玉梅, 等. 乌龙茶多糖的酶法提取及降血糖活性初步研究[J]. 中国现代应用药学, 2008, 25(4): 286-288.
[13] 何学斌, 薛存宽, 魏守蓉, 等. 茶多糖对α-淀粉酶活性抑制作用及对糖尿病模型大鼠血糖影响研究[J]. 医药导报, 2007, 26(11): 1284-1286.
[14] Li S, Chen H, Wang J, et al. Involvement of the PI3K/Akt signal pathway in the hypoglycemic effects of tea polysaccharides on diabetic mice [J]. International Journal of Biological Macromolecules. 2015, 81: 967-974.
[15] 倪德江, 陈玉琼, 谢笔钧, 等. 绿茶、乌龙茶、红茶的茶多糖组成、抗氧化及降血糖作用研究[J]. 营养学报, 2004, 26(1): 57-60.
[16] 刘琴琴, 叶珊, 罗文娟, 等. 湖南茯茶对糖尿病小鼠血糖的影响[J]. 中国现代药物应用, 2013, 7(13): 220-221.
[17] 彭晓赟, 赵运林, 何小书, 等. 茯砖茶茶叶品质和保健功能的研究概况[J]. 湖南城市学院学报(自然科学版), 2011, 20(4): 45-48.
[18] 蔡正安, 刘素纯, 刘仲华, 等. 茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J]. 茶叶科学, 2010, 30(1): 57-62.
[19] 刘建宇, 刘丹, 张辉, 等. 安化黑茶化学成分及药理活性研究进展[J]. 中草药, 2017, 48(7): 1449-1455.
[20] 张冬英, 邵宛芳, 蒋智林, 等. 普洱茶分离组分的降糖降脂活性作用研究[J]. 云南农业大学学报, 2010, 25(6): 831-834.
[21] 吴扬, 胡志和, 郭嘉, 等. 乳铁蛋白铬对实验性糖尿病小鼠血糖水平的影响[J]. 食品科学, 2010, 31(13): 253-258.
[22] 方玉, 刘刚, 张晓喻, 等. 青刺尖茶汤对便秘模型小鼠润肠通便的效果[J]. 食品科学, 2014, 35(11): 265-268.
[23] 杨蕾, 舒娈, 姚冬冬, 等. 葛根素对链脲佐菌素诱导的糖尿病小鼠降糖作用[J]. 中国医院药学杂志, 2014, 34(16): 1338-1342.
[24] 陈亚蓝. 普洱茶茶色素对SD大鼠脂质代谢的影响及其作用机理研究[D]. 天津: 天津商业大学, 2016.
[25] 刘紫萱, 张继媛, 肖萍, 等. 3种植物活性成分联合改善2型糖尿病小鼠氧化应激效果研究[J]. 食品研究与开发, 2017, 38(8): 5-10.
[26] Awadallah S M, Ramadan A R, Nusier M K. Haptoglobin polymorphism in relation to antioxidative enzymes activity in type 2 diabetes mellitus [J]. Diabetes & Metabolic Syndrome Clinical Research & Reviews, 2013, 7(1): 26-31.
[27] Hassan A. Amelioration of altered antioxidant enzyme activity by Satureja khuzistanica essential oil in alloxan-induced diabetic rats [J]. Chinese Journal of Natural Medicines, 2014, 12(9): 672-676.
[28] 陈刚. 茶多糖对代谢综合征大鼠糖脂代谢的干预作用及机理研究[D]. 上海: 复旦大学, 2011.
[29] 徐淑云, 卞如濂, 陈修. 药理实验方法学[M]. 2版. 北京: 人民卫生出版社, 1991.
[30] 王瑶, 季宇彬, 陈明苍. 中药与肠道菌群相互作用的研究进展[J]. 中国医药导报, 2012, 9(2): 12-13.
[31] 杨富亚, 许波, 李俊俊, 等. 普洱茶渥堆过程中复合酶制剂的应用研究[J]. 安徽农业科学, 2013, 41(9): 4057-4060.
[32] 邵春甫, 贾黎晖, 李长文, 等. 普洱茶茶褐素研究进展[J]. 天津化工, 2011, 25(6): 1-3, 11.
[33] 罗龙新, 吴小崇, 邓余良, 等. 云南普洱茶渥堆过程中生化成分的变化及其与品质形成的关系[J]. 茶叶科学, 1998, 18(1): 58-60.
Hypoglycemic Effects of Black Tea and Fungus Fermented Black Brick Tea on Hyperglycemic Model Mice
ZHOU Yang1, XIAO Wenjun1,3, LIN Ling1, YUAN Dongyin1, PENG Yingqi1, TAN Chunbo2, ZHANG Qiang2, GONG Zhihua1,3*
1. Key Laboratory of Tea Science of Educational Ministration, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Wuling Xiufeng Tea Co. Ltd., Changde 415000, China; 3. National Research Center of Engineering & Technology for Utilization of Functional Ingredients from Botanicals, Changsha 410128, China
Based on the successfully establishment of hyperglycemia model by intraperitoneal injection of streptozotocin, 90 KM male mice were randomly divided into the normal, model, black tea treated (high, medium, low doses), fungus fermented black brick tea treated (high, medium, low doses) and metformin hydrochloride (n=10/each group) groups, and were continuously administrated for 28 days to study the hypoglycemic effects of black tea and fungus fermented black brick tea processed from the same batch of fresh leaves. The results show that compared with the normal group, the weight, water, diet and blood glucose levels of the model group were significantly different (0.01). The blood glucose level of the model group reached the standard of hyperglycemic index and indicates that the model was successful. Compared with the model group, the high dose ofblack tea treated group and fungus fermented black brick tea treated groups’ liver index were significantly decreased (0.05) and the pancreas index were significantly enhanced(0.05). The total cholesterols of the middle and high doses of black tea treated groups and fungus fermented black brick tea treated groups were significantly decreased (0.05), whiletheactivities of superoxide dismutase and catalase were significantly increased (0.05).The blood sugar, triglyceride and malondialdehyde levelsof black tea treated groups and fungus fermented black brick tea treated groups were significantly decreased in a dose-dependent manner (0.05). Besides, glucose tolerance, activity of glutathione peroxidase, insulin levels were increased significantly in a dose-dependent manner (0.05). The damaged structure of pancreas were repaired in black tea treated and fungus fermented black brick tea treated groups. Except for the low-dose black tea treated group, the hepatic glycogen level were enhanced in other black tea treated groups (0.05). Compared with the black tea groups, the high-dose fungus fermented black brick tea was significantly superior to the high-dose black tea in improving insulin level, blood sugar level, oral glucose tolerance, malondialdehyde level and liver glycogen level (0.05). The middle and high dose groups of fungus fermented black brick tea were also significantly superior to the middle and high dose groups of black tea in increasing the activities of catalase, superoxide dismutase and glutathione peroxidase. The results prompt that both the black tea and fungus fermented black brick tea could reduce the blood glucose of hyperglycemic mice, and fungus fermented black brick tea had better effects than black tea. The underlying mechanism needs further investigation.
black tea, fungus fermented black brick tea, hyperglycemia, model mice, hypoglycemic effect
S571.1;TS272.5+2
A
1000-369X(2019)04-415-10
2018-10-17
2019-01-06
国家重点研发计划(2017YFD0400803)、湖南省科技重大专项(2017NK1020)、长沙市科技重大专项(kq1703003)
周阳,男,硕士研究生,主要从事茶树生理与品质化学研究方面的研究,87007183@qq.com。*通信作者:gzh041211@163.com

