黄芪建中汤对大鼠十二指肠溃疡及TLR-2介导的肠黏膜免疫屏障的影响
宋厚盼,陈小娟,曾梅艳,陈新怡,蔡 雄,喻 嵘,谢明霞, 彭清华
(湖南中医药大学 1. 中医诊断研究所、2. 中医学院,湖南 长沙 410208)
十二指肠溃疡(duodenal ulcer, DU)是临床常见的一种消化系统疾病,其病因主要包括幽门螺杆菌(Helicobacterpylori, HP)感染、服用非甾体类药物、精神心理因素、不良生活饮食习惯等,典型的临床症状表现为慢性、周期性、节律性的上腹部或剑突下疼痛,空腹疼痛加重,进食缓解[1]。近年来,DU发病率呈逐年升高趋势,严重影响了人们的生命健康和生活质量。尽管当前抑酸药、抗生素和黏膜保护药物的应用,使大多数患者获得较好的短期疗效,但如何加速溃疡愈合、防止溃疡复发、减少并发症和不良反应发生,仍然是DU临床和基础研究重点关注的问题[2]。
黄芪建中汤(Huangqi Jianzhong decoction, HQJZ)是历代医家治疗内科脾胃病及其他各科病见脾胃虚损证的常用方剂,本方由黄芪、饴糖、桂枝、白芍、生姜、甘草和大枣组成,具有温中补虚、缓急止痛之功效。消化性溃疡中医诊疗专家共识意见[3]和消化性溃疡中西医结合诊疗共识意见[4]均建议以本方为主方随证加减治疗脾胃虚寒型DU患者,但目前有关HQJZ治疗DU的基础研究较少。本研究通过构建大鼠DU模型,探讨HQJZ促进溃疡愈合的药理效应及其对十二指肠黏膜免疫屏障功能的影响,揭示其治疗DU的分子机制,为中医药或中西医结合疗法在临床应用于消化性溃疡疾病的治疗提供科学依据。
1 材料
1.1 实验动物SD大鼠,♂,SPF级,体质量(180±20)g,购自湖南斯莱克景达实验动物有限公司,实验动物许可证号:SCXK(湘)2016-0002。每笼6只饲养,环境温度(23±2)℃,相对湿度45%~55%,12 h光暗周期循环。适应性喂养3 d后开始正式实验。
1.2 试剂大鼠肿瘤坏死因子α(tumor necrosis factor α, TNF-α)试剂盒(CRE0003)、大鼠白细胞介素10(interleukin-10, IL-10)试剂盒(CRE0007),均购于北京四正柏生物科技有限公司;大鼠白细胞介素4(interleukin-4, IL-4)试剂盒(70-EK304/2-48)购于联科生物;总RNA提取试剂(B518621)、M-MuLv第一链cDNA合成试剂盒(B532435)、SG Fast qPCR Master Mix(B639271),均购于生工生物工程有限公司;兔抗髓样分化因子88(myeloid differentiation factor 88, MyD88)一抗(bs-1047R)、兔抗Toll样受体2(Toll-like receptor, TLR-2)一抗(bs-10472R),均购于北京博奥森生物技术有限公司;伊红染液(批号:150109)、DAB显色试剂盒(批号:ZLI-9018),均购于北京中杉金桥生物技术有限公司。

Fig 1 Schematic diagram of establishing rat model of duodenal ulcer with syndrome of spleen and stomach deficiency-cold
1.3 药物阿司匹林(批号:BJ38595,拜耳医药保健有限公司);埃索美拉唑肠溶胶囊(批号:G170815,重庆莱美药业股份有限公司);HQJZ组方药物,购于湖南中医药大学第一附属医院中药房,本方由胶饴30 g、桂枝9 g、白芍18 g、黄芪5 g、甘草6 g、生姜9 g、大枣4枚组成(参照《方剂学》第十版教材,中国中医药出版社,李冀主编)。按原方比例混合除胶饴外的全部药材,以蒸馏水(m ∶V=1 ∶8)浸泡1 h,电热套煎煮40 min,纱布过滤。以相同体积的蒸馏水重复提取1次,过滤,合并两次滤液,加入胶饴使之溶解,减压浓缩至每毫升药液含HQJZ生药1 g。根据人和动物体表面积折算系数换算,HQJZ的给药剂量为9.27 g·kg-1。
1.4 仪器CM1900冷冻切片机(德国Leica公司);KD-BM II电脑生物组织包埋机(浙江省金华市科迪仪器设备有限公司);YD-A生物组织摊片机(浙江省金华市益迪医疗设备有限公司);Moticam Pro 205A三目生物显微镜(麦克奥迪医疗诊断系统有限公司);Cytation 5酶标仪(美国BioTek公司);SmartSpecTMplus核酸蛋白测定仪、MyCyclerTMPCR仪(美国Bio-Rad公司);LightCycler 480II荧光定量PCR仪(瑞士Roche公司)。
2 方法
2.1 动物模型建立及分组采用随机数字表法,将SD大鼠分为正常组、模型组、埃索美拉唑(esomeprazole, ESO)组、HQJZ组,每组各12只。参照文献方法构建脾胃虚寒证候模型[5],预先制备实验所需的1 g·mL-1的番泻叶水煎剂。正常组大鼠在造模全过程每天以10 mL·kg-1灌胃蒸馏水,不作其它任何处理。造模d 1起,模型组、ESO组、HQJZ组大鼠于下午14 ∶00以10 mL·kg-1番泻叶水煎剂灌胃;15 ∶30左右将大鼠置于0.80 m(长)×0.59 m(宽)×0.48 m(高)规格,装满常温自来水的水槽中游泳,直至大鼠四肢划动无力,鼻唇部没入水中,立即捞起。每天于同一时间,连续7 d采用“苦寒泻下+劳倦过度”方法造模,由此建立脾胃虚寒证候模型。d 8起,停止脾胃虚寒证候造模,模型组在上午10 ∶00予以无水乙醇5 mL·kg-1灌胃,12 ∶00给予200 mg·kg-1的阿司匹林水溶液灌胃,由此建立DU(脾胃虚寒证)模型,连续造模4 d。ESO组、HQJZ组则在造模给药的基础上,每日下午14 ∶00分别给予4.17 mg·kg-1的ESO和9.27 g·kg-1的HQJZ水煎剂进行治疗,连续给药4 d(Fig 1)。
2.2 标本采集末次给药后,所有大鼠禁食禁水12 h,d 12取材。采用3%~4%异氟烷(于100% O2环境)麻醉大鼠,常规消毒后,自胸骨剑突下沿腹中线剪开腹壁,腹主动脉采血,4 ℃、3 000 r·min-1离心10 min,分离大鼠血清,-20 ℃保存备用。取血完毕后,迅速采集十二指肠标本,剪取幽门下十二指肠组织3 cm,沿肠系膜纵轴方向剖开,以冰生理盐水漂洗干净,相机拍照,用于观察黏膜损伤情况,并计算黏膜损伤指数。截取1段1 cm靠近幽门的肠组织,以4%多聚甲醛固定。剩余肠组织-80 ℃保存,用于荧光定量PCR实验。
2.3 大鼠一般症状与体征观测实验全程对比观察各组大鼠的整体精神状态、活动状况、毛发光泽、食欲情况、粪便性状等,隔天测定1次大鼠的体质量、进食量及肛温。
2.4 十二指肠黏膜溃疡指数(ulcer index, UI)测定肉眼观察黏膜损伤情况,参照Guth等[6]标准进行评分。正常黏膜:0分;病灶长度≤1 mm:1分;1 mm<病灶长度≤2 mm:2分;2 mm<病灶长度≤3 mm:3分;3 mm<病灶长度≤4 mm:4分;病灶长度>4 mm时,分段计分,若病灶宽度>2 mm,则分数乘以2。最后以各组大鼠十二指肠黏膜病灶分数的均值作为UI。溃疡愈合率/%=[(模型组UI-药物组UI)/模型组UI]×100%。
2.5 十二指肠黏膜组织病理学检查取出固定好的十二指肠组织,采用梯度乙醇脱水2 h,二甲苯透明,包埋。连续石蜡切片,厚度为5 μm,烤片,常规苏木精-伊红(hematoxylin and eosin, HE)染色,中性树胶封片,于100倍镜下进行组织形态观察,选取典型视野拍照,使用ImageJ图像分析软件,测量小肠绒毛高度和隐窝深度。
2.6 细胞因子IL-4、IL-10和TNF-α的检测按照试剂盒说明书准备样品,配制溶液,混匀后,立即采用酶标仪在450 nm波长下检测吸光度。以吸光度值(OD)为纵坐标,各细胞因子标准品浓度为横坐标,绘制标准曲线,样品血清所含的细胞因子浓度根据标准曲线换算。每组设3个复孔。
2.7 荧光定量PCR法检测TLR-2、MyD88 mRNA表达取100 mg十二指肠组织,以液氮初步碾碎后,加入1 mL TRIzol提取总RNA。运用M-MuLV第一链cDNA合成试剂盒将RNA逆转录为cDNA。采用SG Fast qPCR Master Mix试剂进行荧光定量PCR反应,引物序列见Tab 1,配制50 μL反应体系。预变性条件为:95 ℃ 30 s,1个循环。PCR反应条件为:95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。65 ℃ 15 s扩增曲线分析,收集荧光信号。采用2-△△CT法计算目的基因的mRNA相对表达量,其中△Ct值=目的基因Ct值-β-actin Ct值[5]。
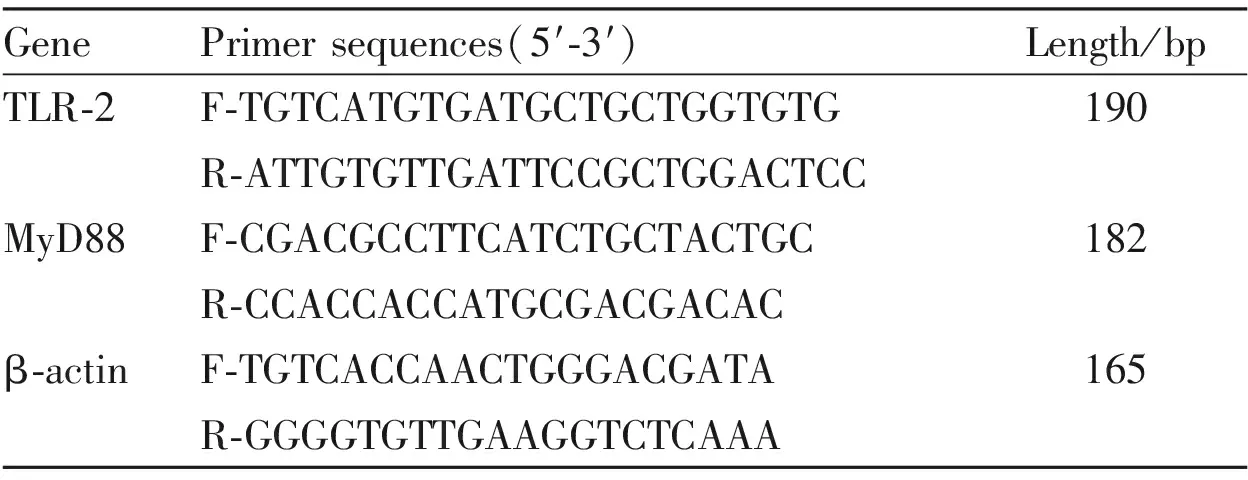
Tab 1 Gene primer sequences for qRT-PCR
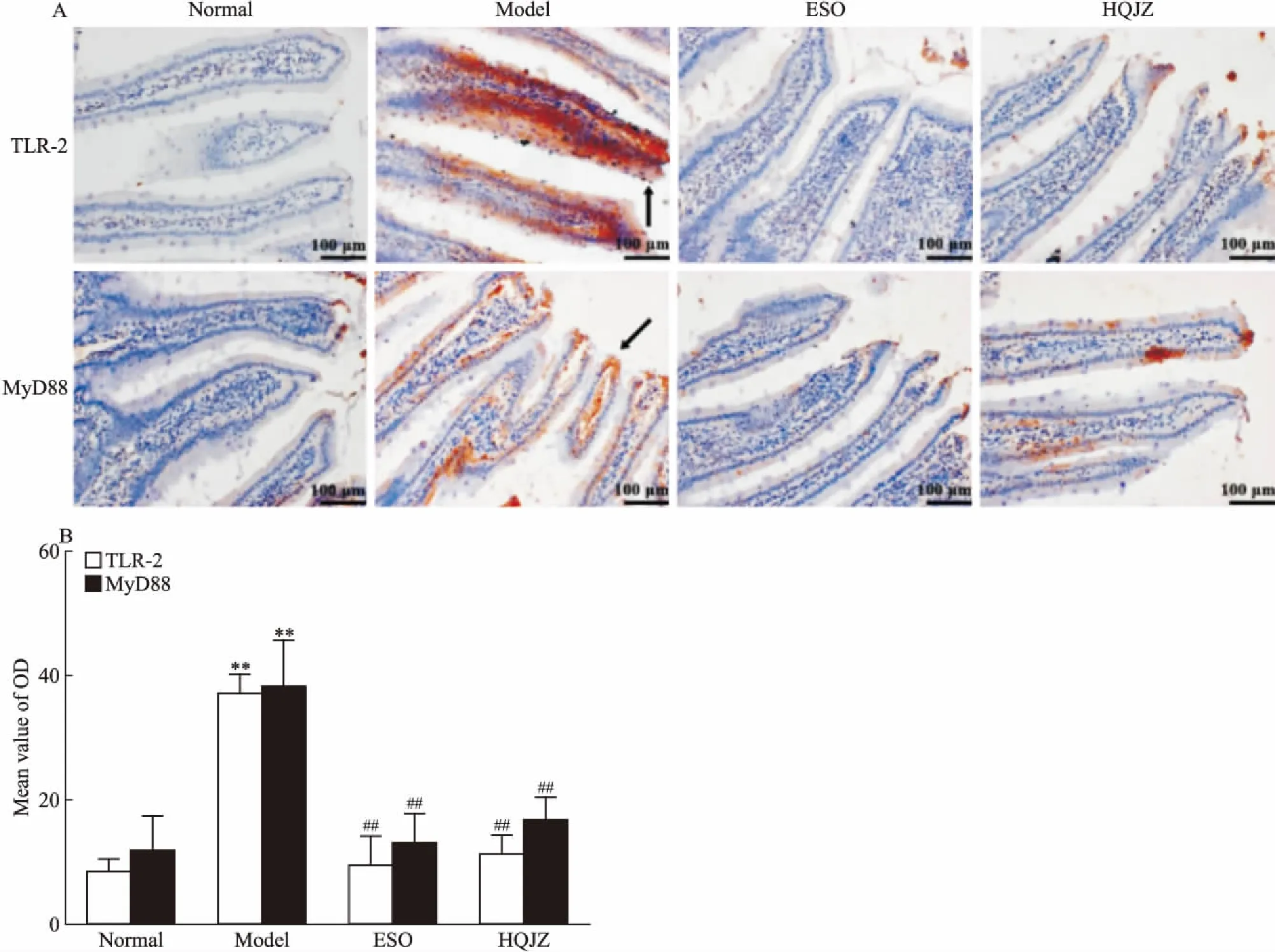
2.8 免疫组化法检测TLR-2、MyD88蛋白表达将固定好的十二指肠组织包埋、切片,采用二甲苯、梯度乙醇、蒸馏水分别将切片脱蜡、水化。以PBS浸润石蜡切片,微波修复,双氧水浸润,PBS浸洗。滴加封闭液,室温放置15 min,分别滴加50 μL TLR-2一抗(1 ∶100)、MyD88一抗(1 ∶100),4 ℃孵育过夜。加入山羊抗兔二抗(1 ∶2 000),室温孵育2 h。加入DAB试剂显色反应10 min,苏木精溶液复染1 min。采用梯度乙醇和二甲苯脱水、透明。中性树胶封片。光学显微镜下观察石蜡切片,采用Motic Image 3.2软件选取典型视野进行拍摄,应用Image-Pro Plus 6.0软件对图片中阳性蛋白表达进行分析,以积分光密度(integral optical density, IOD)值表示[7]。

3 结果
3.1 HQJZ对大鼠体质量、进食量及肛温的影响Fig 2结果显示,造模前(d 0)各组大鼠的体质量、进食量、肛温均无明显差异。经过7 d脾胃虚寒证造模,模型(Model)组大鼠体质量、进食量、肛温均呈现降低趋势,再经过4 d的DU造模,模型大鼠体质量、进食量、肛温值进一步下降(P<0.05,P<0.01)。给予HQJZ治疗后,大鼠体质量明显增加,明显高于给药前(d 7)、模型组(P<0.05);大鼠进食量明显增加,与给药前(d 7)相比有增加趋势,与模型组相比,差异有显著性(P<0.05);大鼠肛温明显提高,明显高于与给药前、模型组(P<0.01)。
3.2 HQJZ对大鼠DU的治疗作用Fig 3、Tab 2结果显示,模型组大鼠十二指肠黏膜出现严重损伤,可见明显出血点或出血条带,溃疡指数明显高于正常组(P<0.01)。给予HQJZ治疗后,黏膜损伤明显减轻(P<0.01)。给予HQJZ治疗后,溃疡愈合率(或抑制率)达80.53%。
Tab 2 Therapeutic effect of HQJZon duodenal ulcer in
**P<0.01vsnormal;##P<0.01vsmodel
3.3 HQJZ对大鼠十二指肠黏膜形态改变的影响Fig 4结果显示,正常大鼠十二指肠组织黏膜层、黏膜下层、肌层层次分明,小肠绒毛排列整齐,中央乳糜管清晰可见。模型组大鼠十二指肠组织可见明显损伤,小肠绒毛大量脱落,上皮层和固有层层次不清,中央乳糜管受损严重,黏膜下层可见炎性细胞浸润。给予HQJZ治疗后,大鼠十二指肠组织基本恢复正常,仅见少量的黏膜上皮细胞损伤脱落,小肠绒毛排列整齐,中央乳糜管排列规整,黏膜下层炎性细胞少见。Fig 5结果表明,模型组大鼠小肠绒毛高度明显降低,隐窝深度变浅(P<0.01)。给予HQJZ治疗后,大鼠小肠绒毛高度明显增加,隐窝深度亦明显增加(P<0.01)。
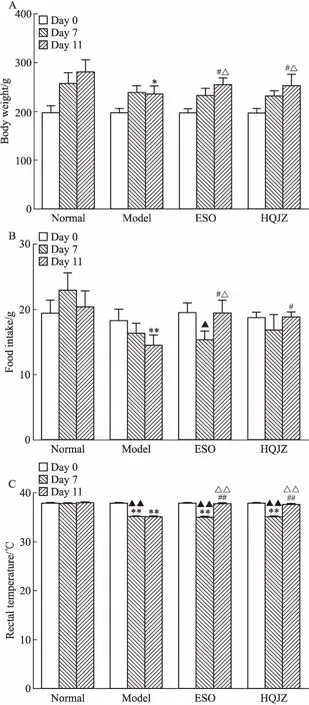
Fig 2 Effect of HQJZ on changes of body weight(A),food intake(B), and rectal temperature(C) in
*P<0.05,**P<0.01vsnormal group;#P<0.05,##P<0.01vsmodel group;▲P<0.05,▲▲P<0.01vsd 0;△P<0.05,△△P<0.01vsd 7
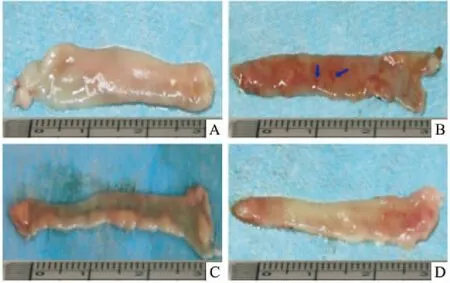
Fig 3 Representative pictures of duodenal tissue in each group
A:Normal;B:Model;C:Esomeprazole;D:HQJZ.Arrowheads indicate mucosal damage/ulcer.
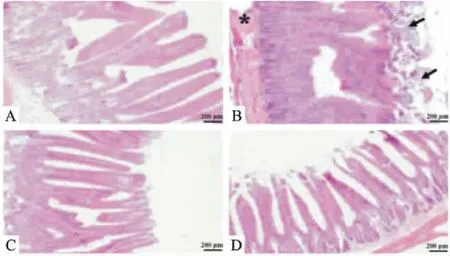
Fig 4 HE staining of duodenum in each group(×100)
A:Normal; B: Model; C: Esomeprazole; D: HQJZ. Arrowheads indicate severe loss of villi in the duodenum, asterisk indicates inflammatory cell infiltration.

Fig 5 Effect of HQJZ on duodenum
**P<0.01vsnormal group;##P<0.01vsmodel group
3.4 HQJZ对大鼠血清IL-4、IL-10、TNF-α含量的影响如Fig 6所示,与正常组相比,模型组大鼠血清抗炎细胞因子IL-4、IL-10含量明显降低(P<0.01);给予HQJZ治疗后,大鼠血清IL-4、IL-10含量均明显增加(P<0.01)。与正常组比较,模型组大鼠血清炎性细胞因子TNF-α含量急剧增加(P<0.01);给予HQJZ治疗后,TNF-α含量明显降低(P<0.01)。
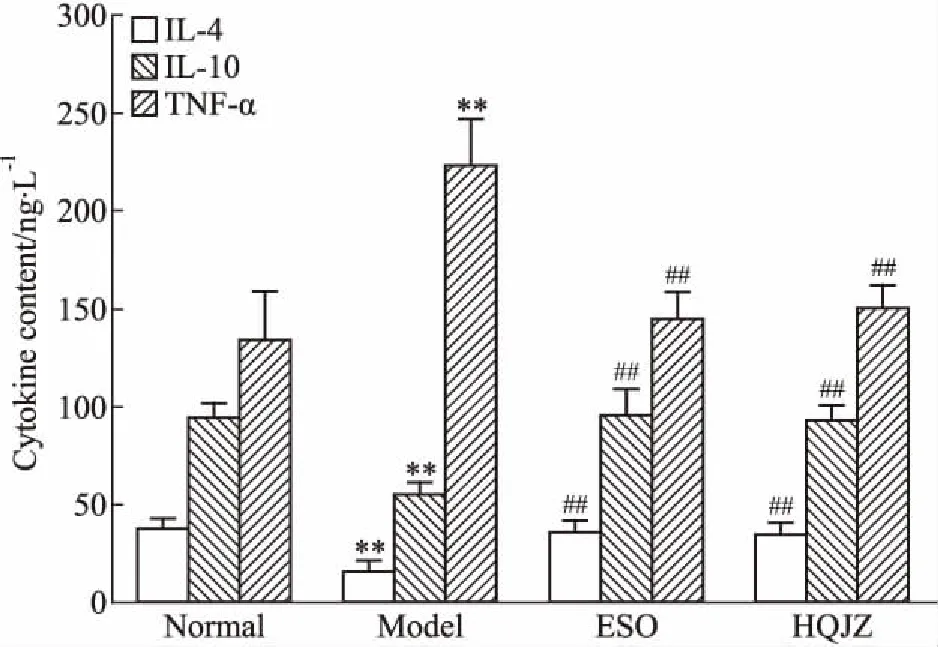
Fig 6 Effect of HQJZ on serum cytokines in
**P<0.01vsnormal group;##P<0.01vsmodel group
3.5 HQJZ对大鼠十二指肠黏膜TLR-2、MyD88 mRNA表达的影响Fig 7结果显示,与正常组比较,模型组大鼠十二指肠黏膜TLR-2、MyD88 mRNA表达均明显上调(P<0.01)。给予HQJZ治疗后,大鼠十二指肠黏膜TLR-2及MyD88 mRNA表达均明显下调(P<0.01)。
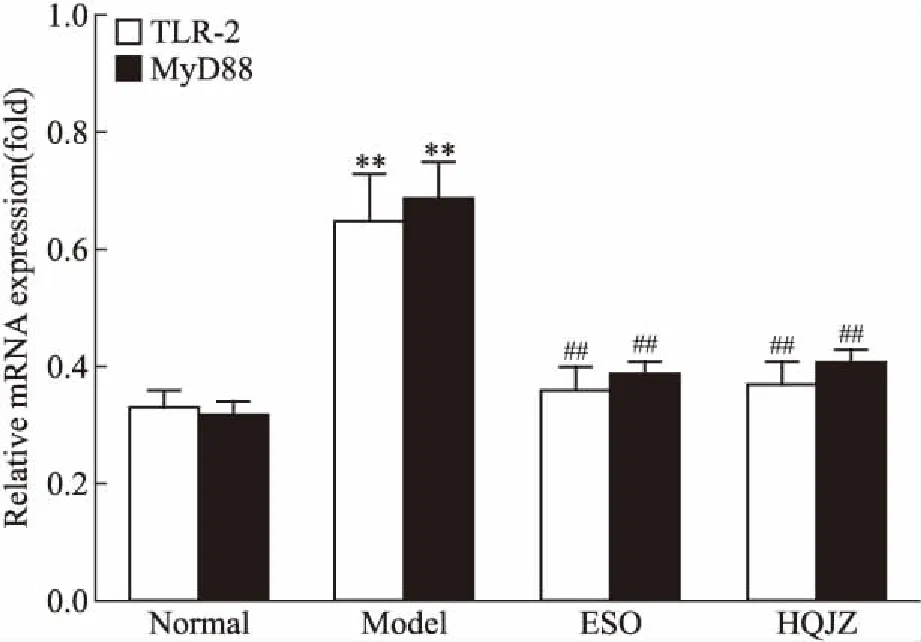
Fig 7 Effect of HQJZ on expression of TLR-2 andMyD88 mRNA in duodenal mucosa of
**P<0.01vsnormal group;##P<0.01vsmodel group
3.6 HQJZ对大鼠十二指肠黏膜TLR-2、MyD88蛋白表达的影响Fig 8结果表明,TLR-2与MyD88蛋白阳性表达部位主要分布于十二指肠黏膜。正常组大鼠肠黏膜TLR-2、MyD88蛋白表达较低,DU模型大鼠肠黏膜TLR-2和MyD88蛋白表达明显升高(P<0.01);给予HQJZ治疗后,TLR-2及MyD88蛋白表达均明显下调(P<0.01)。
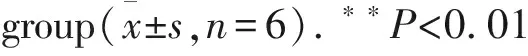
4 讨论
肠道是人体消化系统的重要组成部分,肠黏膜屏障对于维持肠道消化、吸收功能具有极其重要的作用,肠黏膜屏障损伤是DU、溃疡性结肠炎等疾病发生、发展的重要环节[8]。肠黏膜免疫屏障主要由非特异免疫屏障(机械屏障、化学屏障、生物屏障)和免疫屏障构成[9]。与机体整体免疫系统不同,肠黏膜免疫屏障是在抗原刺激性产生的局部免疫反应,通过中和抗原物质,避免黏膜受到损害,从而防止溃疡的发生。肠黏膜免疫屏障主要由分泌型免疫球蛋白(sIgA)介导的体液免疫和细胞毒性介导的细胞免疫构成[10]。
Toll样受体(Toll-like receptor, TLR)是表达于天然免疫细胞(巨噬细胞、树突状细胞等)和其他细胞或组织(上皮细胞、内皮细胞等)表面最重要的模式识别受体,TLR是架接肠道固有免疫和适应性免疫的桥梁。TLR属于I型跨膜蛋白,由富含亮氨酸重复序列的胞外区、跨膜区和含有Toll/白细胞介素1受体同源区(Toll/interleukin 1 receptor homologous region, TIR)结构域的胞内区组成,通过识别病原相关分子模式(pathogen-associated molecular patterns, PAMP)或机体释放的有害内源性物质,诱发天然免疫反应,抵抗病原体感染,抑制炎症反应发生,保护组织黏膜免受损伤[11]。MyD88是胞内含有TIR结构域的蛋白分子,是激活溃疡发生、发展过程中炎症反应最常见的接头分子,MyD88依赖性途径是除TLR-3以外,其他所有TLR共同的信号通路[12]。胃肠道微生物或内源性毒素可通过刺激TLR,诱导上皮细胞迁移、增殖、分化,加固胃肠黏膜上皮紧密连接功能,保护胃肠黏膜屏障,抑制溃疡产生。
TLR-2介导的肠黏膜免疫屏障可产生多种细胞因子,如生长因子、淋巴因子、肿瘤坏死因子、干扰素、白细胞介素等[13]。IL-2、TNF-α、IFN-γ是常见的高表达的炎性细胞因子,IL-4、IL-5、IL-10则是当前研究较多的抗炎细胞因子。TNF-α主要来源于巨噬细胞,通过与相应的介质受体结合或与其他细胞因子相互作用,引起肠黏膜上皮细胞凋亡,细胞因子瀑布式释放,诱导黏膜损伤,促进溃疡形成。IL-4由T细胞辅助细胞2(Th2)产生,对sIgA介导的肠黏膜屏障体液免疫具有明显增强作用。作为一种免疫调节性细胞因子,IL-10可调节多种免疫细胞的分化和增殖,限制和终止炎症反应,防止过度免疫应答,并在一定程度上影响紧密连接蛋白表达,保证肠黏膜上皮完整性,抑制溃疡发生[14]。
现代药理学研究表明,HQJZ可抑制胃酸分泌、缓解胃肠平滑肌痉挛,且具有促使肉芽生长、抗炎和抑制幽门螺杆菌的作用,可从根本上改善胃肠道的内环境,提高溃疡愈合率[15]。本研究以TLR-2介导的肠黏膜免疫功能为切入点,探讨HQJZ治疗DU的药理效应及分子机制。本研究结果表明,HQJZ可明显改善大鼠的一般症状、体征,给予HQJZ治疗后,模型组大鼠的体质量、进食量、肛温均明显提升。HQJZ可明显促进大鼠十二指肠溃疡愈合,溃疡愈合率高达80.53%。HE染色结果表明,给予HQJZ治疗后,DU模型大鼠十二指肠黏膜排列整齐,少见炎性细胞浸润,结构基本恢复正常。ELISA结果表明,HQJZ可明显增加大鼠血清抗炎细胞因子IL-4、IL-10含量,且可明显降低致炎细胞因子TNF-α含量。分子水平实验结果证实,HQJZ可明显下调大鼠十二指肠黏膜TLR-2、MyD88 mRNA表达;免疫组化结果则表明,HQJZ可明显降低DU大鼠肠黏膜TLR-2和MyD88蛋白表达。
综上所述,本文研究结果提示,HQJZ具有明显的促进DU愈合的效应,其机制可能与干预TLR-2介导的肠黏膜免疫屏障功能有关。