马里苷通过AMPK通路抑制高糖软脂酸诱导大鼠肾小球系膜细胞氧化应激及炎症损伤的作用机制
阿米拉·阿不拉提,张楠楠,古丽拜克热木·热合曼,范雪梅,毛新民,姚 蓝
(新疆医科大学1. 中医学院中药系、2. 药学院药理教研室、3. 中医学院、4. 中医学院中药资源教研室,新疆 乌鲁木齐 830011)
随着人类生活水平不断提高,糖尿病肾病(diabetes nephropathy,DN)发病率呈现逐年上升趋势,这已成为严重危害人类健康的重要问题。DN是导致终末期肾功能衰竭最严重、最常见的糖尿病并发症之一[1]。研究表明,糖脂代谢紊乱会引起肾脏内氧化应激反应的发生,炎症细胞因子的增加,激活多种信号通路,诱发DN的发生、发展,加重肾脏的损害[2]。
两色金鸡菊(CoreopsistinctoriaNutt.)又名昆仑雪菊,在新疆民间维吾尔人当作花茶饮用,对心血管疾病有预防作用。植物化学研究表明,两色金鸡菊富含黄酮类化合物,其具有明显的抗氧化、抗病毒、抗炎等活性[3]。研究发现,马里苷是黄酮类化合物的主要活性成分之一,为查尔酮主要的葡萄糖苷[4],其具有良好的降高血糖[5]、调血脂、抗高血压[6]等功效。课题组前期研究已证实,两色金鸡菊提取物的活性成分通过抗氧化应激、抑制炎症反应,发挥保护肾脏的作用,但其主要活性成分的药理作用机制仍有待于研究。因此,本研究以马里苷为研究对象,观察其对体外DN模型中氧化应激与炎症反应,以及对纤维蛋白因子表达的影响。通过腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,研究马里苷延缓模型细胞炎症与氧化应激损伤所致肾脏纤维化病变的作用机制,为两色金鸡菊中活性成分马里苷的药理作用与开发利用提供理论依据。
1 材料与方法
1.1 细胞与试剂大鼠肾小球系膜细胞HBZY-1(货号:ZQ0540),均购自上海中乔新舟生物科技有限公司。马里苷(批号:171215),购自成都昂赛思生物科技有限公司;DMEM培养基(HyClone公司,批号:SH30022.01);抗体NADPH氧化酶4(NADPH oxidase 4,NOX4)(14347-1-AP)、胶原蛋白VI(Collagen VI)(17023-1-AP)、AMPKα(66536-1-lg),均购自Proteintech公司;抗体磷酸化-AMPKα(p-AMPKα)(AF3423)、转化生长因子-β1(TGF-β1)(AF1027),购自Affinity Biosciences;α-平滑肌肌动蛋白(α smooth muscle actin,α-SMA)抗体(Cell Signaling公司,批号:19245S);抗体AMPKγ1(ab32508)、纤维连接蛋白(fibronectin,FN)(ab2413)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)(ab25124)购自Abcam公司;MTS细胞增殖试剂盒(比色法)(Promega,批号:G3580);
1.2 仪器Steri-CuLt型CO2培养箱(美国Thermo);AxioObserverZ1倒置显微镜(德国ZEISS);5427R型高速冷冻离心机(德国Eppendorf);Multiskan GO酶标仪(美国Thermo Fisher);156-8001型垂直电泳槽、GelDocXR+凝胶成像分析系统(美国Bio-Rad)。
1.3 方法
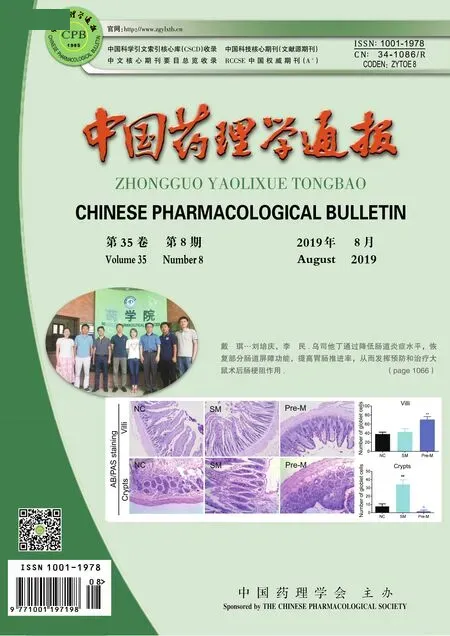
1.3.1MTS检测细胞增殖 用DMEM完全培养基培养HBZY-1细胞,将细胞置于含5% CO2、37 ℃培养箱中适应性培养至细胞贴壁生长,待细胞生长至80%~90%时,接种于96孔板中,5×103个/孔。待细胞贴壁生长融合70%~80%后,弃上清。将细胞分为11组,分别是:空白组(Control,无细胞只含培养基),正常对照组(NG,有细胞用DMEM完全培养基);高糖+软脂酸组(HG+PA),采用葡萄糖100 mmol·L-1、软脂酸250 μmol·L-1干预细胞建立模型;马里苷干预组在模型细胞建立的基础上,采用不同剂量马里苷(1、 5、 10、 20、 40、 80、 160、 320 μmol·L-1)干预。继续培养24 h后,弃上清,每孔加入无血清DMEM培养基+MTS 20 μL,37 ℃恒温培养箱避光孵育2 h,酶标仪在490 nm处测定吸光度(A)值,实验独立重复3次。细胞增殖率/%=(A药物组-A空白组)/(A对照组-A空白组)×100%。
1.3.2Western blot实验 在T25培养瓶中培养细胞,取对数生长期HBZY-1细胞,细胞融合至80%~90%后,分为NG组、HG+PA组、HG+PA+ 马里苷(25、50、100、200 μmol·L-1)(HG+PA+M25、HG+PA+M50、HG+PA+M100、HG+PA+M200)给药组。继续培养24 h后弃去培养液,冰上裂解,加入蛋白裂解液RIPA提取总蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE电泳,在100 V、250 mA条件下冰浴转膜,5%脱脂奶粉封闭膜2 h,4 ℃孵育一抗过夜,避光常温孵育二抗2 h,显色,测灰度值(实验独立重复3次)。ImageJ软件进行检测与分析条带的灰度值。

2 结果
2.1 马里苷对高糖软脂酸诱导的HBZY-1细胞增殖的影响Tab 1结果显示,高糖软脂酸干预下的模型组增殖率为212.85%,明显高于正常组(P<0.01),说明DN细胞模型建立成功。在此基础上采用不同浓度马里苷干预,对细胞增殖出现了抑制作用,其中马里苷(80、320 μmol·L-1)组细胞增殖率明显下降(P<0.05)。但当马里苷浓度达到160 μmol·L-1时,其抑制作用出现了反弹,原因可能是随马里苷给药浓度的升高,马里苷本身的颜色加深,随之吸光度(OD)值也增加。
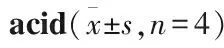
Tab 1 Effect of marein on HBZY-1 cell proliferationinduced by high glucose palmitic
#P<0.05,##P<0.01vsNG;*P<0.05,**P<0.01vsHG+PA
2.2 马里苷对高糖软脂酸诱导的HBZY-1细胞中氧化应激因子NOX4表达的影响如Fig 1所示,与正常对照组相比,高糖软脂酸干预后的模型细胞中NOX4蛋白表达明显升高(P<0.01);与高糖软脂酸模型组相比,NOX4蛋白表达量随马里苷浓度的增加而呈下降趋势(P<0.01)。
2.3 马里苷对高糖软脂液诱导的HBZY-1细胞中炎性因子TGF-β1、MCP-1表达的影响如Fig 2所示,与正常对照组相比,高糖软脂酸干预后的模型细胞中TGF-β1、MCP-1蛋白表达明显升高(P<0.01);与高糖软脂酸模型组相比,TGF-β1、MCP-1的蛋白表达随马里苷浓度的增加而明显下降(P<0.01)。
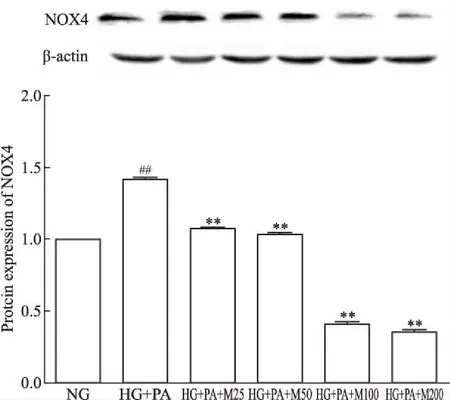
Fig 1 Effect of marein on expression of NOX4 protein in HBZY-1cells induced by high glucose and palmitic
##P<0.01vsNG group;**P<0.01vsHG+PA group
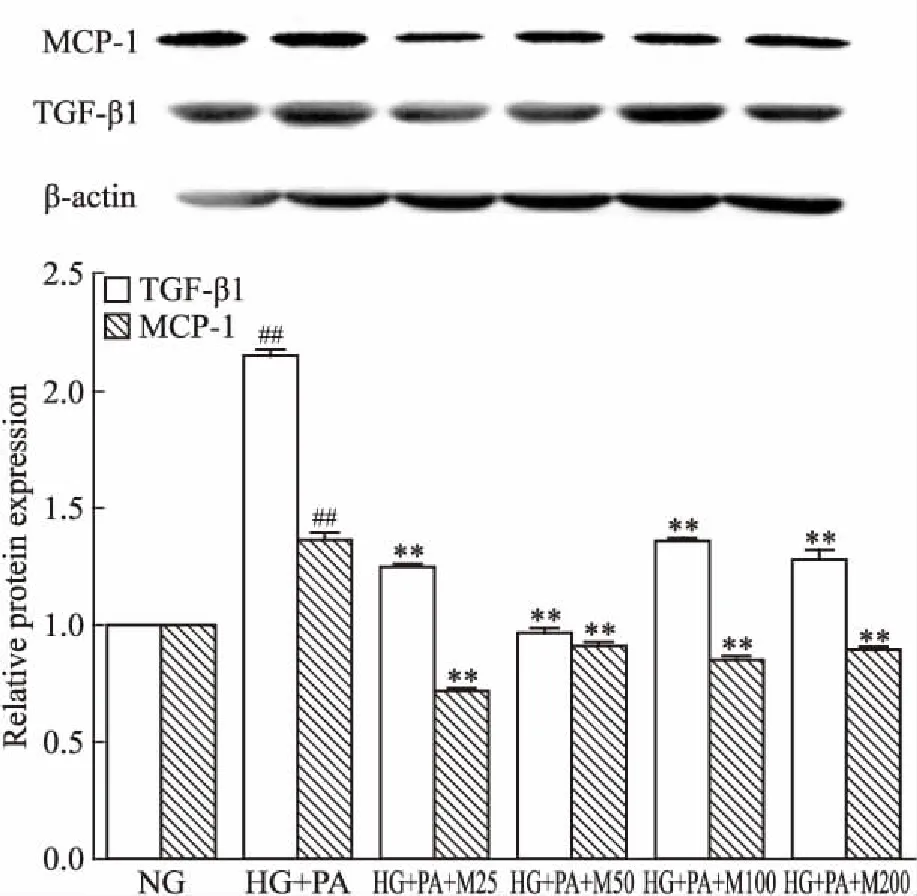
Fig 2 Effect of marein on expression ofTGF-β1 and MCP-1 protein in HBZY-1cells induced by high glucose and palmitic
##P<0.01vsNG group;**P<0.01vsHG+PA group
2.4 马里苷对高糖软脂酸诱导的HBZY-1细胞中α-SMA、FN、Collagen Ⅵ表达的影响如Fig 3所示,与正常组比较,高糖软脂酸干预后的模型细胞中α-SMA表达呈现下降趋势(P<0.01);与高糖软脂酸模型组比较,马里苷(25、50、200 μmol·L-1)干预模型细胞后,α-SMA相对表达量明显降低(P<0.01)。高糖软脂酸干预后,模型细胞中FN、Collagen Ⅵ的蛋白表达与正常组比较明显升高(P<0.01);与高糖软脂酸模型组相比,FN、Collagen Ⅵ的蛋白表达随马里苷浓度的增加而呈下降趋势(P<0.01),其中马里苷200 μmol·L-1抑制模型细胞中Collagen Ⅵ表达作用最为明显。
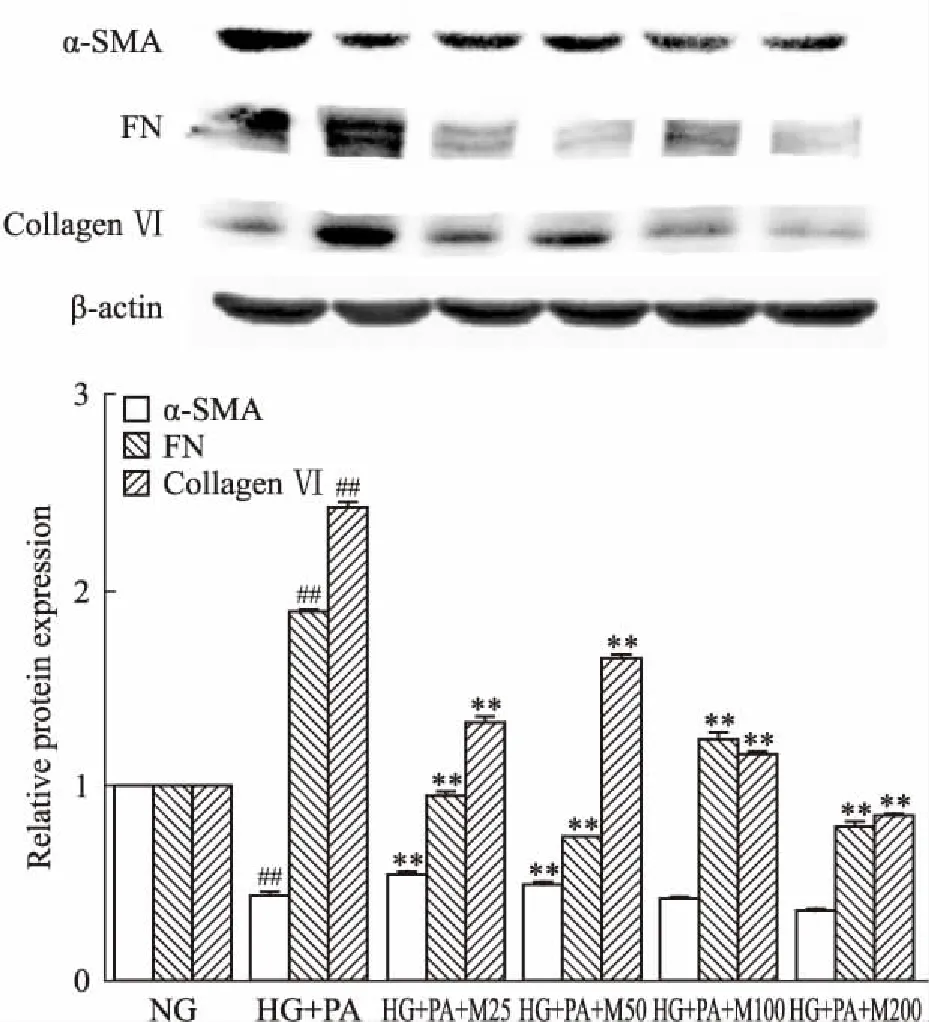
Fig 3 Effects of marein on expression ofα-SMA, FN, collagen Ⅵ in HBZY-1 cells induced byhigh glucose and palmitic
##P<0.01vsNG group;**P<0.01vsHG+PA group
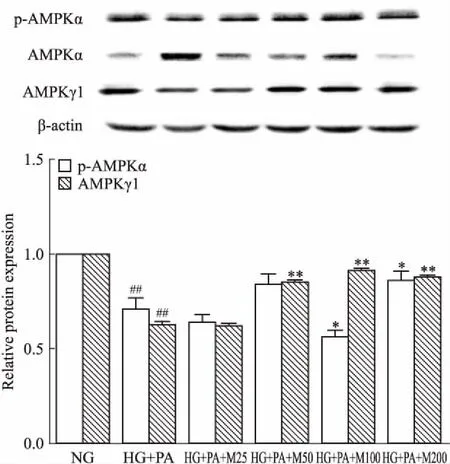
Fig 4 Effect of marein on expression ofp-AMPKα and AMPK γ1 protein in HBZY-1cells induced by high glucose and palmitic
##P<0.01vsNG group;*P<0.05,**P<0.01vsHG+PA group
2.5 马里苷对高糖软脂酸诱导的HBZY-1细胞中AMPK通路相关蛋白表达的影响如Fig 4所示,与正常组比较,高糖软脂酸干预后的模型细胞中p-AMPKα、AMPKγ1蛋白相对表达量明显降低(P<0.01);不同浓度马里苷干预模型细胞后,一定程度上调p-AMPKα、AMPKγ1蛋白表达,其中马里苷100、200 μmol·L-1组p-AMPKα蛋白相对表达量较模型组明显增加(P<0.05)。马里苷50、100、200 μmol·L-1能明显增加细胞中AMPKγ1蛋白表达。
3 讨论
目前DN发病机制尚不明确,肾小球系膜细胞表型转分化是DN病理早期改变,以系膜细胞增殖、基底膜的增厚、肾小球基质聚集及肾小球硬化为特征。机体长期处于氧化应激状态,是发生肾小球硬化的关键[7]。因此,研究认为“氧化应激”是DN发展和进展的关键中介[8]。糖尿病过程中持续代谢紊乱诱发肾脏氧化应激反应,造成线粒体以及内皮细胞损伤,从而导致炎症反应、相关代谢通路异常及肾脏结构与功能的改变[9]。在DN早期,NOX4在糖尿病肾小球中高表达[10],产生大量活性氧(reactive oxygen species,ROS),诱导肾脏发生氧化应激反应,通过多种信号通路介导肾小球肥大、肾小球基底膜增厚、胞外基质FN、胶原蛋白等沉积,最终导致肾脏结构与功能的改变。因此,寻找NOX4抑制剂具有临床新药的研究意义[11]。本实验表明,马里苷抑制氧化应激损伤因子NOX4表达,进而保护肾脏损伤。
炎性因子TGF-β1是介导DN肾脏炎症反应及纤维化病变的重要诱导因子,在DN状态下,TGF-β1含量异常增加,通过诱导其下游信号通路,刺激系膜细胞、成纤维细胞、小管上皮细胞等增殖,并释放大量FN、胶原等细胞外基质成分。肌成纤维细胞是细胞外基质的主要来源之一,TGF-β1通过激活下游Smad2/3信号通路,诱导成纤维蛋白的标志性蛋白α-SMA异常表达,激活肾小管上皮细胞转化与分化,促使肾小管上皮细胞向肌成纤维细胞转化加剧。成纤维母细胞的异常增多释放大量纤维蛋白FN、胶原,是细胞外基质增厚,肾小球、肾小管滤过率降低,最终导致肾间质纤维化发生的关键环节[12]。MCP-1在DN进展中是重要的促炎细胞因子。在高糖高脂环境下,肾小球系膜细胞、足细胞等多种功能细胞,均大量释放MCP-1到细胞外,对肾脏细胞增殖、炎性及细胞黏附性均有影响,可以在一定程度上反映肾脏受炎症损伤的程度。高糖软脂酸刺激系膜细胞增加MCP-1蛋白表达,加剧肾脏炎症反应[13]。由此可知,DN过程中伴随炎症反应是导致肾脏纤维化病变的重要发病机制,马里苷能明显抑制高糖软脂酸诱导HBZY-1细胞中TGF-β1、MCP-1表达,进而延缓炎症反应所导致的肾脏损伤。
AMPK被认为是一种细胞能量稳态介质,并有助于系膜细胞增殖和纤维化的产生[14],参与细胞能量代谢,调节机体能量的储存与消耗。AMPK主要以α、β、γ三个亚基的形式存在。AMPK最重要的亚基是γ亚基, 是体内AMPK水平传感器。近年来研究者发现,AMPK在肾脏高表达,参与肾脏细胞能量稳态,并发挥对肾脏保护作用。激活AMPK可抑制成纤维细胞增殖和细胞外基质积累[15]。AMPK通过抑制肾脏氧化应激与炎症反应,延缓糖尿病肾病肾脏病理损伤[16]。分子对接模拟表明,马里苷与AMPKγ亚基有高度亲和力,通过作用于AMPKγ亚基,上调活性AMPK磷酸化水平。体外细胞实验表明,马里苷通过活化AMPKγ亚基,抑制丙二醛诱导的大鼠肾上腺嗜络细胞凋亡[4]。本研究进一步证实,马里苷对AMPKγ1蛋白具有明显上调作用,进一步说明了AMPK可能为马里苷的活性作用靶点。马里苷通过激活AMPK信号通路,抑制高糖软脂酸诱导HBZY-1细胞中氧化应激与炎症损伤,在延缓DN的肾脏纤维化病变中发挥保护作用。然而,AMPK在肾脏中的保护作用机制较为复杂,马里苷如何通过介导AMPK通路调控DN的发生、发展,仍有待于进一步研究。