基于蛋白质组学探讨粗壮女贞总苷对高脂血症金黄地鼠的调脂作用机制
张紫文,李晨晨,潘瑞乐,孙 乐,杨润梅,陈爱兵,高南南
[1. 河北科技大学化学与制药工程学院,河北 石家庄 050018;2. 中国医学科学院北京协和医学院药用植物研究所中草药物质基础与资源利用教育部重点实验室&中药(天然药物)创新药物研发北京市重点实验室,北京 100193]
大量研究资料表明,高脂血症是脑卒中、冠心病、心肌梗死、心脏猝死等心脑血管疾病独立而重要的危险因素,因此,调节血脂、改善血脂异常的临床治疗是降低心脑血管病发生率和死亡率的重要措施[1]。目前,临床上广泛使用的降脂西药主要是他汀类、贝特类,它们的降脂疗效确切,但长期使用都存在不可避免的副作用。相对于西药来说,降脂中药历史悠久,具有品种多、毒副作用小的优点。近年来的研究表明,很多中药都有调节血脂的作用,如大黄、山楂、黄连、三七、蒲黄、党参、何首乌、葛根、莱菔子等,同时也发现了姜黄素、小檗碱、金丝桃苷等一些降脂作用较强的活性成分。本课题组前期研究发现,源于小叶苦丁茶基源植物的粗壮女贞总苷[total phenylpropanoid glycoside fromLigustrumrobustum(Roxb.) Blume,LRTPG]具有很好的调节血脂和肝脂作用。进一步机制研究表明,LRTPG能促进地鼠肝激酶B1(liver kinase B1,LKB1)磷酸化,激活腺苷酸(AMP)活化的蛋白激酶(AMP-activated protein kinase,AMPK),进而磷酸化抑制固醇调节元件结合蛋白-1c(sterol regulatory element binding protein 1c,SREBP-1c),在转录水平抑制其下游的脂肪酸和甘油三酯(triglyceride,TG)合成酶的表达[2-3]。课题组还发现,LRTPG可以使高脂饲料诱导的肥胖小鼠体质量、脂肪量、脂肪细胞横截面面积、Lee’s指数和总胆固醇(total cholesterol,TC)水平下降。其减肥调脂机制为脂肪组织的瘦素水平升高,并因此降低脂肪组织的甘油二酯酰基转移酶水平,从而抑制TG的合成;同时,肝脏胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的表达增加,促进了胆固醇的分解代谢[4]。中药有效部位的调脂作用通常有多个靶点和多条途径,为了寻找LRTPG除了LKB1-AMPK- SREBP-1c及CYP7A1以外的其他调脂通路,本实验拟通过label-free蛋白质组学技术,应用前期实验的高脂血症模型组和LRTPG给药组金黄地鼠肝脏[2],进一步探究LRTPG的调脂机制。
1 材料与方法
1.1 材料
1.1.1标本来源 高脂饲料诱导建立的金黄地鼠高脂血症模型组肝脏,分别标记为M1、M2、M3;LRTPG(1.2 g·kg-1,连续灌胃给药4周)给药组肝脏分别标记为L1、L2、L3。
1.1.2试剂与仪器 FA、HPLC级氨水、ACN(美国Sigma公司);蛋白裂解液(瑞士Roche公司);BCA蛋白定量试剂盒(康为世纪生物技术有限公司)。高速离心机、热干浓缩仪、pH计、质谱、液相、NanoDrop(美国Thermo Scientific公司);酶标仪(美国BioTek公司)。
1.2 方法研钵中加入蛋白裂解液,充分研磨肝脏样品,冰上超声破碎后取上清,采用微孔检测法测定蛋白浓度,将SDS-PAGE上样缓冲液与各组蛋白样品按照1 ∶4的比例混匀,沸水浴5 min,冷却到室温后,离心取上清,加入加样孔后进行电泳。蛋白定量后,用50 mmol·L-1碳酸氢铵稀释至蛋白中尿素浓度为2 mol·L-1,按100 ∶1加入胰蛋白酶,37 ℃酶解超过12 h。采用纳升液相色谱分离样品,水相(A相)为0.1%甲酸水溶液,有机相(B相)为0.1%甲酸和80%乙腈水溶液,流速为600 nL·min-1。样品经液相系统分离后,用质谱仪进行质谱分析。使用Mascot 2.2软件进行查库鉴定,并利用Proteome Discoverer 1.4定量分析,数据库为uniprot-mouse-160125,过滤参数为Peptide FDR≤0.01。
2 结果
2.1 金黄地鼠肝脏总蛋白的提取分析与SDS-PAGE电泳金黄地鼠肝脏通过提取、裂解及定量,测出蛋白提取率及浓度均符合下一步测试要求。通过SDS-PAGE对提取结果进行检测发现,6组样品之间平行度较好,蛋白条带清晰(Fig 1)。
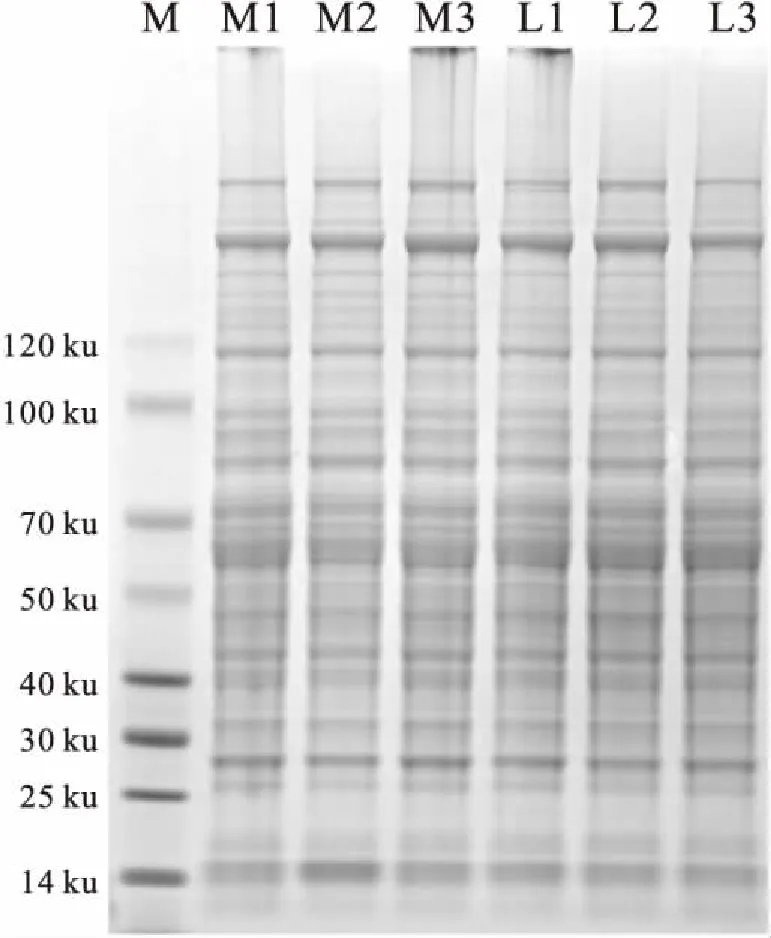
Fig 1 SDS-PAGE gel map of liver sample
2.2 生物信息分析对实验中得到的549个差异蛋白进行GO分析和KEGG Pathway分析。GO分析目的为研究差异蛋白的功能,生物过程(biological process,BP)分析发现,这些蛋白主要涉及代谢过程、运输过程、氧化还原过程、蛋白质运输过程、磷酸化、信号转导、细胞内蛋白质转运、蛋白水解和脂质代谢过程。其中,参与代谢过程的蛋白最多,为56个蛋白,占10%;参与运输过程和氧化还原过程的蛋白分别为54和43个,各占9.8%和7.8%;参与脂质代谢过程的蛋白为12个,占2.2 %(Fig 2)。细胞位置(cell component,CC)分析表明,差异蛋白所处位置主要为细胞质,占42.4 %(Fig 3)。分子功能(molecular function,MF)分析鉴定揭示出差异蛋白涉及多项分子功能,包括蛋白质结合(19.7%)、核苷酸结合(15.5%)、金属离子结合(12%)、poly(A)RNA结合(11.1%)、水解酶活性(8.7%)和脂质结合(1.8%)等功能(Fig 4)。通过KEGG pathway对549个差异蛋白进行检索,这些蛋白共参与到30个信号转导通路中,涉及多种代谢途径,包括氧化磷酸化、非酒精性脂肪肝病、PI3K-Akt信号通路、cAMP信号通路、cGMP-PKG信号通路等(Fig 5)。
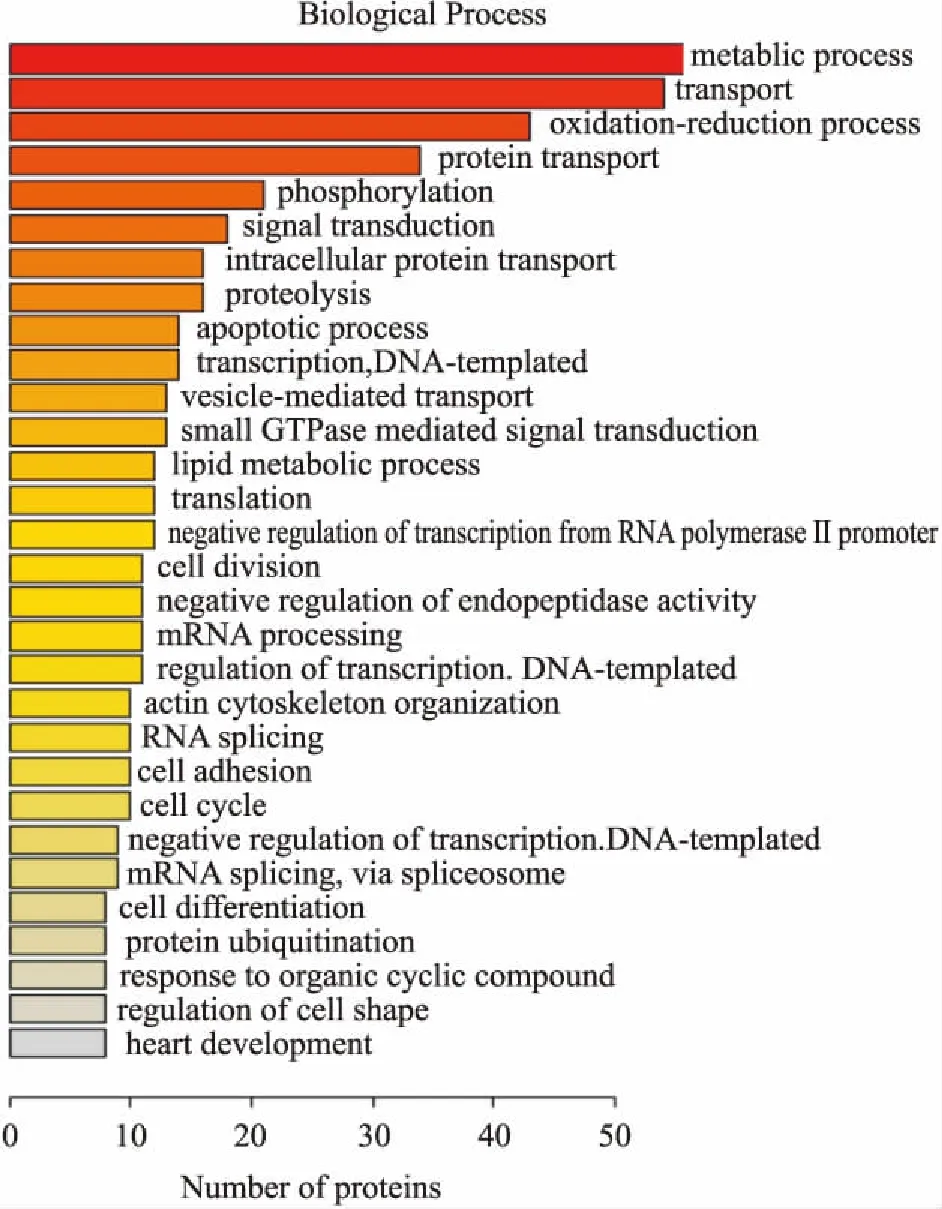
Fig 2 Biological progress
2.3 样本表达模式聚类聚类分析根据数据的数学特征对数据进行分类比较,本实验对差异表达蛋白在模型组和LRTPG(1.2 g·kg-1)给药组间比较,分析蛋白的上调和下调情况。L组代表LRTPG给药组,M组代表模型组,其中蛋白上调用红色表示,蛋白下调用绿色表示,差异蛋白聚类图见Fig 6。
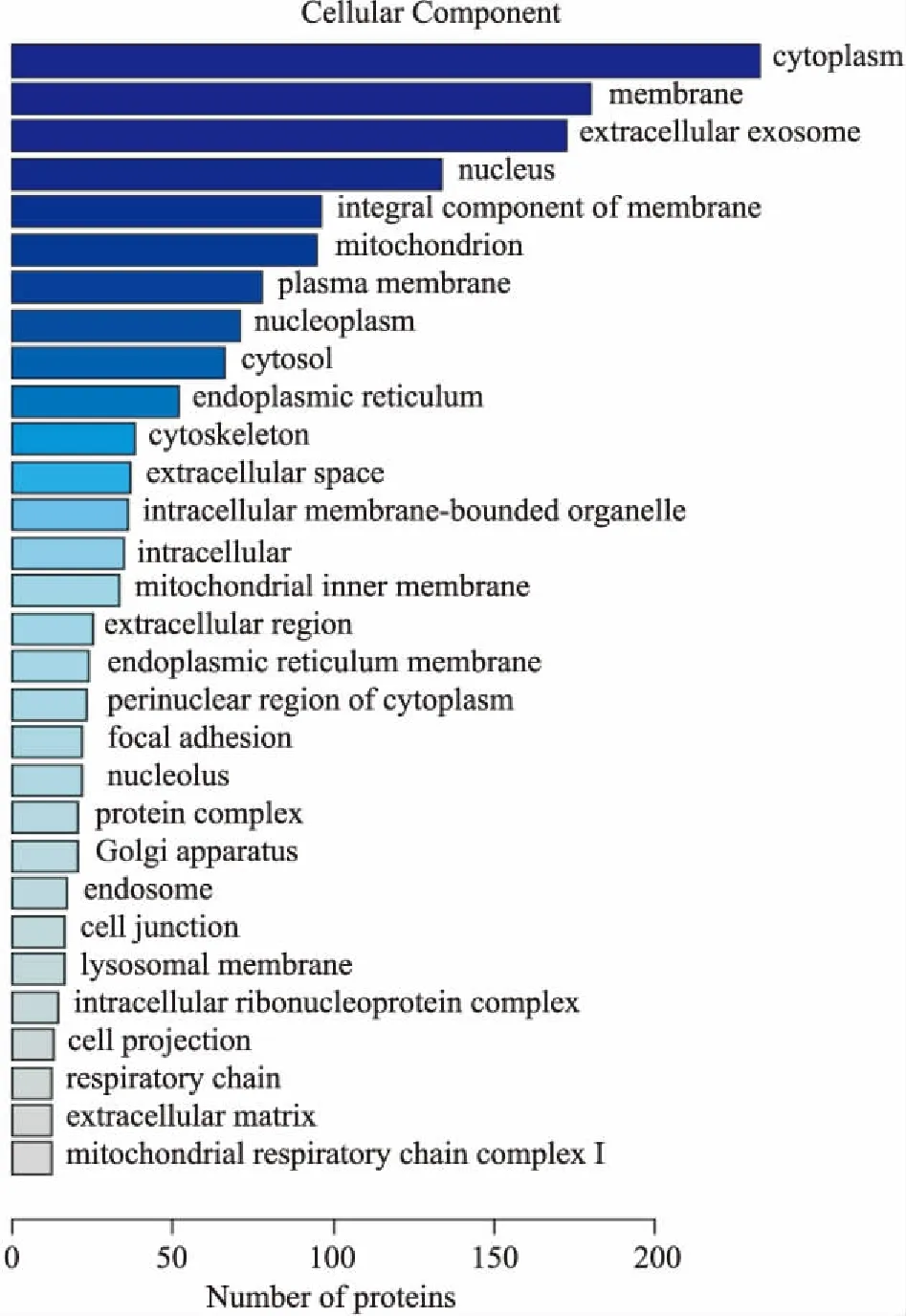
Fig 3 Cellular component
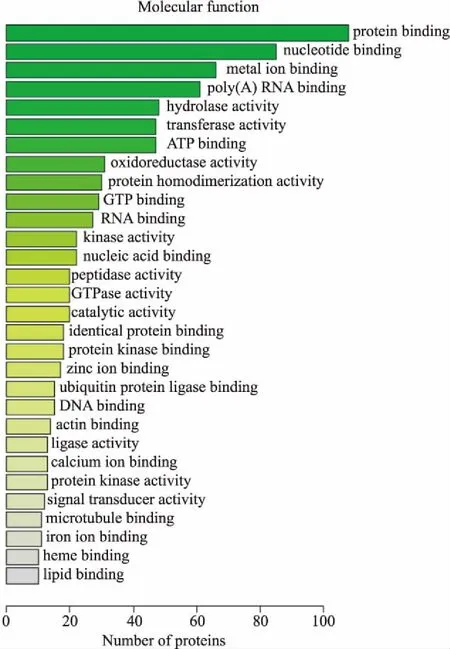
Fig 4 Molecular function
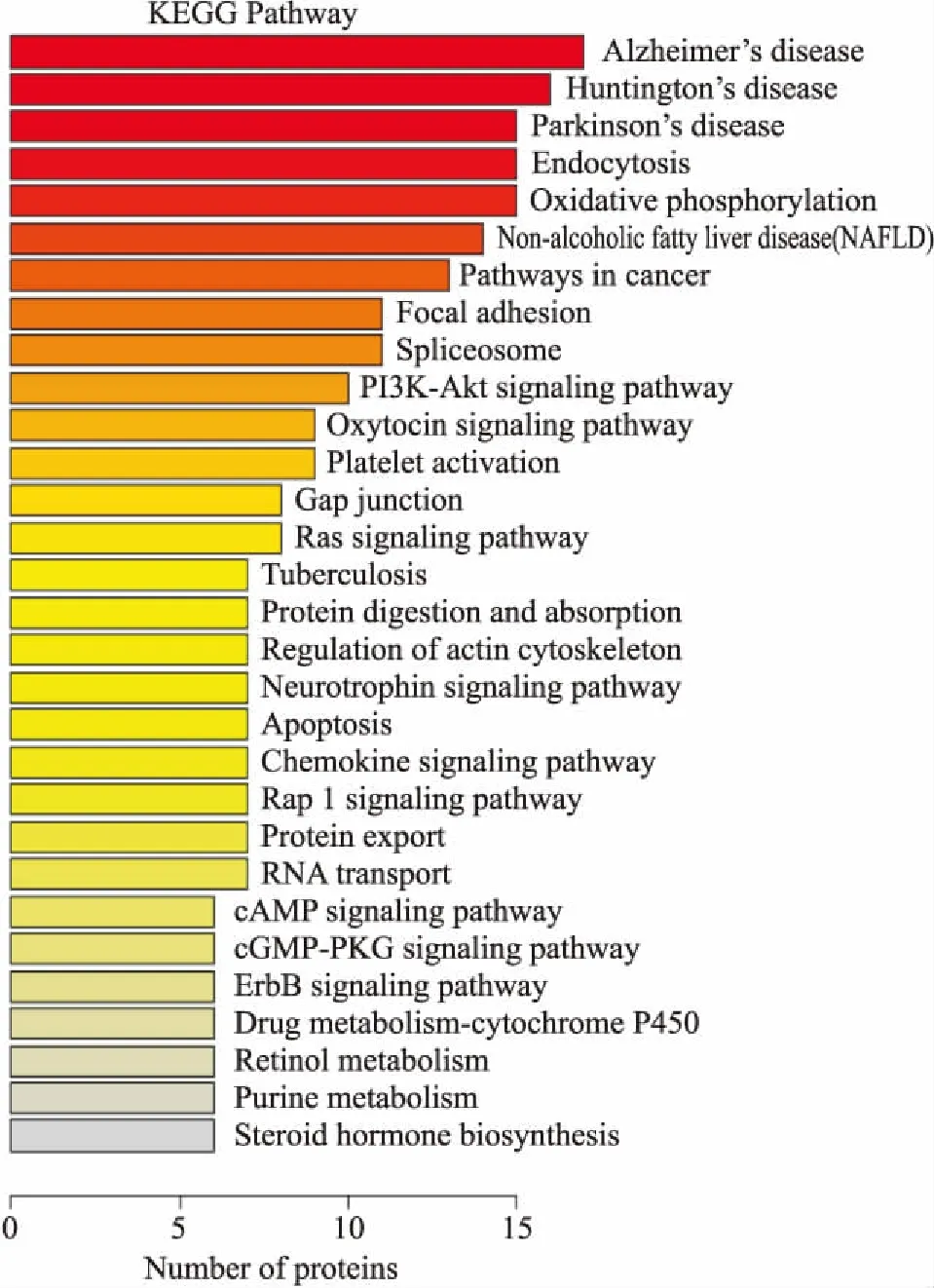
Fig 5 KEGG annotation of differential proteins
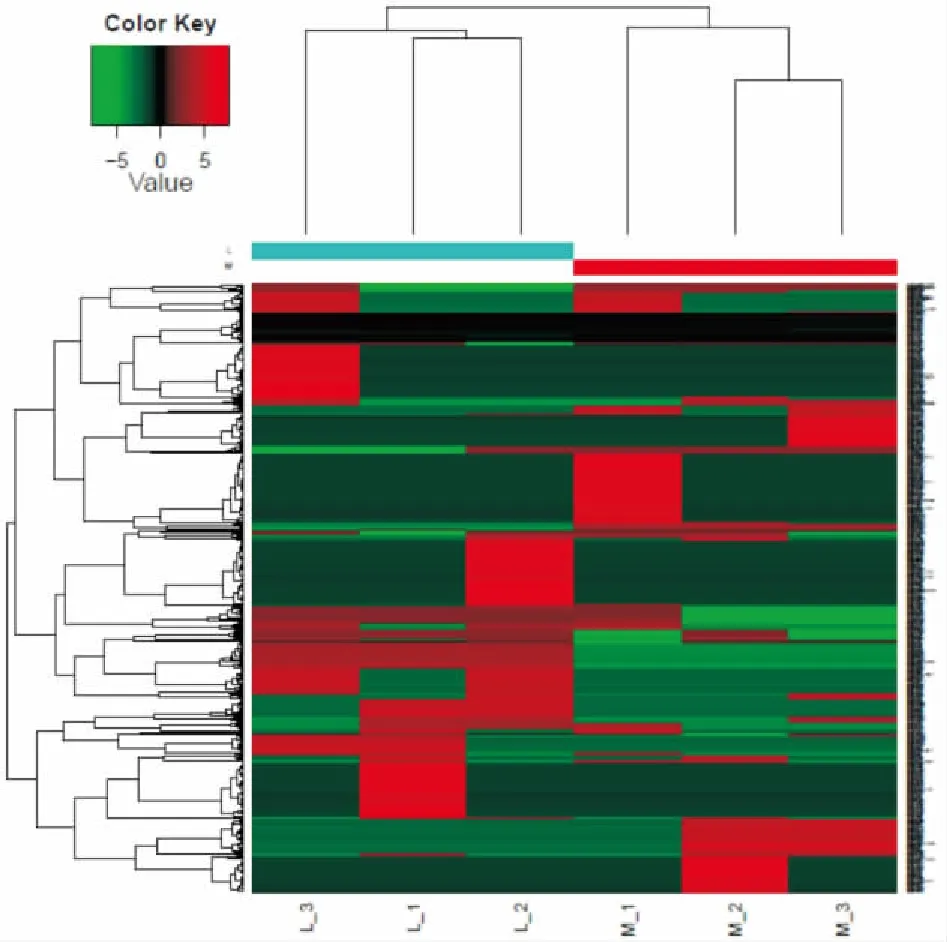
Fig 6 Clustering map of differential protein in Lgroup and M group
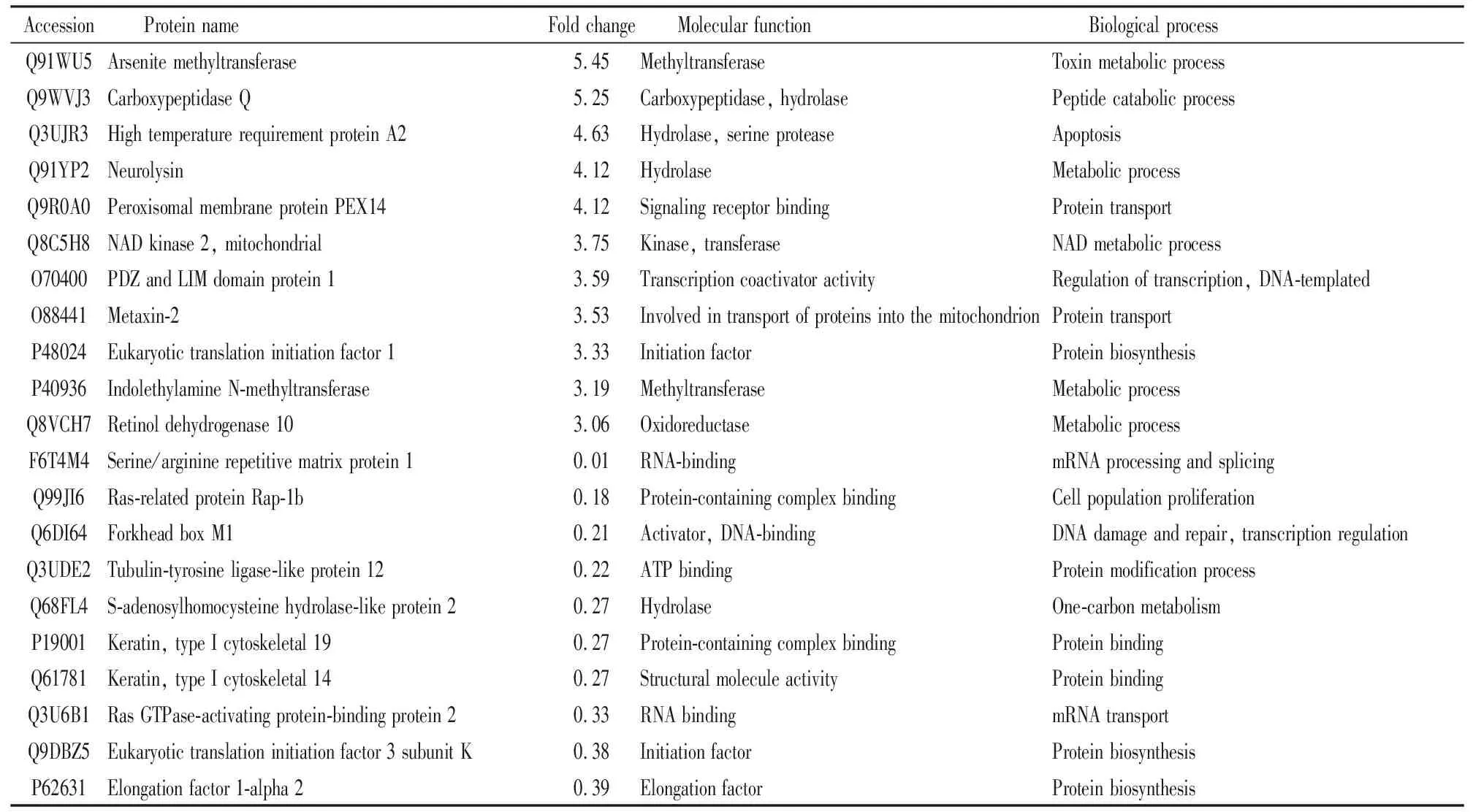
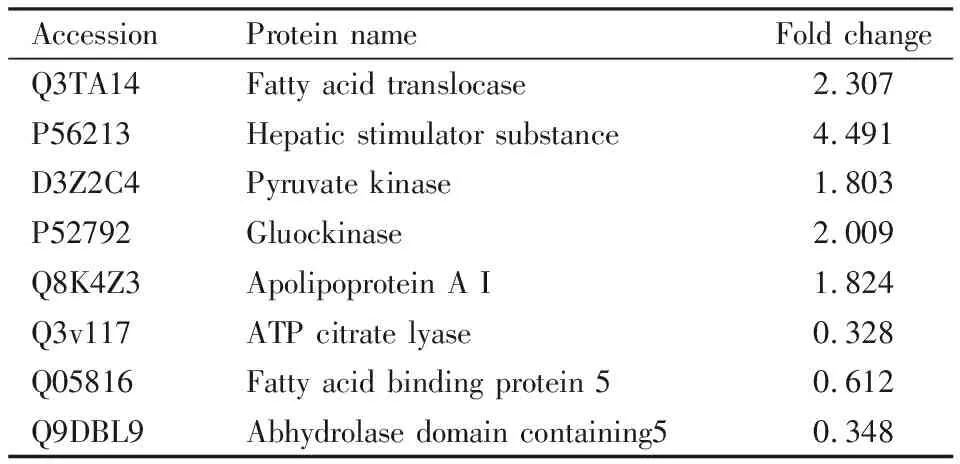
2.4 差异表达蛋白筛选结果采用Proteome Discoverer 1.4对蛋白质组进行Label-free定量分析,结果表明,共鉴定出2 231个蛋白,模型组与LRTPG给药组差异表达蛋白为549个,其中93种蛋白表达上调,59种蛋白表达下调,397种蛋白只在模型组或者给药组中有定量值。以两组样本定量比值(fold change,FC)求取log10对数为横坐标,以T检验显著性检验P值的负对数-log10(P-value)为纵坐标,得到火山图,见Fig 7。火山图中的绿色和红色圆点表示差异具有显著性的蛋白质(满足FC≤0.667或FC≥1.5),灰色圆点为无变化的蛋白质(0.667 Fig 7 Volcanic map of protein abundance 我们进一步以FC> 3或FC< 0.4为筛选条件,筛选出21个差异显著性表达的蛋白,利用Uniport数据库分析这些蛋白质的生物学过程及分子功能。Tab 1结果显示,其中参与代谢过程的蛋白有8个,LRTPG作用后表达明显上调的蛋白有7个:砷甲基转移酶(arsenite methyltransferase,As3mt)参与毒素代谢过程;羧肽酶Q(carboxypeptidase Q,CPQ)在循环肽的水解中起重要作用;高温相关丝氨酸蛋白酶A2(high temperature requirement protein A2,Htra2)在细胞凋亡过程中起到促进蛋白降解的作用;神经溶解素(neurolysin,Nln)可以水解寡肽;线粒体烟酰胺腺嘌呤二核苷酸激酶(mitochondrial NAD kinase 2,Nadk2)参与烟酰胺代谢;吲哚乙胺N-甲基转移酶(indolethylamine N-methyltransferase,Inmt)参与色氨酸代谢;视黄醇脱氢酶10(retinol dehydrogenase 10,Rdh10)是正常胚胎发育所必需的。表达明显下调的蛋白有1个:S-腺苷高半胱氨酸水解酶样蛋白2(S-adenosylhomocysteine hydrolase-like protein 2,Ahcyl2 )参与半胱氨酸和蛋氨酸代谢。 参与蛋白质运输、修饰、结合以及合成过程的蛋白有8个,表达明显上调的蛋白有3个:过氧化物酶体膜蛋白14(peroxisomal membrane protein PEX14,Pex14)在过氧化物酶体转运中发挥关键作用;线粒体外膜导入复合蛋白2(metaxin-2,Mtx2)参与蛋白质转运到线粒体中;真核翻译起始因子1(eukaryotic translation initiation factor 1,Eif1)在真核细胞蛋白质翻译起始过程中发挥重要作用。表达明显下调的蛋白有5个:微管蛋白酪氨酸连接酶类似物12(tubulin-tyrosine ligase-like protein 12,Ttll12)可以在微管蛋白的羧基末端翻译后修饰;细胞角蛋白19(keratin、type I cytoskeletal 19,Krt19)对维持细胞结构的完整性起重要作用;细胞角蛋白14(keratin、type I cytoskeletal 14,Krt14)参与形成上皮细胞的细胞骨架;真核翻译起始因子3亚基K(eukaryotic translation initiation factor 3 subunit K,Eif3k)是真核翻译起始因子3复合物的组分;真核延伸因子1 A 2(elongation factor 1-alpha2,Eef1a2)在蛋白质合成过程中促进氨酰tRNA与核糖体A位点的GTP依赖性结合。 参与转录调节的蛋白有5个,表达明显上调的蛋白为PDZ和LIM域蛋白1(PDZ and LIM domain protein 1,Pdlim1),参与成纤维细胞中应力纤维的组装、拆卸和定向。表达明显下调的蛋白有4个:丝氨酸/精氨酸重复性基质蛋白1(serine/arginine repetitive matrix protein 1,Srrm1)是参与众多前mRNA加工过程;Ras相关蛋白Rap-1b(Ras-related protein Rap-1b,Rap1b)在内皮屏障功能的建立中起作用;叉头盒蛋白M1(forkhead box M1,Foxm1)在控制细胞增殖中起重要作用;Ras GTP酶活化蛋白结合蛋白2(Ras GTPase-activating protein-binding protein 2,G3bp2)是参与mRNA转运的支架蛋白。 以上表达差异有显著性的蛋白在多种生物过程中发挥功能,但与脂质代谢相关性较少。为寻找LRTPG调脂作用的靶点,我们筛选出参与脂质代谢过程的8个差异蛋白进行深入分析,见Tab 2。 2.4.1脂质代谢相关的上调蛋白 脂肪酸转移酶(fatty acid translocase,FAT/CD36)对脂质的转运内吞和信号传导非常重要,可与游离脂肪酸结合,促进对游离脂肪酸的摄取[5]。本实验中,LRTPG(1.2 g·kg-1)给药组地鼠肝脏的CD36表达较模型组增高,由此推测,LRTPG可以通过上调肝脏CD36的表达,增加对游离脂肪酸的摄取,从而降低血中游离脂肪酸含量。 Tab 1 Differential protein of FC> 3 or FC<0.4 Tab 2 Lipid metabolism-related differential protein 肝刺激因子(hepatic stimulator substance,HSS)存在于哺乳动物的胚肝,以及部分切除后的残余肝脏中。研究表明,加入外源性HSS蛋白可以促进肝细胞增殖,减少肝细胞内脂质的蓄积,使细胞免受脂质损伤[6]。本实验中,LRTPG给药组地鼠肝脏的HSS表达较模型组明显增高,表明LRTPG可以通过促进肝脏中HSS的表达,降低肝脏中脂质的堆积,减轻肝损伤。课题组前期研究也发现,LRTPG对高脂血症金黄地鼠肝细胞病变具有明显的减轻效果[2]。 丙酮酸激酶(pyruvate kinase,PK)将磷酸烯醇式丙酮酸转变成丙酮酸,是调节糖酵解的关键酶之一。PK被激活,葡萄糖分解加快。本实验中,LRTPG给药组地鼠肝脏的PK表达较模型组明显增高,表明LRTPG可以通过激活PK,提高葡萄糖的分解代谢速度,从而减少葡萄糖转化为脂质。 葡萄糖激酶(gluockinase,GCK)催化葡萄糖磷酸化为葡萄糖-6-磷酸。GCK活性微小的改变就会导致糖代谢很大的变化,被认为是具有前景的糖尿病治疗药物新靶点[7]。本实验中,LRTPG给药组地鼠肝脏的GCK表达较模型组明显增高,表明LRTPG可促进高脂饮食金黄地鼠体内的葡萄糖合成肝糖原,进而避免肝脏将多余的能量转变成脂肪储存,减少肝脏脂质堆积。 载脂蛋白A I(apolipoprotein A I,ApoA I)是高密度脂蛋白的主要载脂蛋白,在外周组织中,ApoA I为游离胆固醇和磷脂的受体,能促进胆固醇的摄取,并且能够将高密度脂蛋白中的胆固醇酯转移到肝脏中进行代谢,阻止胆固醇在外周组织中的聚积[8]。LRTPG给药组肝脏中ApoA I表达明显升高,提示LRTPG可能通过上调ApoA I来促进胆固醇逆向转运。 2.4.2脂质代谢相关的下调蛋白 ATP柠檬酸裂解酶(ATP citrate lyase,ACLY)是连接着葡萄糖降解与脂肪酸、胆固醇合成的关键代谢酶。ACLY通过影响乙酰辅酶A,控制脂肪酸从头合成[9]。本实验中,LRTPG给药组地鼠肝脏的ACLY表达较模型组降低,表明LRTPG可通过抑制ACLY的表达来抑制脂肪酸的合成,进而减少肝脏中脂肪的堆积。 脂肪酸结合蛋白5(fatty acid binding protein 5,FABP5)对硬脂酸和亚油酸具有高度亲和力,并能特异性结合脂肪酸,通过调节细胞内脂肪酸转运调控脂质代谢[10]。本实验中,LRTPG给药组地鼠肝脏的FABP5表达较模型组降低,表明LRTPG可通过减少FABP5的表达来抑制脂肪酸的转运。 自水解酶域蛋白5(abhydrolase domain containing 5,ABHD5)可通过激活甘油三酯脂肪酶,调控脂肪分解代谢过程[11]。LRTPG给药组相比模型组地鼠肝脏的ABHD5表达下调,表明LRTPG并未通过ABHD5来促进脂肪的分解代谢。 中药是中华民族的瑰宝,但是中药成分复杂多样,且无法很好地解释中药的作用靶点和机制,阻碍了中药现代化的发展。将蛋白质组学技术应用于中医药相关研究中,比较细胞或动物模型给药前后,相应靶器官或组织中蛋白质的变化,对中药有效部位或有效成分作用靶点进行识别,有助于科学解释中药的作用机制。差异蛋白质定量分析是最为常见的定量蛋白质组学,包括同位素标记相对和绝对定量(isobaric tags for relative and absolute quantification,iTRAQ)和非标记定量(label-free)。近年来,蛋白质组学技术广泛的应用于中药作用机制的研究中。Zhang等[12]利用iTRAQ技术,分析研究了茵陈五苓散对高脂血症大鼠血浆和血管组织差异表达的蛋白,表明该药的作用机制涉及脂质代谢、凝血、炎症等通路。Zhou等[13]将一种由10种中药组成的清肺口服液给予呼吸道合胞病毒(respiratory syncytial virus, RSV)感染的肺炎小鼠,利用label-free技术分析和比较小鼠血清蛋白质组的变化,揭示纤维蛋白肽B和肝素辅因子II是清肺口服液治疗RSV肺炎的靶点,并且提示清肺口服液的作用与其改善RSV引起的机体免疫、炎症、凝血反应的紊乱状态密切相关。 我们前期的一系列药效学研究已经明确了LRTPG的调脂减肥功效,并阐明了LRTPG的部分调脂机制。肝脏作为脂质代谢的中心和最直接的脏器,它对机体脂质代谢的调节起到决定性作用。本研究选用高脂饲料诱导的高脂血症模型组和LRTPG给药组金黄地鼠的肝脏,应用label-free蛋白质组学技术比较和筛选了两组金黄地鼠肝脏的差异表达蛋白,并进行生物信息学分析。KEGG通路分析表明,筛选出的差异蛋白参与到多种代谢途径中,与脂质代谢相关的主要包括氧化磷酸化、非酒精性脂肪肝、PI3K-Akt等信号通路。进一步对差异蛋白进行筛选分析发现:(1)LRTPG通过上调CD36,增加对游离脂肪酸的摄取,并且下调FABP5、ACLY,抑制游离脂肪酸的转运和合成,降低血清中游离脂肪酸的含量,减少肝脏的脂质堆积。秦佑等[14]发现,树豆酮酸A可以通过减少游离脂肪酸的释放来降低小鼠3T3-L1脂肪细胞总脂肪的含量;Furuhashi等[15]研究显示,给予小鼠FABP抑制剂,可预防和治疗动脉粥样硬化和2型糖尿病;Pinkosky等[16]发现,ETC-1002可以通过激活AMPK和抑制ACLY的活性,减少高脂血症金黄地鼠肝脏中TC、TG的含量,并且降低循环中致动脉粥样硬化脂蛋白的含量。(2)LRTPG增加HSS的表达量,从而保护肝脏,降低肝损伤。Jiang等[17]发现,HSS基因转移可抑制缺氧/复氧诱导的细胞死亡,以及缺血/再灌注造成的小鼠肝脏损伤。(3)LRTPG提高PK和GCK的活性,调节糖代谢来加快葡萄糖的分解,同时促进葡萄糖合成糖原,减少肝脏中脂肪的堆积,达到降低肝脂的效果。(4)LRTPG还可能通过上调ApoA I来促进胆固醇逆向转运。Gordts等[18]发现,将人类ApoA I基因通过腺病毒注入小鼠体内,小鼠血浆中HDL-C水平升高,并且心肌梗死模型小鼠的死亡率降低。综上所述,label-free蛋白质组学研究筛选出的与脂代谢相关差异表达的蛋白,很可能是LRTPG发挥调脂作用的潜在靶标蛋白,涉及不同生物学功能和信号通路。为证实LRTPG的调脂新靶点,我们拟采用Western blot、免疫组化等技术,进一步验证蛋白质组学研究结果。 [致谢:本研究在中国医学科学院药用植物研究所中草药物质基础与资源利用教育部重点实验室和中药(天然药物)创新药物研发北京市重点实验室完成,感谢实验室老师和同学们给予的帮助和指导!]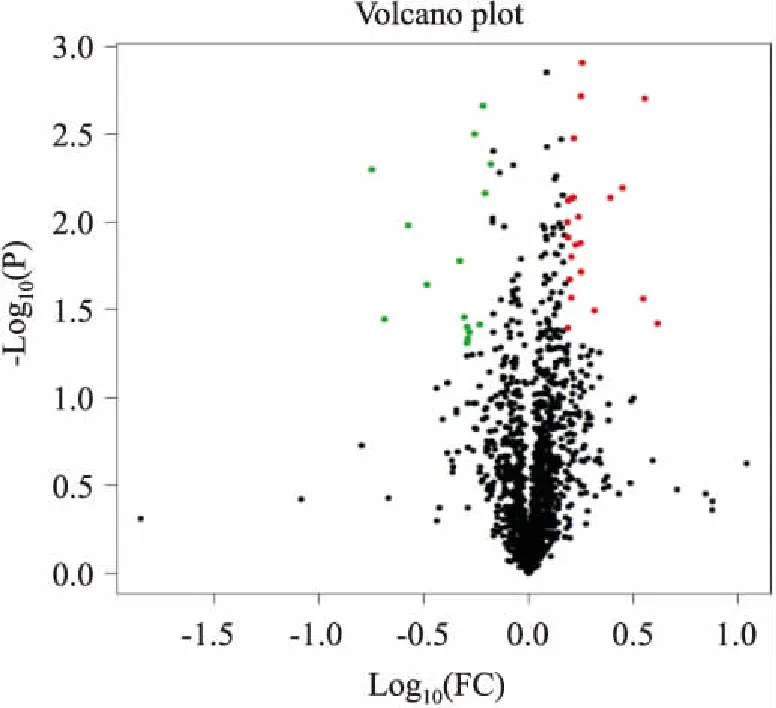
3 讨论