ERK抑制剂U0126通过下调cyclin D1与survivin蛋白表达抑制乳腺癌细胞增殖
田继华,常思佳,郭海秀,冀 贺,王艳红
(山西医科大学微生物学与免疫学教研室,山西 太原 030001)
乳腺癌是女性最常见的恶性肿瘤之一,发病率居高不下,并且呈年轻化趋势,但病因尚未完全清楚[1]。肿瘤的发生、发展是一个十分复杂的过程,癌细胞的突变、增殖、细胞程序性死亡都参与其中。大量研究发现,cyclin D1[2]与survivin蛋白[3]参与肿瘤的增殖和抵抗凋亡,促进肿瘤细胞的增殖。ERK通路是目前研究较多的,与肿瘤细胞增殖密切相关的信号通路,ERK的过度激活在口腔癌、黑色素瘤、乳腺癌等许多人类癌症中均有发现[4]。本研究以人乳腺癌细胞株为研究对象,观察ERK抑制剂U0126对乳腺癌细胞增殖、细胞周期及凋亡的影响,并通过检测cyclin D1及survivin蛋白表达探讨其具体的调控机制。
1 材料与方法
1.1 材料
1.1.1药物与试剂 MCF7完全培养液、L-15培养基,由中国科学院干细胞库提供;U0126、p44/42 MAPK(ERK1/2)抗体、phospho-p44/42 MAPK(ERK1/2)(Thr202/Tyr204)抗体,均购于美国Cell Signaling Technology公司;抗cyclin D1(H-295)、GAPDH、survivin、cleaved caspase-3抗体,均购自美国Santa Cruz Biotechnology;Annexin V-FITC细胞凋亡检测试剂盒、细胞DNA含量检测试剂盒(细胞周期)、全蛋白抽提试剂盒(KGP250)、磷酸化蛋白提取试剂盒、BCA蛋白浓度测定试剂盒,购自南京凯基生物科技发展有限公司。
1.1.2细胞株 人乳腺癌细胞株MCF-7、MDA-MB231,由中国科学院干细胞库提供。
1.1.3仪器 HEPA-CLASS100三气组织培养箱(美国Thermo公司);Wellscan MK3酶标仪(芬兰雷勃仪器厂);ESP ELITE型流式细胞仪(美国COULITER公司);Bio-Rad GelDoc EZ凝胶成像系统、Quantity One分析系统(美国Bio-Rad公司)。
1.2 细胞培养及分组人乳腺癌细胞株MCF-7、MDA-MB231分别用含10%胎牛血清(FBS)的MCF7完全培养液、L-15培养基,在37 ℃、5% CO2培养箱常规培养。将已传代2~3次,融合度达80%的细胞换用无血清培养基24 h,使细胞进入静止期,然后进行细胞分组干预:MCF-7组(MCF7完全培养液常规培养,含10% FBS)、MCF-7+U0126组(MCF7完全培养液中加入U0126,调整U0126浓度为5 μmol·L-1)、MDA-MB231组(L-15培养基+10% FBS常规培养)、MDA-MB231+U0126组(L-15培养基+10% FBS+ U0126,调整U0126浓度为5 μmol·L-1)。
1.3 MTT法检测细胞增殖将MCF-7、MDA-MB231单细胞悬液接种于2个96孔培养板,1×103~1×104个细胞每孔,37 ℃、5% CO2培养箱中培养;分组,每组设6个复孔;U0126分别干预24、48 h,在干预结束前4 h,每孔加入MTT 20 μL;弃掉培养液,每孔加150 μL DMSO,室温振荡10 min,使结晶物充分溶解;酶标仪检测各孔492 nm波长处吸光度值(OD值),记录结果,实验重复3次。
1.4 流式细胞仪检测细胞周期将培养瓶中细胞消化,制成单细胞悬液,接种于6孔细胞培养板,5×105个细胞/孔,培养24 h;将细胞分组后,培养24 h收集各孔细胞,1 000 r·min-1离心5 min,弃上清,将细胞浓度调整为1×108·L-1;取1 mL细胞悬液,离心去上清,加入70%预冷的乙醇1 mL,4 ℃固定过夜;用PBS洗去固定液,离心后加100 μL RNase A,37 ℃水浴30 min;再加入400 μL PI进行染色混匀,4 ℃避光30 min;上流式细胞仪检测,记录激发波长488 nm处荧光。
1.5 流式细胞仪检测细胞凋亡将细胞接种于6孔细胞培养板培养,分组后再培养24 h;胰酶消化后分别收集各孔细胞,离心5 min后,收集1×105~5×105个细胞;加5 μL Annexin V-FITC混匀后,加入5 μL PI混匀;室温避光反应5~15 min;1 h内上机检测。
1.6 Western blot检测p-ERK/ERK、cyclin D1、survivin及cleaved caspase-3蛋白表达细胞分组培养2 h后,收集细胞提取蛋白;采用BCA蛋白定量试剂盒测定蛋白浓度,调至等浓度后加入上样缓冲液混合,离心后上样;恒压80 V电泳,30 min后改为恒压120 V至电泳结束;将蛋白转至PVDF膜上,用5%脱脂奶粉室温封闭,加入相应一抗,在摇床上4 ℃孵育过夜,TBST洗膜3次后,加相应二抗室温孵育2 h,洗膜后显色,使用凝胶成像系统拍照分析,计算各条带光密度(optical density,OD)值,以靶蛋白与内参蛋白的OD值比值代表相对蛋白的表达量。

2 结果
2.1 U0126抑制乳腺癌细胞MCF-7、MDA-MB231的增殖根据各组OD值(Tab 1)及公式:抑制率/%=(1-药物干预组OD值/对照组OD值)×100%,计算抑制率。结果显示,U0126干预组MCF-7、MDA-MB231细胞在24 h的抑制率分别为45.12%、29.11%;48 h抑制率分别为49.57%、36.73%,与对照组比较,差异有显著性(P<0.01),说明U0126能有效抑制乳腺癌细胞MCF-7、MDA-MB231的增殖。从结果中我们也发现,U0126对MCF-7的抑制作用要强于MDA-MB231,两种细胞48 h的抑制率要高于24 h,但差异无显著性(P>0.05)。
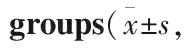
Tab 1 The optical density(OD) measured at492 nm in different n=6)
**P<0.01vsMCF-7;##P<0.01vsMDA-MB231
2.2 U0126将MCF-7、MDA-MB231细胞周期阻断在G0/G1期细胞周期结果显示(Fig 1、Tab 2),与MCF-7、MDA-MB231组细胞相比,U0126干预组G0/G1期细胞比例明显增加,S及G2期细胞比例下降(P<0.05,P<0.01),说明U0126可使细胞停滞于G0/G1期,抑制细胞分裂增殖。

Fig 1 Cell cycle assay in different groups
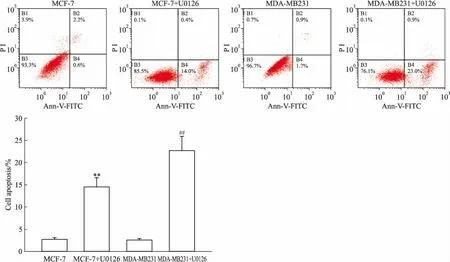
2.3 U0126增加MCF-7、MDA-MB231早期凋亡细胞如Fig 2所示,MCF-7、MDA-MB231组细胞凋亡率分别为(2.8±0.35)%、(2.6±0.38)%,U0126干预组细胞凋亡率分别为(14.5±2.12)%、(22.7±3.21)%,较未干预组凋亡率分别增加了约4倍和8倍(P<0.01)。
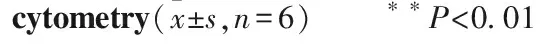
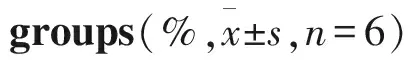
Tab 2 Cell cycle assay in different
*P<0.05,**P<0.01vsMCF-7;#P<0.05,##P<0.01vsMDA-MB231
2.4 U0126可抑制cyclin D1表达Fig 3的Western blot结果显示,U0126(5 μmol·L-1)处理人乳腺癌细胞MCF-7、MDA-MB231 2 h后,可阻断ERK的磷酸化,降低cyclin D1的蛋白表达,与对照组相比,差异具有显著性(P<0.01)。说明U0126通过抑制p-ERK表达,下调cyclin D1,将细胞周期阻断在G0/G1期,抑制乳腺癌细胞的增殖。
2.5 U0126可抑制survivin上调cleaved caspase-3表达如Fig 4所示,U0126(5 μmol·L-1)处理人乳腺癌细胞2 h后,survivin表达明显减少,分别为未处理组的40.1%、26.3%;而cleaved caspase-3的表达明显增高,分别为未处理组的2.58倍、2.76倍,差异有统计学意义(P<0.01)。
3 讨论
乳腺的各级导管及腺上皮均可发生异常增生,导致乳腺癌,腺上皮增生可发展为不典型增生,进一步演变为原位癌、早期浸润癌和浸润性癌,腺上皮细胞的异常增生是乳腺癌发生发展的基础,而癌细胞的增殖受到许多信号通路调控[5]。丝裂原活化蛋白激酶(MAPK)是一条十分重要的信号通路,细胞的生长、发育、分裂、死亡等许多生理过程都受其调控,而胞外信号调节激酶(ERK)是MAPK家族中众多成员中最核心的环节。ERK可以调节细胞的增殖、分化和存活,是多种生长因子(EGF、NGF、PDGF等)的下游蛋白[6]。一方面,ERK能够接受生长因子、丝裂原、环境刺激等信号;另一方面,ERK通过信号级联反应,作用于AP-1、NF-κB等核转录因子,调控基因表达,从而在肿瘤侵袭与转移过程中发挥中介和信号放大的作用。ERK的过度激活在许多人类的癌症,如口腔癌、黑色素瘤、乳腺癌等中均有发现[7]。目前,国内外已大量开展针对ERK途径中各个环节的相关研究,希望能够找到相关抑制物,用以切断信号转导途径,从而达到治疗疾病的目的[8]。
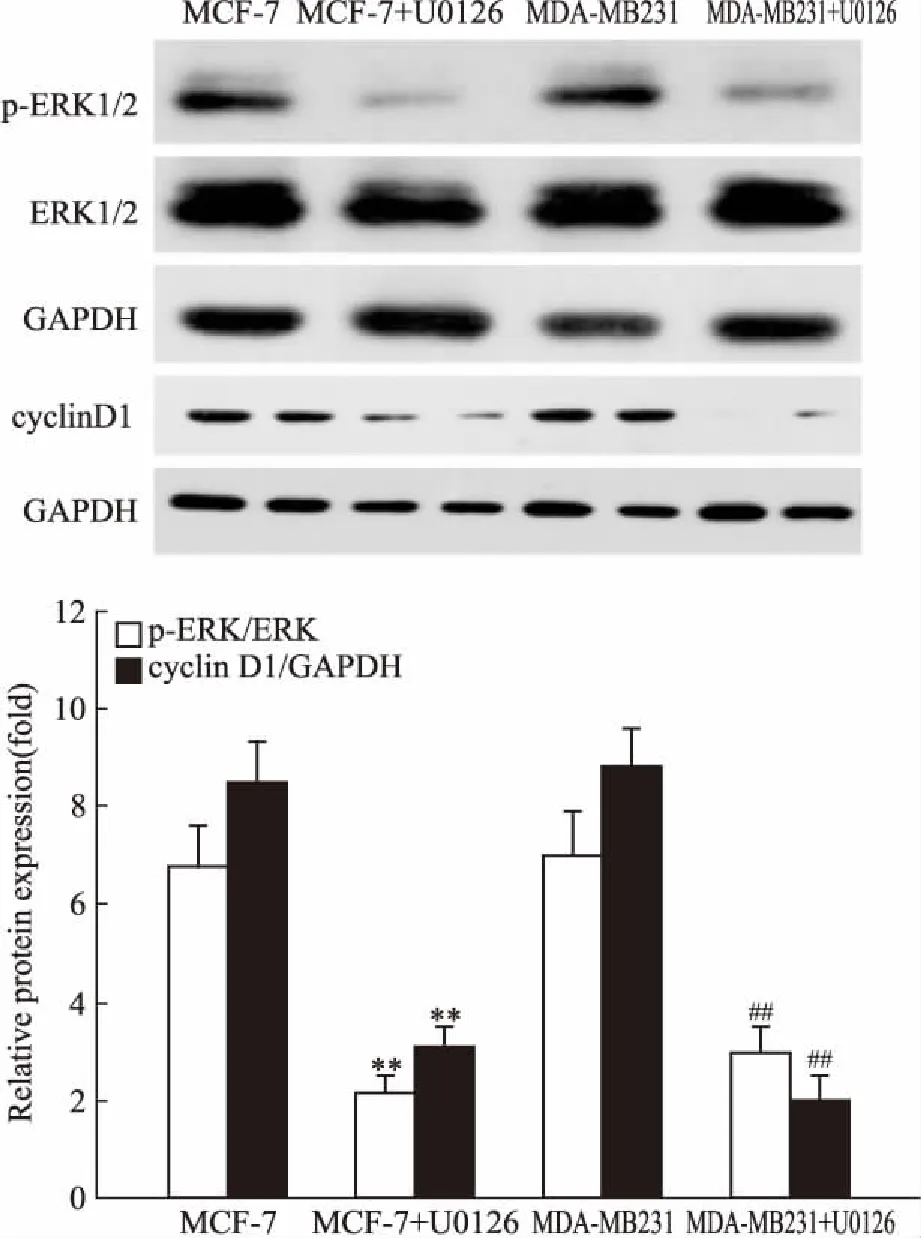
Fig 3 Protein levels of p-ERK and cyclin D1
**P<0.01vsMCF-7;##P<0.01vsMDA-MB231
Fig 4 Protein levels of survivin and cleaved
**P<0.01vsMCF-7;##P<0.01vsMDA-MB231
本实验中,我们首先选用人乳腺癌细胞株MCF-7、MDA-MB231为研究对象,ERK抑制剂U0126处理乳腺癌细胞后,通过MTT法,观察U0126对MCF-7、MDA-MB231增殖的影响。MCF-7和MDA-MB231都是乳腺癌细胞,但是二者侵袭能力不一样,细胞形态差别大,有些基因表达也不同,如SP7基因在MCF-7细胞中不表达,但是在MDA-MB231中高表达。MCF-7为体外培养雌激素受体(estrogen receptor,ER)阳性乳腺癌细胞系,恶性程度较MDA-MB231低,MDA-MB231为ER阴性,增殖速度相对较快,且属于高转移性恶性乳腺癌细胞系。我们选择两种乳腺癌细胞系,主要观察U0126对不同乳腺癌细胞是否均能发挥抑制作用,结果发现,U0126可以明显抑制乳腺癌细胞MCF-7、MDA-MB231的增殖。癌细胞的增殖主要有两方面的因素,一方面是促进细胞进入增殖周期,分裂加速;另一方面是减少细胞凋亡[9]。所以我们接下来分别检测了U0126对MCF-7、MDA-MB231细胞周期及细胞凋亡的影响。结果显示,U0126可以将MCF-7、MDA-MB231的细胞周期阻断在G0/G1期,同时增加早期凋亡细胞的比例。
正调控蛋白cyclin、细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK),以及负调控蛋白CDK抑制因子(CDK inhibitor,CKI)可以对细胞周期的每一个阶段进行调控。cyclin与CDKs通过形成cyclin-CDKs复合物,对细胞周期进行共同控制,使细胞严格按照G1期-S期-G2期-M期的顺序连续进行复制。cyclin D(D1、D2、D3)是细胞由静止G0期进入G1期所必需的,一些生长因子可刺激cyclin D表达水平升高,并与CDK4或CDK6结合进入胞核,激活下游途径,启动细胞DNA复制,促使细胞通过G1/S调控点[10]。Cyclin D1在细胞增殖的G1期发挥作用,正向调控细胞周期,促进DNA的合成及细胞的增殖,从而促进肿瘤的发展[11]。本研究发现,U0126可以将MCF-7、MDA-MB231的细胞周期阻断在G0/G1期,所以接下来我们检测了cyclin D1,发现U0126可以明显减少cyclin D1的表达量,说明U0126通过调控cyclin D1将细胞周期阻断在G0/G1期,进而抑制乳腺癌细胞的增殖。
细胞凋亡作为一种由基因控制的程序性死亡,可以维持内环境的稳定,这些基因在种属之间的保守性非常高,如caspase家族、Bcl-2家族、抑癌基因p53、癌基因c-Myc等。Survivin是凋亡抑制蛋白家族的新成员,是一种只表达于肿瘤和胚胎组织的蛋白,涉及肿瘤细胞的分化增殖及浸润转移[12]。17q25染色体的BIRC5基因编码survivin蛋白,其仅含有单一的抗凋亡活性必不可少的杆状病毒凋亡抑制蛋白重复序列(BIR)功能区、1个C末端卷曲螺旋结构,通常以二聚体的形式存在[13]。在细胞增殖过程中,高表达survivin的细胞可越过G2/M,直接完成异常有丝分裂,造成细胞周期缩短,导致肿瘤增殖速度加快。同时p53、Fas等细胞凋亡因子也可被高表达的survivin抑制,导致细胞的凋亡减少,促进肿瘤的无限增殖[14]。也有研究表明,survivin具有诱导新生毛细血管形成的作用,从而为肿瘤的无限增殖创造了良好的营养环境[15]。Survivin抑制细胞凋亡的机制有以下两种可能:① 对凋亡终末效应酶caspase-3和caspase-7的活性进行直接抑制,从而阻断各种刺激诱导的细胞凋亡过程; ② 通过survivin与周期蛋白激酶CDK4、CDK2之间的相互作用,阻断凋亡信号转导通路[16]。U0126可以增加MCF-7、MDA-MB231早期凋亡细胞的比例,通过检测survivin、cleaved caspase-3的蛋白表达,我们发现U0126可以明显抑制survivin表达,而增加cleaved caspase-3表达量,说明U0126通过调控survivin表达而增加细胞凋亡,从而抑制乳腺癌细胞的增殖。
综上所述,本研究证实MCF-7、MDA-MB231细胞中ERK信号通路被异常激活,U0126通过阻断ERK信号通路调控cyclin D1,将细胞周期阻断在G0/G1期,抑制survivin蛋白表达,而增加cleaved caspase-3表达量,促进细胞凋亡,从而抑制乳腺癌细胞MCF-7、MDA-MB231的增殖。这一结果为使用信号通路阻断剂治疗乳腺癌提供了重要的实验依据。