大鼠paralemmin-3基因重组慢病毒载体构建及其在肺泡巨噬细胞中的表达
唐俭,陈旭昕,樊重阳,韩志海,△
肺泡巨噬细胞是体内重要的吞噬和抗原提呈细胞,其作为固有免疫系统中的“第一道防线”参与了多种肺部疾病包括急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发病过程[1-2]。目前依据极化状态的不同,巨噬细胞可分为M1和M2两个亚群,调控巨噬细胞极化方向是治疗ARDS等多种炎症失控疾病的潜在策略[3]。Paralemmin-3(PALM3)属于Paralemmin蛋白家族,本课题组前期研究表明,下调PALM3的表达可以抑制脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞炎性反应[4],但上调PALM3的表达对巨噬细胞极化方向是否存在影响尚少见报道。因此,本研究拟通过以慢病毒为介导,构建含大鼠PALM3基因的重组慢病毒载体,并测定PALM3在肺泡巨噬细胞中的表达情况,以期为后续实验奠定基础。
1 材料与方法
1.1 材料 大肠杆菌感受态细胞(DH5α)及293T细胞由武汉普诺赛生命科技有限公司提供;大鼠肺泡巨噬细胞(NR8383)购自美国模式培养物集存库;pCV186载体及慢病毒空载体pCV186-Cherry购自上海吉凯基因化学技术有限公司;DMEM培养基、Ham’s F12培养基和胎牛血清均为GIBCO公司产品。Lipofectamine 2000脂质体转染试剂盒及Trizol购自Invitrogen公司;质粒抽提试剂盒胶购自Qiagen公司;DNA回收、纯化试剂盒、聚合酶链反应技术(PCR)试剂、DNA连接试剂盒、BamHⅠ和AgeⅠ限制性内切酶购自TaKaRa公司;抗鼠PALM3多克隆抗体购自Sigma公司;抗GAPDH及二抗购自Santa Cruz公司;蛋白定量和细胞蛋白提取试剂盒购自江苏碧云天公司;ECL-PLUS发光试剂盒及蛋白Marker均购自Thermo Fisher公司。
1.2 方法
1.2.1 细胞培养 293T细胞所用培养液为含10%胎牛血清的DMEM培养基,置于37℃、5%CO2及95%湿度培养箱中培养,每隔1 d换液1次,2~3 d传代1次。NR8383细胞所用培养液为含10%胎牛血清的Ham’s F12培养基,置于37℃、5%CO2恒温培养箱中培养,每隔2 d换液1次,3~4 d传代1次,实验所用细胞均处于对数生长期。
1.2.2 鼠PALM3基因扩增 在GenBank中查阅大鼠PALM3的mRNA序列(XM-002728582),采用premier 5.0设计特异性引物,上游引物:5′-AGGTCGACTCTAGAGGATCCCGCCACCATGGCTCTGCAGACCCCGGTG-3′;下游引物5′-TCCTTGTAGTCCATACCGGTCATGACCACACAACACTGGCACG-3′,BamHⅠ酶切位点为GGATCC,AgeⅠ的酶切位点为ACCGGT。引物的设计和合成由上海吉凯基因化学技术有限公司完成。反应条件如下:依次98℃5 min;98℃10 s,55℃10 s,72℃90 s,以上循环30次,取10µL PCR产物进行1%琼脂糖凝胶电泳分析。
1.2.3 重组质粒pCV186-cherry-PALM3的构建与鉴定 用BamHⅠ和AgeⅠ酶切质粒pCV186-cherry及鼠PALM3基因扩增产物,酶切产物纯化后,用DNA连接酶连接线性化的pCV186-cherry及rat-PALM3基因片段,转化至DH5α,在含有氨苄青霉素抗性的LB琼脂培养平板上培养过夜,挑选单克隆扩大培养,行PCR鉴定,PCR反应的上游引物:5′-AAAAGCTTGGGGCAGAGCTG-3′;下 游 引 物 :5′-CCTTATAGTCCTTATCATCGTC-3′。此引物由上海吉凯基因化学技术有限公司合成,反应条件如下:94℃3 min;94℃30 s,55℃ 30 s,72℃ 90 s,共22次循环。取10µL PCR产物进行1%琼脂糖凝胶电泳分析,对PCR鉴定正确的阳性克隆小提质粒并送检测序。
1.2.4 重组慢病毒lenti-CV186-Cherry-PALM3的包装与滴度测定 采用Qiagen公司的质粒抽提试剂盒对重组质粒及辅助包装质粒pHelper 1.0和pHelper 2.0进行高纯度无内毒素抽提,按Lipofectamine 2000脂质体说明书将重组质粒及辅助包装质粒pHelper 1.0和pHelper 2.0共转染293T细胞,转染8 h后更换为完全培养基继续培养48 h,收集细胞培养上清液,4℃,4 000 r/min离心10 min,随后将上清液过滤到40 mL超速离心管中,25 000 r/min、4℃离心2 h,此时收集到的即为病毒浓缩液,病毒液保存于-70℃冰箱中备用。将293T细胞以5×104个/孔接种于96孔板中,37 ℃、5%CO2培养箱内培养过夜。分别加入逐孔稀释的病毒液(1×10-1~1×10-6),12 h后去除含慢病毒的培养基,换为新鲜完全培养基继续培养48 h,然后采用荧光标记法在荧光倒置相差显微镜下观察并计算各孔中表达荧光的细胞数。
1.2.5 最佳感染复数(multiple of infection,MOI)筛选 将对数生长期的NR8383细胞制成细胞悬液,以1×105/孔的密度接种到96孔板中,当细胞融合度达80%时,以不同MOI值(0、1、10、20、50)的重组慢病毒lenti-CV186-Cherry-PALM3感染细胞,转染方法同1.2.4。根据以下公式计算转染效率:转染效率=Cherry阳性细胞数/总细胞数×100%。转染效率90%以上的最低MOI值为最佳MOI值。
1.2.6 Western blot检测慢病毒感染NR8383细胞内PALM3的表达 同1.2.5接种NR8383细胞到6孔板中,接种密度为1×106/孔,分为以下3组:空载体组、空白对照组及慢病毒lenti-CV186-Cherry-PALM3感染组(MOI=20),同1.2.4转染NR8383细胞。转染48 h后用蛋白提取试剂盒提取细胞的总蛋白,测定蛋白浓度后,以GAPDH为内参,取20µg样品依次行SDS-PAGE电泳、电转至PVDF膜,经过脱脂牛奶封闭后,依次加入山羊抗大鼠PALM3多克隆抗体(1∶500)、辣根过氧化物酶标记的兔抗山羊二抗(1∶2 500),ECL发光液中显色。放入GBOX-HR凝胶成像分析系统中进行摄像分析。以GAPDH作为内参照,以PALM3的灰度值/GAPDH的灰度值代表PALM3蛋白的相对表达水平。
1.3 统计学方法 采用SPSS 16.0统计软件进行分析。所有数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 目的基因PALM3的扩增 PCR扩增PALM3基因片段,预期条带大小为2 246 bp,经1%琼脂糖凝胶电泳后,扩增出的条带位于2 000~3 000 bp之间,片段大小与预期结果一致,见图1。
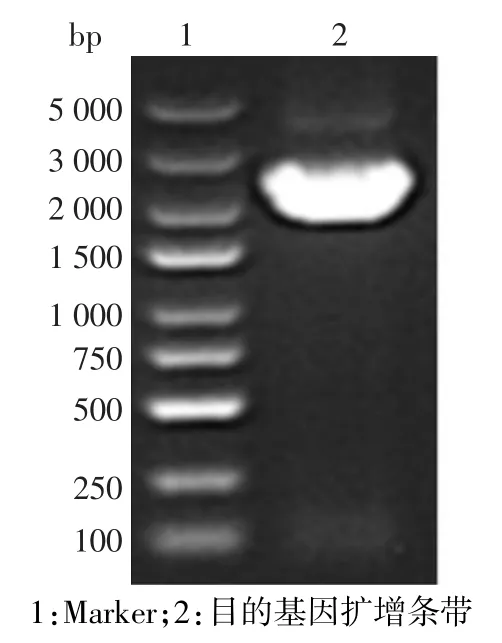
Fig.1 Electrophoresis of PALM3 gene segment by PCR amplification图1 PCR扩增PALM3基因片段电泳结果
2.2 重组载体pCV186-Cherry-PALM3的PCR鉴定 重组质粒pCV186-Cherry-PALM3的阳性克隆PCR产物大小为1 045 bp,设立内参GAPDH片段作为阳性对照,其对应的产物大小为1 000 bp,同时设立ddH2O作为空白对照、空载体作为阴性对照,见图2。
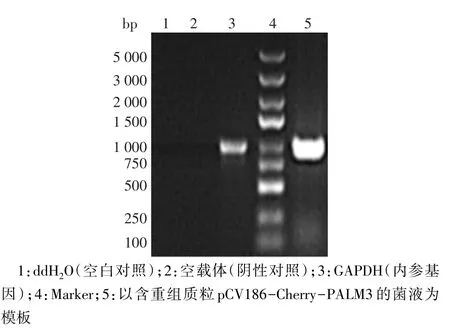
Fig.2 Electrophoresis identification of recombinant plasmid vector pCV186-Cherry-PALM3 by PCR图2 重组质粒pCV186-Cherry-PALM3的PCR电泳鉴定
2.3 重组载体pCV186-Cherry-PALM3的测序鉴定 挑选经PCR鉴定成功的阳性克隆送检测序,测序结果证实rat-PALM3基因序列正确,无突变或缺失,与GenBank信息库中rat-PALM3基因mRNA一致,表明重组质粒pCV186-Cherry-PALM3已成功构建,见图3。
2.4 慢病毒颗粒包装及滴度测定 重组质粒pCV186-Cherry-PALM3、辅助质粒(pHelper 1.0、pHelper 2.0)共转染293T细胞,转染48 h后在荧光显微镜下可观察到特异性红色荧光,见图4,证明此重组慢病毒包装成功。转染293T细胞后,重组慢病毒lenti-CV186-Cherry-PALM3感染滴度为3×108TU/mL。
2.5 转染NR8383细胞最佳MOI筛选及转染效率测定 转染48 h后,肺泡巨噬细胞NR8383开始出现少量红色荧光,随着转染时间延长,各组荧光强度逐渐增强,96 h后达到稳态,见图5。MOI值为0、1、10、20、50时,转染效率分别为 0、(11.33±1.86)%、(40.0±2.89)%、(92.33±1.45)%、(80.33±2.60)%,差异有统计学意义(n=3,F=387.600,P<0.05),最佳MOI值为20。
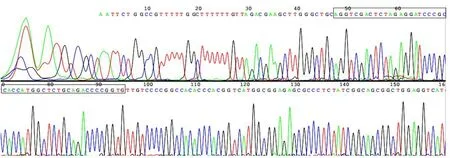
Fig.3 DNA sequencing analysis of recombinant plasmid vector pCV186-Cherry-PALM3图3 重组质粒pCV186-Cherry-PALM3的测序结果
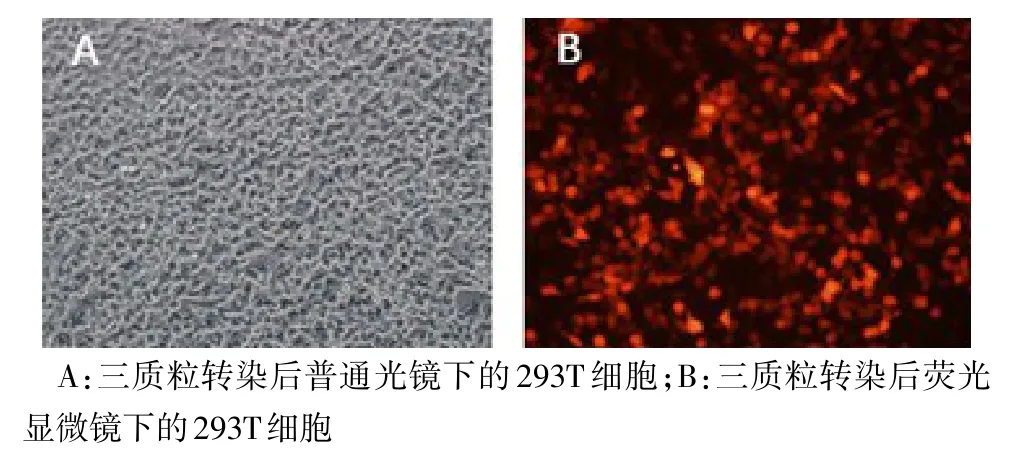
Fig.4 The morphology of 293T cells at 48 h after plasmid transfection under phase contrast and fluorescence microscopy(×200)图4 三质粒共转染48 h后293T细胞在普通光学显微镜及荧光显微镜下的观察(×200)
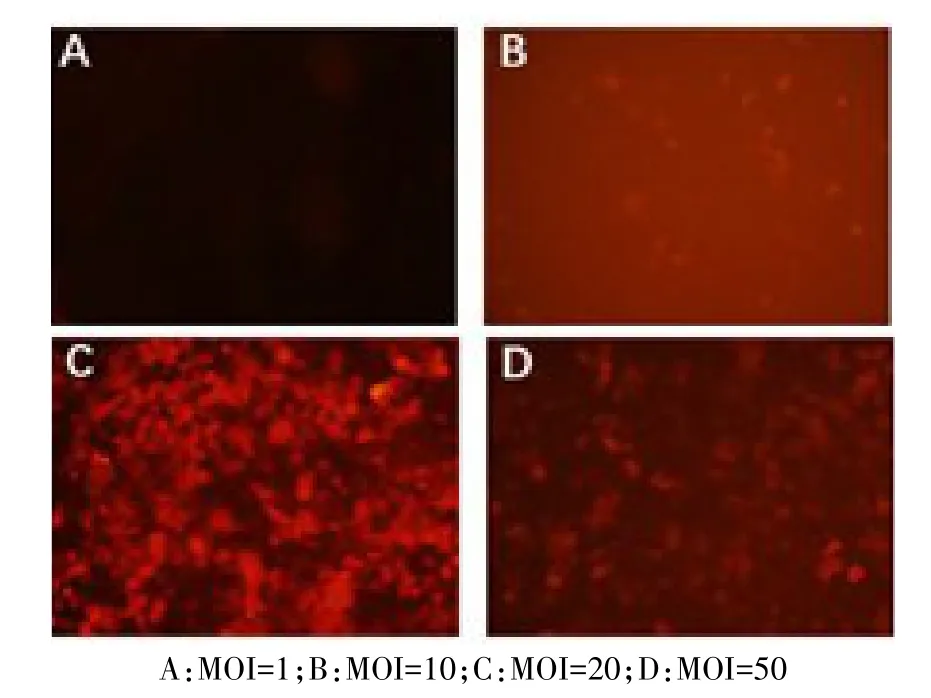
Fig.5 The fluorescence expression in NR8383 cells after transfection with lenti-CV186-Cherry-PALM3(×200)图5 重组慢病毒lenti-CV186-Cherry-PALM3转染NR8383细胞96 h后荧光表达情况(×200)
2.6 Western blot检测PALM3蛋白表达情况 重组慢病毒lenti-CV186-Cherry-PALM3按MOI=20转染NR8383细胞96 h后,lenti-CV186-Cherry-PALM3转染组PALM3蛋白表达较空白对照组和空载体组显著增强,差异有统计学意义(n=3,F=43.670,P<0.05);而空载体组与空白对照组PALM3蛋白表达差异无统计学意义(P>0.05),见图6。
3 讨论
成熟的巨噬细胞在各种因素下出现表型及形态分化,即巨噬细胞的极化现象[5]。极化后的巨噬细胞亚型可以细致调节及回应各种不同的刺激,在机体宿主防御、免疫应答、维持内环境稳定中扮演着重要角色[6]。巨噬细胞极化的机制是刺激信号通过膜受体启动胞内信号转导通路,通过激活转录因子启动不同基因表达以实现表型特征。巨噬细胞极化受多种信号分子调控,目前比较明确具有调节巨噬细胞极化作用的转录因子包括:核因子-κB、转录激活蛋白1、信号转导子和转录激动子、细胞因子信号抑制因子及过氧化物酶体增殖物激活受体等[7]。
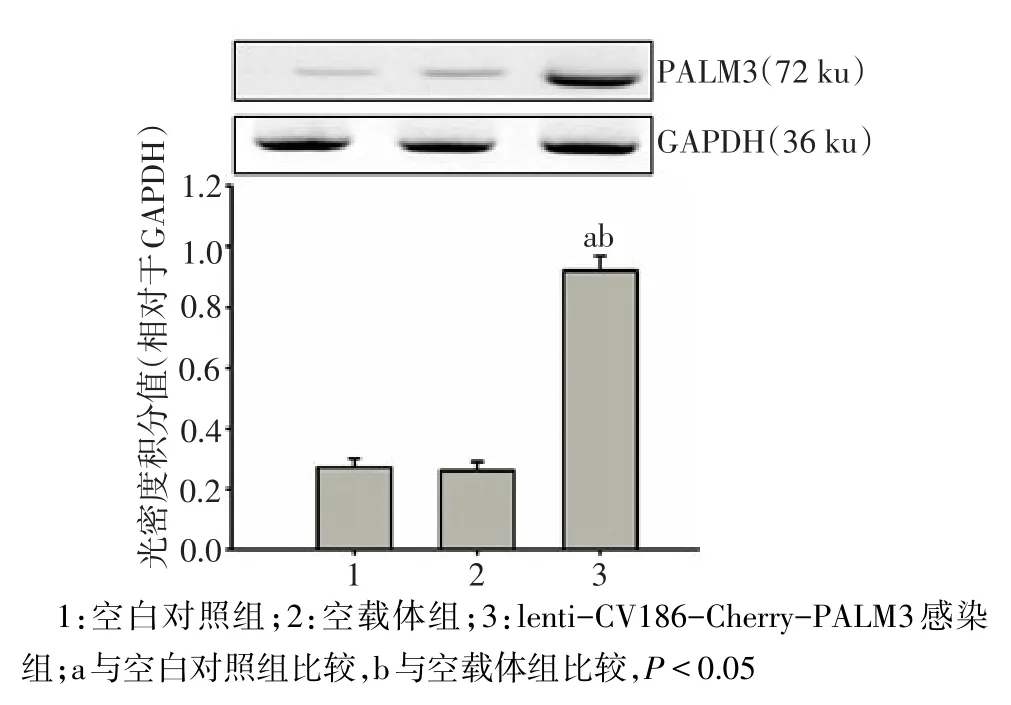
Fig.6 Western blot analysis of PALM3 protein expression in NR8383 cells图6 NR8383细胞中PALM3 Western blot分析
PALM3是一种异戊二烯/棕榈酰锚定的磷蛋白。最早于1992年为Cornish等[8]在非洲爪蛙中被发现,并将其称为Xlgv7/Xlcaax-1。PALM3主要参与细胞膜动力学、细胞的运动性、细胞形状控制及肿瘤淋巴管形成等[9]。前期研究发现,PALM3在肺泡上皮中参与了脂多糖(LPS)诱导的炎症反应,下调PALM3的表达可以减轻LPS诱导的炎症反应及改善内毒素性急性肺损伤的程度[10-11]。本课题组近期研究发现,PALM3在肺泡巨噬细胞NR8383中有表达,下调PALM3的表达同样能抑制LPS诱导的炎症反应,而且下调PALM3后可抑制NR8383细胞中Toll样受体/白细胞介素-1受体信号(Toll like receptor/Interleukin-1 receptor,TIR)通路中复合物的形成[4]。这些结果提示PALM3可能作为“接头”分子,参与TIR信号的转导,而TIR信号通路又参与了巨噬细胞的极化,因此笔者推测PALM3除了在巨噬细胞中参与调控LPS诱导的炎症以外,可能还参与了巨噬细胞极化的调控。调控巨噬细胞中PALM3的表达水平可能影响巨噬细胞极化的方向,从而改善炎症和免疫相关疾病的预后。
慢病毒是逆转录病毒的一个亚类,其优势是具有同时感染分裂细胞与非分裂细胞的独特能力,而其他逆转录病毒仅可感染分裂细胞[12]。对于原代细胞、干细胞等一些较难转染的细胞,应用慢病毒载体可以大大提高靶基因转导效率,使目的基因整合到宿主细胞基因组中的可能性大大增加,能够较方便快捷地实现目的基因长期、稳定表达[13]。本研究采用三质粒表达系统,包括2个辅助包装质粒和1个表达质粒,3个质粒共转染1个细胞系,使序列重叠的机会减少,减少载体重组过程中产生有复制能力病毒的可能性[14]。表达质粒主要表达目的基因、报告基因及目的基因启动子等,而辅助包装质粒表达病毒包装所需的结构蛋白。表达载体和包装质粒载体互补,共转染包装293T细胞后成功制备出重组慢病毒lenti-CV186-Cherry-PALM3,采用荧光标记法测定病毒滴度为3×108TU/mL。转染巨噬细胞后可以观察到报告基因Cherry表达,最佳MOI为20。后期经Western blot法检测目的基因PALM3表达,证实制备的重组慢病毒lenti-CV186-Cherry-PALM3对肺泡巨噬细胞系NR8383细胞具有较高的感染效率。
综上所述,本研究利用基因工程技术成功构建了含鼠PALM3基因的重组慢病毒载体lenti-CV186-Cherry-PALM3,其滴度为 3×108TU/mL,感染NR8383细胞的最佳MOI值为20。该重组慢病毒载体不仅能够在真核细胞中实现PALM3的过表达,还可利用标签Cherry实现目的基因的示踪定位,为下一步研究PALM3对肺泡巨噬细胞极化的影响奠定了前期基础。
——一道江苏高考题的奥秘解读和拓展

