维生素预混料中生物素含量的试剂盒法验证
陈敏儿,黄启红,熊 娟,伍玲燕,黄璇莹,张云龙
(广东省测试分析研究所,广东 广州 51000)
1 原理
生物素是植物乳杆菌Lactobacillus plantarum 生长所必需的营养素,将样品提取液和生物素检测培养基加入包被有Lactobacillus plantarum 的微孔中,Lactobacillus plantarum 的生长与样品生物素的含量呈线性关系。添加生物素作为标准或者作为样品混合物,乳杆菌会一直生长直至生物素被消耗殆尽。培养一段时间后测定吸光度,根据生物素含量与吸光度的标准曲线计算出样品中生物素的含量。
2 测定方法
2.1 试剂和材料
微生物法定量检测生物素试剂盒(VitaFast)
氢氧化钠(广州化学试剂厂)
生物素标准品(中国药品生物制品检定所)
一次性无菌注射器(江南)
0.22μm无菌过滤器(Sartorius stedim)
2.2 仪器和设备
HWS26型电热恒温水浴锅(上海一恒)
BHC-1300ⅡA/B2生物洁净安全柜(苏州净化)
1900培养箱(BioCELL)
MK3酶标检测仪(Thermo)
JJ200B电子天平(G&G)
2.3 供试品溶液的制备:
称取1.000g维生素预混料到1000mL容量瓶中,加入约400mL蒸馏水,摇匀。用NaOH调整pH值到8.0±0.2。95℃水浴提取30分钟,其间振荡至少5次,迅速冷却到30℃以下。用无菌蒸馏水准确定容至刻度。取1mL溶液至一个50mL无菌离心管中,加无菌蒸馏水至40mL,然后摇匀。无菌过滤,根据浓度范围,在1.5mL(或2.0mL)无菌试管中进一步稀释。
2.4 培养基的制备
取出试剂盒中的培养基,打开瓶盖用镊子取出干燥剂,加入10mL无菌水(取自试剂盒)至生物素培养基瓶中。盖好培养基瓶,摇匀。水浴加热该瓶至95℃保持5min分钟,其间振荡至少2次,并确保瓶子封闭。迅速冷却至室温(30℃以下)。使用0.2μm无菌滤膜过滤培养基至无菌离心管中。
2.5 标准品溶液的的制备
打开试剂盒中的生物素标准品瓶,添加X mL(X=详见标准品瓶)无菌水(取自试剂盒)至标准品瓶中。盖上标准品瓶盖,摇匀稀释=标准品浓缩液。取6个无菌管(1.5~2.0mL),并按照下列表格准备标准品溶液:
*样品提取稀释倍数1∶40已经包含在标准曲线中。

表1 标准曲线溶液制备
2.6 测定法
微孔板实验中必须使用无菌水稀释的无菌样品,无菌水取自试剂盒。
移液器先移取培养基,之后标准品或稀释的样品,如下:
-移取150μL生物素培养基至微孔中。
-移取150μL标准品或稀释的样品至指定的微孔中(用标准品或样品溶液冲洗移液器尖)。
-用粘合箔盖住板条或微孔:除去粘合箔上的保护层,将其平放在微孔条上,用手将粘合箔平压,使其充分封闭微孔板条。注意保证粘合箔和微孔的封闭性,特别注意微孔的边缘部分。
-在37℃黑暗条件下孵育44~48h。
测量:
-再次压紧粘合箔,将微孔板翻置在桌面上,在桌面平面上振荡,使微生物溶解在培养基中。
-将微孔板翻回如前置于桌面上,从右上角开始以对角线方向180°角轻扯下粘合箔,与此同时务必用另一只手按住放置在桌面上的微孔板,以防止因粘合箔与微孔板粘合过紧而在撕扯时带起微孔板。
-破坏微孔中液体表面的所有泡沫(可以用移液管尖或针状物)。
-用酶标仪610~630nm(或540~550nm)条件下读取吸光度。
计算:
在计算结果时使用拜发公司提供的配套的RIDA?SOFTWin软件。
判定检测结果有效:
-OD空白值 -OD标准5>0.6 OD 样品稀释倍数40已经包括在标准曲线中(详见质量保证书)。在下面的公式中,只需要考虑提取的进一步稀释倍数及不同的样品重量。 生物素(μg / 100g)= 空白溶液的制备:不加样品,依2.3所述处理得相应的生物素空白溶液; 阴性样品溶液:选取不含添加生物素的样品,依2.3制备的阴性样品溶液; 供试品溶液:依2.3制备; 测定:按2.6所述测定法测定空白溶液和样品溶液的吸光度。 所得结果如下: 表2 专属性试验结果 依2.5配制浓度为0.08μg/100mL,0.24μg/100mL,0.40μg/100mL,0.56μg/100mL,0.72μg/100mL的生物素标准品溶液,按2.6所述在630nm波长处测定,所得浓度与吸光度关系如下: 表3 线性试验标准曲线 3.3.1 重复性 依2.3的方法平行制备6份供试品溶液,分别测定供试品溶液中生物素的浓度,以所得的样品中生物素的浓度来计算RSD %。 所得结果如下: 表4 重复性试验结果 3.3.2 中间精密度 连续3日,每日分取同一批号的样品,由不同检测员按2所述方法测定生物素,以测得的样品中生物素的结果来计算相应的RSD。 表5 中间精密度试验结果 取已知生物素含量的样品1.000g,置离心管中,共取9份,3份为一组,分为A、B、C三组。各组对照品加入量与样品生物量之比分别约为0.8∶1,1∶1,1.2∶1。 A组:3份样品均同法处理,方法为:于样品中加入53.0μg生物素对照品(配制浓度为100μg/mL的生物素对照品溶液,加入此溶液0.530mL),摇匀,依2.3处理,作为供试品溶液A。按2.6所述测定,计算回收率和RSD。 B组:3份样品均同法处理,方法为:于样品中加入66.0μg生物素对照品(配制浓度为100μg/mL的生物素对照品溶液,加入此溶液0.660mL),摇匀,依2.3处理,作为供试品溶液B。按2.6所述测定,计算回收率和RSD。 C组:3份样品均同法处理,方法为:于样品中加入79.0μg生物素对照品(配制浓度为100μg/mL的生物素对照品溶液,加入此溶液0.790mL),摇匀,依2.3处理,作为供试品溶液C。按2.6所述测定,计算回收率和RSD。 所得结果如下: 表6 准确度试验结果 备注:测得加入生物素的质量(μg)=测得总的生物素的质量(μg)-1.000g样品生物素的质量(μg) 取同一样品溶液,分别于0、1、2、3、5、8小时时测定,测得生物素含量(mg/100g),计算RSD。 表7 耐用性试验结果 本文选取维生素预混料为样品,参照《中国药典》2015版四部通则9101药品质量标准分析方法验证指导原则,对生物素微生物试剂盒法进行方法学验证,验证实验中线性和专属性试验测试结果良好,重复性相对标准偏差(RSD)为2.57%,中间精密度RSD为1.73%,准确度试验中回收率在95%~110%之间,RSD分别达4.37%、4.99%、2.51%,耐用性RSD为2.13%,均符合指导原则中的要求(RSD≤6%,回收率在80%~115%之间)。结果表明,生物素试剂盒法准确,可靠,适合于该维生素预混料中生物素的检测要求。与生物素传统微生物法相比,生物素试剂盒法方便快捷,无需活化菌种及传代,省时省力,亦减少污染概率,更适合厂家用于监控产品质控。3 方法验证
3.1 专属性
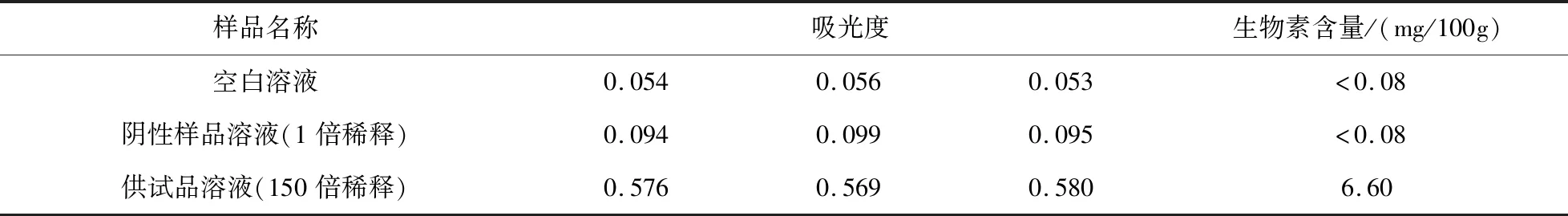
3.2 线性
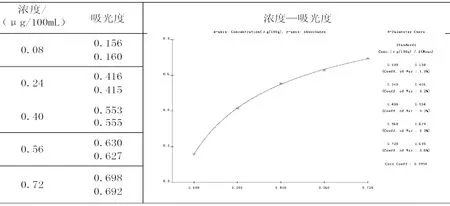
3.3 精密度


3.4 准确度
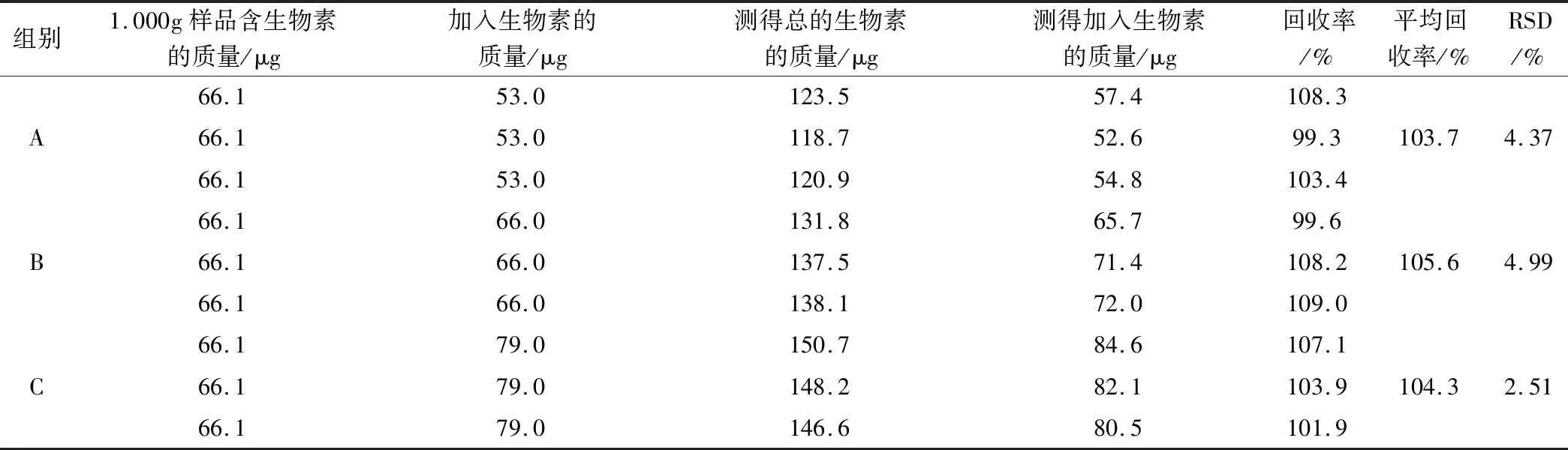
回收率(%)=测得加入生物素的质量(μg)÷加入生物素的质量(μg)×100%3.5 耐用性

4 结论

