钼对桃树叶片低温伤害的缓解作用
郜怀峰,彭福田,肖元松,张亚飞,王国栋,孙希武,贺 月
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,山东泰安 271018)
低温作为一种非常重要的非生物胁迫因子,能够影响农作物的生长、产量和地域分布等[1]。钼是高等植物正常生长发育和生理代谢的必需微量元素之一,研究表明,钼可以影响小麦等植物的生理代谢过程[2-3],提高植物抗逆性。近年来,由于气候变化异常,极端天气时有发生。倒春寒使桃树在生长期遭遇0℃以下低温而使细胞组织受伤害,是一种生理病害,会对桃树枝梢幼叶造成很大伤害,影响叶片正常的生长发育和生理功能,造成巨大的经济损失,如何降低低温伤害是影响桃树生产的重要因素。目前,对桃树低温冷害的研究只停留在田间自然条件下的低温对果实外形及产量的影响方面[4],对其生理生化指标的研究鲜见报道。因此,加强钼对桃树低温胁迫伤害的缓解效果及机制研究显得尤为重要。
钼能通过含钼酶调控植物体内的碳代谢、氮代谢、激素代谢和活性氧代谢等多种生理过程,与植物的抗非生物胁迫如低温[5]、干旱[6]、盐害[7]等密切相关。钼不仅能够通过含钼酶调控ABA和IAA的合成,还能调节钼酶活性[8]、抗氧化酶活性[9]及渗透调节物质含量[10]从而影响植物的抗性。它还对维持叶绿素结构必不可少,缺钼会使植物叶绿素含量明显减少,结构异常,导致叶片发黄,光合速率降低。钼单独存在于生物体时并不能发挥作用,只有形成钼辅因子 (molybdenum cofactor,Moco) 结合到钼酶上才具有生物活性[11-13]。在拟南芥中LOS5/ABA3是编码钼辅因子硫化酶的基因,该酶催化Moco硫酸化形式的产生,它是植物中ABA生物合成途径最后一步起关键作用的醛氧化酶 (AO) 所必需的辅助因子[14]。由于AO家族具有广泛的底物特异性,推测AO不仅调控激素合成,还参与除植物激素合成外的其他代谢活动,研究表明,植物体内AO不仅可以催化H2O2产生,还能催化的产生,从而影响植物活性氧代谢[15]。
前人研究表明,缺钼条件下施钼能提高小麦[8]、早熟禾[16]、草坪[17]等植物的抗冻性。低温胁迫下,施钼提高了小麦和草坪草海滨雀稗超氧化物歧化酶(SOD)、过氧化物酶 (POD)、过氧化氢酶 (CAT) 活性,增加了小麦抗坏血酸 (ASA)、还原型谷胱甘肽(GSH)、类胡萝卜素 (CAR) 含量,降低了活性氧自由基的含量[8,17-18],提高了植物清除活性氧的能力,减小了活性氧对细胞的伤害。施钼能够增加冬小麦可溶性蛋白质、可溶性糖、脯氨酸含量,且脯氨酸比可溶性蛋白和可溶性糖能更早、更敏感、更显著地响应低温胁迫[3]。但钼能否提高桃树抗冻性、缓解低温胁迫造成的伤害,至今未见报道。为此,本试验以毛桃实生苗为试材,研究低温胁迫下,钼酸铵对桃叶片细胞膜氧化伤害、渗透调节物质及抗冻相关基因钼辅因子硫化酶、脯氨酸合成酶及过氧化物酶表达的影响,明确钼对桃树低温胁迫伤害的缓解效果及机制,以期为生产中缓解桃树低温胁迫伤害提供理论参考。
1 材料与方法
1.1 试验材料与设计
试验以当年生毛桃 (Amygdalus persicaL.) 实生苗为试材,于2017年在山东农业大学南校区试验站进行。
选取长势一致、无病虫害的20片叶毛桃实生苗定植于盆中,每盆定植1株,盆为圆柱形,内径10 cm、高8 cm,盆内栽培基质为营养土和蛭石,按1∶1比例混合,基质基本理化性状为pH 6.81、有机质37.64 g/kg、速效氮162.34 mg/kg、速效磷123.73 mg/kg、速效钾140.36 mg/kg,土壤钼含量为0.43 mg/kg (低于土壤平均水平1.7 mg/kg),有效钼含量为0.104 mg/kg (处于临界水平,低于0.1 mg/kg为缺钼水平),每盆基质重量为1.5 kg。试验设5个处理为:清水 (M0);0.01%钼酸铵 (M1);0.04%钼酸铵(M2);0.08%钼酸铵 (M3);0.12%钼酸铵 (M4)。每个处理设9个重复。每隔5天喷施一次,每次喷50 mL,一共喷3次。第3次后,将实生苗置于冷光源植物生长箱 (0℃,5000 lx,12 h光照) 中进行低温胁迫处理,于0 h、12 h、24 h、48 h测定其电导率,48 h后测定叶片钼含量、冻害指数、相对电导率、SPAD值、净光合速率、脯氨酸、可溶性糖等,选取最佳喷施钼酸铵浓度。
为进一步研究钼酸铵对桃实生苗低温胁迫的缓解作用及其机制,根据上一试验分析结果,研究0.04%钼酸铵对桃低温胁迫下,叶片可溶性糖、脯氨酸及抗氧化酶活性及丙二醛含量的影响。选取另一批长势一致、无病虫害的20片叶毛桃实生苗进行试验,试验设计为:清水 + 常温 (CK);清水 + 0℃ (T1);0.04%钼酸铵 + 常温 (T2);0.04%钼酸铵 + 0℃(T3)。各处理选9株长势基本一致的实生苗,每隔5天喷施一次,每次50 mL,一共喷施3次。第3次处理后,将T1、T3置于冷光源植物生长箱 (0℃,5000 lx,12 h光照) 中,CK、T2置于冷光源植物生长箱 (20℃,5000 lx,12 h光照),分别于0 h、24 h、48 h取相同叶位功能叶片测定可溶性糖、脯氨酸、抗氧化酶活性和丙二醛含量,部分样品液氮速冻,-80℃保存,测定LOS5/ABA3、P5CS1及RCI3表达量。
1.2 指标测定
1.2.1 桃实生苗叶片钼含量测定 参照Wang等[19]方法进行,称取桃实生苗叶片干样0.3 g于消解管中,加入5 mL优级纯浓硝酸浸泡过夜后,再加入2 mL优级纯双氧水,采用微波消解萃取仪进行消解,消解完全冷却后转移至比色管中,用超纯水定容至50 mL,放置过夜即可得样品待测液。采用相同消解方法制备空白对照组,用Nex ION 300X型电感耦合等离子体质谱仪测定钼含量。每处理3个重复,结果取其平均值 (下同)。
1.2.2 冻害指数 低温胁迫后,统计叶片的伤害情况。只要叶片上出现萎蔫、水渍状、失绿等症状,均认为发生冻害。统计该植株发生冻害的叶片数以及植株总叶片数。
冻害指数 (%) = 植株上表现出冻害症状的叶片数/植株叶片总数 × 100。
1.2.3 电导率 相对电导率按照李合生[20]的方法进行。鲜样先用自来水冲洗,再用蒸馏水冲洗2次,避开主脉将叶片切割成大小一致的叶块,混合均匀,取0.5 g,装入大试管中,加入20 mL蒸馏水,抽气3次,每次20 min,第一次抽气后取出摇动,室温保持3~4 h,多次摇动,测电导率S1,封口沸水浴10 min,冷却,平衡10 min后测电导率S2,同时测定蒸馏水电导率S0。
相对电导率 (%) = 100 × (S1 - S0)/(S2 - S0)。
1.2.4 叶绿素SPAD值、净光合速率 在冷光源植物生长箱内利用CIRAS-3便携式光合仪测定系统(PPSystems,英国) 测定充分展开的功能叶片净光合速率,重复6次,取其平均值。SPAD值用SPAD-502型仪器测定,重复6次,取其平均值。
1.2.5 脯氨酸 脯氨酸含量测定采用茚三酮比色法[21]。称取鲜样0.5 g,加入5 mL磺基水杨酸,封口沸水浴10 min,冷却,用滤纸漏斗过滤,吸滤液2 mL(对照吸蒸馏水2 mL),加入2 mL冰乙酸,再加入3 mL酸性水合茚三酮显色液,沸水浴40 min,冷却,加入5 mL甲苯,充分震荡,静置分层,取上层甲苯液于520 nm下比色。计算公式:脯氨酸 (μg/g,FW或DW) = Y × V/a × W (Y由标准曲线查得,V为提取液体积,a为测定时吸取的体积,W为样品重)。
1.2.6 可溶性糖 可溶性糖采用蒽酮比色法测定。叶片擦净,剪碎,称取0.3 g,放入刻度试管,加10 mL蒸馏水,封口,于沸水中提取30 min (提取两次),提取液过滤入25 mL容量瓶中,反复冲洗试管及残渣,定容至刻度。吸取0.5 mL样品液于20 mL试管中,加入蒸馏水1.5 mL,然后按顺序向试管中加入0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分震荡,立即将试管放入沸水中,逐管准确保温1 min,取出自然冷却至室温,以空白做参比,在630 nm下比色。
1.2.7 过氧化氢酶 (CAT)、丙二醛 (MDA)、过氧化物酶 (POD)、超氧化物歧化酶 (SOD) 活性测定方法
CAT活性测定采用紫外吸收法;MDA含量测定采用硫代巴比妥酸 (TBA) 比色法;POD活性测定采用愈创木酚显色法;SOD活性测定采用氮蓝四唑光化还原法。
1.2.8 实时荧光定量PCR分析 采用EASYspin Plus植物RNA快速提取试剂盒 (北京爱德莱生物科技有限公司) 提取样品RNA,用于实时荧光定量PCR的cDNA利用反转录试剂盒 (Perfect Real Time,TaKaRa) 获得。实时荧光定量PCR采用SYBR Green PCR Premix Ex Taq (宝生物公司),操作参照说明书进行,引物参见表1。用CFX96 Touch Real-Time PCR Detection System (Bio-Rad,USA) 进行实时荧光定量PCR。反应程序为:95℃预变性30 s,95℃变性5 s,58℃退火30 s,40次循环。所有实时荧光定量PCR反应均设置3次生物学重复和3次技术重复,所得数据采用进行计算。

表1 研究所用引物Table 1 Primers used in this study
1.3 数据处理与分析
试验数据采用Excel 2007进行图表绘制,用SPSS 20.0软件对数据进行单因素方差分析及最小显著差异性检验 (Duncan’s新复极差法,P〈 0.05)。
2 结果与分析
2.1 低温胁迫下不同浓度钼酸铵处理的桃实生苗生长状况
对不同浓度钼酸铵处理的桃实生苗在冷光源植物生长箱 (0℃,5000 lx,12 h光照) 中培养48 h后,对各组的生长状况进行观察分析。各处理的桃实生苗叶片发生不同程度的萎蔫和卷曲,其中,M0处理最为严重,叶片卷曲、萎蔫程度最重,0.04%钼酸铵处理叶片萎蔫数量最少,但叶片也有卷曲现象。由此可知,钼酸铵处理可以减轻低温胁迫下桃实生苗叶片的萎蔫程度,以0.04%钼酸铵处理效果最佳 (图 1)。
2.2 不同浓度钼酸铵对低温胁迫下桃实生苗叶片冻害指数的影响
低温胁迫下,桃实生苗叶片会受到不同程度的损伤,出现萎蔫、水渍状、失绿等症状,对叶片的生理功能造成一定影响 (图1)。在低温胁迫后,对5个处理的叶片冻害指数进行统计分析。由表2可知,相对于M0 (清水) 处理,钼酸铵处理能显著降低叶片受冻指数,减轻叶片萎蔫程度,M1、M2、M3、M4处理冻害指数分别降低了23.8%、38.4%、29.6%、24.0%,以0.04%钼酸铵 (M2) 处理效果最佳,与其他处理差异显著 (P〈 0.05)。
2.3 不同浓度钼酸铵对桃实生苗叶片钼含量的影响
对不同浓度钼酸铵处理的桃实生苗叶片钼含量进行测定。与对照相比,喷施钼酸铵显著提高了叶片钼含量,浓度为0.01%、0.04%、0.08%、0.12%的钼酸铵处理分别是M0处理的2.04倍、3.33倍、4.25倍和4.45倍,差异显著。可见,桃实生苗叶片钼含量随着喷施钼酸铵浓度的增加而升高 (图2)

图1 低温胁迫下不同浓度钼酸铵处理的桃实生苗生长状况Fig. 1 Peach seedlings treated with different concentrations of ammonium molybdate under low temperature stress

表2 低温胁迫下不同浓度钼酸铵处理的桃实生苗叶片冻害指数Table 2 Frost index of peach seedlings treated with different concentrations of ammonium molybdate under low temperature stress
2.4 不同浓度钼酸铵对低温胁迫下桃实生苗叶片相对电导率的影响
电导率是衡量桃树植株细胞内容物扩散到细胞外的一项生理指标,能够反映细胞质膜受伤害的程度。低温胁迫下,桃实生苗叶片的相对电导率随胁迫时间呈明显上升的趋势,喷施不同浓度的钼酸铵能显著降低桃实生苗叶片的相对电导率。0℃条件下,桃实生苗叶片的相对电导率在0~48 h均呈上升趋势,喷施清水处理 (M0) 的相对电导率一直处于最高的水平,0.01%、0.04%、0.08%和0.12%钼酸铵处理都能显著降低桃实生苗的相对电导率,其中以M2处理效果最为显著 (P〈 0.05),相对电导率的增长幅度显著降低,在48 h时,分别比对照降低了5.10%、7.19%、3.77%、5.03%。说明钼酸铵处理显著降低了桃实生苗叶片膜蛋白受伤害的程度,减少了胞质的胞液外渗,有效地保护了细胞膜系统,增强了叶片的抗低温能力 (图3)。
2.5 不同浓度钼酸铵对低温胁迫下桃实生苗叶片SPAD值、净光合速率的影响
低温胁迫处理后,对5组桃实生苗叶片的SPAD值和净光合速率进行统计分析。不同浓度钼酸铵处理有效阻止了SPAD值及净光合速率的降低,与M0处理相比,SPAD值分别提高了8.6%、23.4%、11.1%、8.6%;净光合速率分别提高了9.4%、62.4%、37.6%、25.6% (图4),其中0.04%钼酸铵处理效果最为明显 (P〈 0.05),说明0.04%处理能显著降低低温胁迫对桃实生苗叶片光合特性的影响。
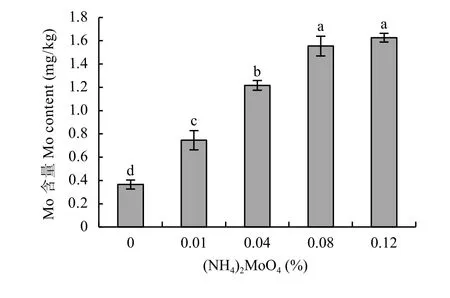
图2 不同浓度钼酸铵处理桃实生苗叶片钼含量Fig. 2 Mo contents in peach seedling leaves under various ammonium molybdate concentrations

图3 低温胁迫下不同浓度钼酸铵处理的桃实生苗叶片的相对电导率Fig. 3 The relative conductivity of peach seedlings leaves treated with different concentrations of ammonium molybdate under low temperature stress
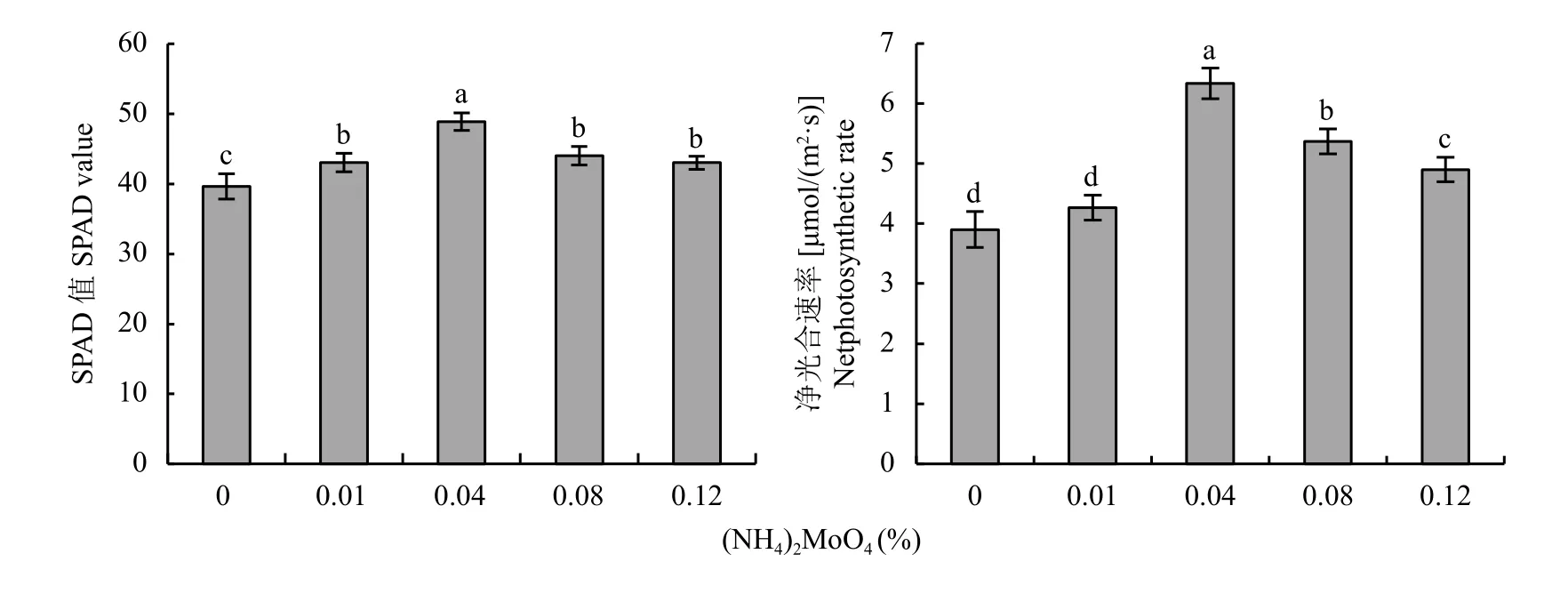
图4 低温胁迫下不同浓度钼酸铵处理桃实生苗叶片SPAD值及净光合速率Fig. 4 SPAD values and net photosynthetic rates of peach seedling leaves treated with different concentrationsof ammonium molybdate under low temperature stress
2.6 不同浓度钼酸铵对低温胁迫下桃实生苗叶片脯氨酸、可溶性糖含量的影响
低温胁迫条件下,与M0处理相比,0.01%、0.04%、0.08%和0.12%钼酸铵处理的叶片脯氨酸含量分别提高了0.89%、11.7%、8.54%、5.06%;可溶性糖含量分别提高了1.95%、9.64%、6.73%、4.50%(图5),其中以0.04%钼酸铵处理效果最为明显 (P〈0.05)。脯氨酸和可溶性糖含量与温度变化密切关联,其含量提高能显著增强细胞的抗逆能力,说明钼酸铵处理能起到调节叶片细胞渗透压、保护膜稳定性的作用。综上表明,0.04%钼酸铵处理对缓解低温胁迫伤害的效果最佳。
2.7 不同温度下钼酸铵对桃实生苗叶片可溶性糖和脯氨酸含量的影响
根据上述试验结果,进一步研究发现。低温胁迫下,桃实生苗叶片的可溶性糖和脯氨酸含量较常温条件下呈升高趋势,0.04%钼酸铵处理能显著提高叶片可溶性糖和脯氨酸含量 (P〈 0.05)。由图6所示,T1 (清水 + 0℃)、T3 (0.04% 钼酸铵 + 0℃) 处理叶片的可溶性糖和脯氨酸 (图6) 含量在0~48 h呈显著上升趋势。在24 h时,T3处理较T1处理可溶性糖含量无显著差异,脯氨酸含量提高了8.82%;在48 h时,T3处理较T1处理可溶性糖含量提高了8.27%,脯氨酸含量提高了8.69%;CK (清水 + 常温)、T2 (0.04%钼酸铵 + 常温) 处理没有明显变化。可溶性糖和脯氨酸能够敏感、显著地响应低温胁迫,0.04%钼酸铵处理使其含量升高可提高细胞渗透势,有利于维持细胞正常的生理活动,是植物对逆境条件的一种适应性变化。

图5 低温胁迫下不同浓度钼酸铵处理桃实生苗叶片的脯氨酸和可溶性糖含量Fig. 5 Proline and soluble sugar contents of peach seedling leaves treated with different concentrations of ammonium molybdate under low temperature stress

图6 不同温度下钼酸铵对桃实生苗叶片可溶性糖和脯氨酸含量的影响Fig. 6 Effect of ammonium molybdate on soluble sugar and proline contents of peach seedling leaves under different temperatures
2.8 钼酸铵对叶片丙二醛含量及保护酶活性的影响
丙二醛积累量是反映膜脂过氧化作用和细胞膜结构破坏程度的一个重要指标,过氧化氢酶、过氧化物酶、超氧化物歧化酶是防止氧自由基对细胞膜伤害的关键酶,对清除低温下自由基伤害起重要作用。试验结果 (图7)表明,0.04%钼酸铵处理能显著
(P〈 0.05) 降低低温 (0℃) 胁迫条件下细胞内MDA的积累量,提高CAT、POD、SOD活性。在24 h时,T3处理MDA含量比T1处理降低了14.6%,CAT、POD、SOD活性分别提高了1.78%、18.7%、5.24%;48 h时,T3处理MDA含量比T1处理降低了10.8%,CAT、POD、SOD活性分别提高了1.98%、11.8%、9.15%,差异显著 (P〈 0.05)。
2.9 钼酸铵对LOS5/ABA3表达量的影响
0.04%钼酸铵处理能显著提高低温胁迫下LOS5/ABA3的表达量。在试验24 h时,T1、T3处理表达量分别提高了1.16倍、2.76倍,T3比T1提高了2.38倍;48 h时,T1表达量降低为0.49倍,T3处理仍提高了2.54倍。相对于T1处理,T3处理后,LOS5/ABA3的表达量保持在稳定且显著较高的水平 (图 8)。
2.10 钼酸铵对P5CS1和RCI3表达量的影响
低温胁迫下,P5CS1和RCI3表达量呈显著上升趋势,0.04%钼酸铵处理能进一步提高P5CS1和CIR1表达量。低温处理24 h时,T1、T3处理的P5CS1表达量分别提高了2.46倍、2.64倍,T3处理比T1处理提高了7.32%;T1、T3处理的RCI3表达量分别提高了1.39倍、1.50倍,T3处理比T1处理提高了7.91%。处理48 h时,T1、T3处理的P5CS1表达量分别提高了1.15倍、2.29倍,T3处理是T1处理的1.99倍;T1、T3处理的RCI3表达量分别提高了1.20倍、1.66倍,T3处理比T1处理提高了 38.3%,差异显著 (P〈 0.05) (图 9)。
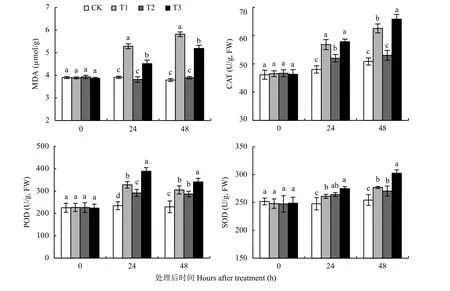
图7 钼酸铵处理后不同时间丙二醛含量和过氧化氢酶、过氧化物酶、超氧化物歧化酶活性Fig. 7 MDA content and activities of CAT, POD and SOD after treatment of ammonium molybdate
3 讨论
钼为植物必需微量元素,在提高植物抗逆性中具有重要作用,在酸性缺钼土壤中施用钼肥对冬小麦具有防冻作用[22]。本研究发现,对低钼土壤生长的毛桃实生苗进行喷钼处理可显著增加叶片钼含量,缓解低温胁迫下叶片萎蔫程度,有效缓解叶绿素含量和光合速率的降低。但抗冻效果并没有随施钼量的增加而逐渐增强,这可能是因为合理浓度的钼供应有利于提高植物体内养分的吸收与征调能力及酶活性,钼含量过高则会打破植物体内钼的平衡机制[23]。

图8 0.04%钼酸铵处理24、48小时后LOS5/ABA3的表达量Fig. 8 Expression level of LOS5/ABA3 at 24 and 48 h after treated with 0.04% ammonium molybdate
钼只有结合钼辅因子后才能发挥其生物有效性,因此研究编码钼辅因子的基因就显得尤为重要。LOS5/ABA3作为编码钼辅因子硫化酶的基因,不仅参与调控醛氧化酶 (AO) 的活性,调节激素合成,还进一步调控植物抗氧化防御能力及其他抗寒基因的表达,是ABA生物合成、胁迫诱导基因表达和胁迫耐受的关键调节因子[24-25],植株在敲除LOS5基因后对逆境胁迫的敏感性增强,更加从反面证明该基因与逆境胁迫有关[16]。转基因大豆中拟南芥LOS5/ABA3基因上调表达,提高了AO活性导致ABA积累显著增加,提高了植株抗逆性[26]。

图9 0.04%钼酸铵处理24、48小时后P5CS1和RCI3的相对表达量Fig. 9 Relative expression of P5CS1 and RCI3 at 24 and 48 h after treated with 0.04% ammonium molybdate
本试验表明,0.04%钼酸铵处理上调了LOS5/ABA3的表达,在低温胁迫下更为显著,且进一步研究发现,低温胁迫下0.04%钼酸铵处理上调了P5CS1和RCI3的表达,同时叶片中脯氨酸含量及过氧化物酶活性与对照相比显著提高。这可能是因为,一些冷诱导基因的表达受低温胁迫的调控,同时也对水分胁迫和脱落酸 (ABA) 有响应[27],RCI3受到环境和内源物质的复杂调节[28]。LOS5 /ABA3作为ABA合成关键基因,它在表达上调时会在转录水平上影响RCI3的表达。1-吡咯啉-5-羧酸合成酶是脯氨酸合成过程中重要的催化酶,LOS5/ABA3能够提高脯氨酸合成酶基因 的表达量,调控脯氨酸的合成,进而影响植物的抗寒性[29-30]。
植物对逆境胁迫的反应会部分通过改变其基因表达量来实现,最终会导致细胞和全植物水平上的各种适应性反应[27,31]。本试验表明,喷施钼酸铵处理的桃实生苗叶片可溶性糖、脯氨酸含量显著提高,酶活性显著提高,与前人施钼能够增加冬小麦可溶性糖、可溶性蛋白质、脯氨酸的含量,提高抗氧化酶活性[3]结果相一致。这可能是因为在低温等非生物逆境胁迫下,植物通过启动一系列复杂的信号网络调控抗寒基因及蛋白质表达,进而影响植物体内各种代谢过程,最终增强植物的抗逆性[5]。可见钼作为植物体必需微量元素,对于调节植株激素、蛋白质、可溶性糖和脯氨酸等内源物质含量,提高植株抗冻性具有重要意义。
冻害对植物的伤害主要是破坏细胞中的膜结构,从而引起代谢失调,导致细胞间隙的水溶液浓度比细胞液低,引起细胞内水分外渗。前人研究表明,施用钼肥提高冬小麦叶细胞细胞器及其膜结构的稳定性和完整性,有利于提高冬小麦膜脂肪酸的不饱和度,降低了膜脂的相变温度,加强了膜的流动性,增强了冬小麦的抗寒力[32]。
本试验表明,低温胁迫下,桃实生苗叶片生理生化功能受到一定损伤,电导率呈上升趋势,膜透性发生改变,但不同浓度钼酸铵处理使桃实生苗叶片冻害指数、相对电导率显著降低,以0.04%浓度效果最佳。且0.04%钼酸铵处理的MDA含量显著降低,CAT、POD、SOD活性显著升高,可以迅速降低桃实生苗叶片活性氧自由基含量,增强了植物清除活性氧的能力,降低了活性氧对植物细胞的伤害。这可能是钼酸铵处理的桃实生苗叶片的叶绿素含量和净光合速率下降幅度得到缓解的一个重要原因。且钼是维持叶绿体结构必不可少的,能提高甘油醛-3-磷酸脱氢酶GAP和果糖-1, 6二磷酸酶FBPase的活性,提高了净光合速率,促进了光合作用的进行[33-34]。
综上表明,喷施钼酸铵处理的桃实生苗叶片,钼辅因子硫化酶、脯氨酸合成酶、过氧化物酶编码基因表达上调的同时,脯氨酸含量、可溶性糖含量、抗氧化酶活性等也显著提高,说明钼能通过调控基因的表达,进而缓解低温胁迫对桃实生苗叶片的伤害,但钼调控相关基因表达的机制还有待进一步研究。
4 结论
低温胁迫下,低钼土壤生长的桃实生苗喷施0.04%钼酸铵,可上调抗冻相关基因LOS5/ABA3(钼辅因子硫化酶)、P5CS(脯氨酸合成酶) 及RCI3(过氧化物酶) 的表达量,提高叶片可溶性糖、脯氨酸含量及抗氧化酶活性,缓解低温胁迫下叶片细胞膜氧化伤害,减轻低温胁迫对桃实生苗的伤害。

