清温并用法对慢加急性肝衰竭大鼠结肠组织调节性T淋巴细胞/辅助性T淋巴细胞17细胞因子的影响
陈斌 彭杰 张涛 朱文芳 张茜茜 丁秀丽 黎运芳
〔摘要〕 目的 研究清溫并用法对慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)大鼠结肠组织Treg/Th17相关型细胞因子表达的影响,探讨其抗ACLF肠源性内毒素血症(intestinal endotoxemia, IETM)的可能调控机制。方法 140只SD大鼠随机分为正常组、模型组、清法组、温法组及清温并用法组。牛血清白蛋白致敏法建立免疫性肝纤维化大鼠模型,腹腔注射D-氨基半乳糖+脂多糖急性攻击建立ACLF大鼠模型,各组予以相应干预,观察24 h内各组大鼠外周血内毒素、外周血Treg/Th17细胞比值、结肠组织Treg/Th17型细胞因子变化。结果 与正常组比较,模型组大鼠在各时间点内毒素明显升高(P<0.01)、Treg/Th17型细胞因子明显升高(P<0.01)、Treg/Th17比值明显降低(P<0.01);与模型组比较,清法、温法、清温并用法组在1、12、24 h各个时间点内毒素、Treg/Th17相关细胞因子表达均降低(P<0.05),以清温并用法组下降最显著(分别与清法组、温法组比较,P<0.05);各组与模型组比较,仅清温并用法组Treg/Th17比值明显升高(P<0.05)。结论 清温并用法抗肝衰竭IETM的机制可能与调节结肠组织Treg/Th17型细胞因子失衡,促使Treg/Th17细胞恢复平衡有关。
〔关键词〕 清温并用法;慢加急性肝衰竭;Treg/Th17型细胞因子
〔中图分类号〕R285.5;R575.4 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2019.05.003
〔Abstract〕 Objective To investigate the effects of clearing and warming simultaneously on the expression of Treg/Th17 associated cytokines in colon tissue of rats with acute and chronic liver failure (ACLF), and to explore its possible regulation mechanism of ACLF against intestinal endotoxemia (IETM). Methods A total of 140 SD rats were randomly divided into a normal group, a model group, a clearing group, a warming group, and a clearing and warming simultaneously group. The rats model of immune hepatic fibrosis were established by sensitization with bovine serum albumin, and then ACLF rats were induced by intraperitoneal injection of D-galactose and lipopolysaccharide (LPS). The changes of endotoxin in peripheral blood, ratio of Treg/Th17 cells in peripheral blood and Treg/Th17 cytokines in colonic tissue were observed within 24 hours. Results Compared with the normal group, the toxins in the model group were significantly increased at each time point (P<0.01), the Treg/Th17 cytokines were significantly increased (P<0.01), and the Treg/Th17 ratio was significantly lower (P<0.01). Compared with the model group, the expression of toxin and Treg/Th17-related cytokines were decreased in the clearing group, the warming group, the clearing and warming simultaneously group at 1 h, 12 h, and 24 h (P<0.05). The decrease in the clearing and warming simultaneously group was the most significant (compared with the clearing group, the warming group, P<0.05). Compared with the model group, the ratio of Treg/Th17 was significantly increased in the clearing and warming simultaneously group than in the model group (P<0.05) Conclusion The mechanism of treating acute-on-chronic liver failure IETM in using clearing and warming simultaneously is related to the regulation of Treg/Th17 cytokine in colonic tissue and promoting the balance of Treg/Th17 cells
〔Keywords〕 clearing and warming simultaneously; acute-on-chronic liver failure; Treg/Th17 cytokines
慢加急性肝衰竭(acute-on-chronic liver failure, ACLF)是在慢性肝病基础上出现的急性肝功能失代偿[1],其中、后期病理机制以肠源性内毒素血症(intestinal endotoxemia, IETM)为主,发生率高达93.3%~100%[2],是引起肝衰竭患者病情恶化和死亡的重要原因。近年来,Treg/Th17细胞成为炎症反应调控研究的热点[3],研究显示肝衰竭患者Treg/Th17细胞频数及相关细胞因子水平明显升高,表明终末期肝病中存在Treg/Th17细胞比例及其炎症因子失衡,且对病情的进展发挥重要作用[4]。课题组长期临床实践及前期研究证实清温并用法对肝衰竭肠源性内毒素血症有效[5-6]。本实验以Treg/Th17细胞比值及相关细胞因子为主要研究指标,探讨清温并用法减轻慢加急性肝衰竭IETM炎症反应的可能免疫学机制。
1 材料与方法
1.1 动物
140只健康雄性SD大鼠,体质量(140±15) g,所有大鼠皆从湖南斯莱克景达实验动物有限公司购得,许可证号:SCXK(湘)2016-0002。
1.2 药物与试剂
中药茵陈蒿汤(方中茵陈30 g,栀子10 g,大黄10 g,甘草6 g);茵陈术附汤(方中茵陈30 g,白术15 g,附子10 g,肉桂3 g,干姜5 g,甘草6 g);温阳解毒化瘀(方中丹参30 g,赤芍60 g,白术30 g,茵陳30 g,薏苡仁30 g,附片10 g)。所有中药饮片均购于湖南中医药大学第一附属医院中药房(每一付中药都采用传统煎药方法,煎取400 mL药液,再用恒温水浴锅将其浓缩成100 mL,3个方剂中的生药含量分别为0.65 g/mL、0.69 g/mL、1.90 g/mL。牛血清白蛋白(Solarbio公司,批号:630G056/518H052),氨基半乳糖、弗氏不完全佐剂、脂多糖(Sigma公司,批号分别为: 210E052、1002453350、426H032),细菌内毒素试剂盒(湛江博康海洋生物,批号:17051004),IL-10、TNF-α、IL-17、IL-23 A、TGF-β ELISA KIT(上海晶天生物,批号分别为1710022、1710025、1710008、1710013、1710027)。
1.3 仪器
DHP-9052恒温箱(上海齐欣科学仪器有限公司);微量移液枪(Rainin PiPet-Lite美国);离心机(德国Eppendorf,Centrifuge 5424 R);超声波细胞粉碎机(宁波新芝技术公司,JY92-Ⅱ型);超净工作台(苏州净化设备有限公司,SW-CJ-2D型);电子天平(上海台之横电子衡器有限公司,FA型);流式细胞仪(Becton, Dickinson and Company);MTP-601F自动荧光酶标仪(日本日立公司)。
1.4 动物造模
采用牛血清白蛋白致敏法造模,建立免疫性肝纤维化大鼠模型[7-8],每次取含牛血清白蛋白4 mg牛血清白蛋白乳化液0.5 mL进行皮下多点注射致敏,前后分别间隔时间为14、10、10 d,总共注射4 次;再通过2 次/周的尾静脉注射牛血清白蛋白,剂量自2 mg/次依次递加0.5 mg/次,最后以4 mg/次剂量维持,全程共6周;第6周末,除正常组外,其余各组通过一次性腹腔注射D-Gal+LPS液(D-Gal 400 mg/kg,LPS 100 μg/kg)急性攻击建立肝衰竭IETM大鼠模型。急性攻击后,分别于1、12、24 h处死动物,采集大鼠外周血门静脉血及结肠组织样本。
1.5 分组与干预
将140只SD大鼠室内适应性喂养1周后,采用随机数字表法分出正常组大鼠10只(蒸馏水),剩下130只大鼠建立免疫性肝纤维化大鼠模型,造模完成81只,随机将这81只大鼠分为模型组(蒸馏水)、清法组(茵陈蒿汤)、温法组(茵陈术附汤)各20只,清温并用法组(温阳解毒化瘀方)21只。药物用量参考文献[9],以大鼠与人的给药剂量系数6.17计算,得出清法组、温法组、清温并用法组生药灌胃量分别为5.759 g/kg、7.096 g/kg、19.538 g/kg。在造模过程的第6周开始进行中药灌胃干预,每日1次,一直干预至急性攻击前,共1周。在腹腔急性攻击之后,每隔6小时灌胃1次,用同等容量的蒸馏水对正常组和模型组进行灌胃。
1.6 观察指标
1.6.1 内毒素检测 采集大鼠门静脉血样1 mL加入体液处理剂Ⅰ号试管内,封闭试管口后混匀15 s,以3 200 r/min速度离心6 min,得到1.6倍上清液;取制得的1.6倍上清液0.4 mL加入体液处理剂Ⅱ号试管内混匀,置于水浴箱加热6 min,混匀后以4 200 r/min速度离心6 min,得到4倍上清液;取其0.3 mL加入检查用水试管中混匀,得到8倍液以备用;取出鲎试剂,分别进行检查用水、供试品溶液、质控品溶液加样;按试剂盒要求测试。
1.6.2 结肠组织IL-10、TNF-α、TGF-β、IL-23、IL-17A检测 参照ELISA试剂盒说明书操作:取40 μL样本加入待测样品孔,后分别加入50 μL链酶亲和素-HRP和10 μL需检测抗体,盖上封板膜,混匀,37 ℃恒温箱温育60 min;用蒸馏水稀释30倍浓缩洗涤液后备用;揭开封板膜后去掉液体甩干后于每个孔加满稀释后的洗涤液,静置30 s后去掉洗涤液,重复5次操作后拍干;显色:每个孔中先后加入显色剂A 50 μL和显色剂B 50 μL,摇匀后在 37 ℃条件下避光显色10 min;每孔加50 μL终止液终止反应,10 min内测定各孔的OD值。
1.6.3 外周血Treg/Th17细胞频数表达检测 采集大鼠外周血2 mL,加入10 μL的CD4抗体,室温避光孵育20 min;400 r/min速度离心5 min后去掉上清液,再加入2 mL的PBS,混匀,离心,去掉上清液;加入100 μL的IC Fixation buffer,室温避光孵育40 min,加2 mL的1×Permeabilization buffer,离心,去掉上清液;加入IL-17A抗体5 μL,混匀,室温避光孵育40 min;加300 μL PBS混匀避光存放,按照流式细胞分析试剂盒说明书要求和标准规程操作检测。Treg细胞检测使用CD4和FOXP3抗体标记,实验步骤同上。
1.7 统计学分析
所有数据采用PSPP17.0进行统计分析处理,计量资料用“x±s”表示,釆用单因素方差分析(One-Way ANOVA)进行多组间比较,进一步两两比较选用LSD-t法检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况观察
除正常组外余130 只大鼠在牛血清白蛋白皮下多点注射致敏阶段无死亡,尾静脉注射攻击开始到第5周末共死亡39只,成模91只,腹腔注射D-Gal+LPS进行急性攻击后,大鼠出现精神萎靡,活动迟缓,部分出现肢体扭曲等衰弱貌;正常组大鼠无死亡,饮食量正常、活动灵敏,无行为异常;模型组1 h死亡1只,死亡率5%,12 h共死亡3 只,死亡率15%,24 h共死亡5只,死亡率25%;清法组、温法组在1 h死亡率0%,12 h死亡1只,死亡率5%,至24 h共死亡2 只,死亡率10%;清温并用法组各时间点无死亡。
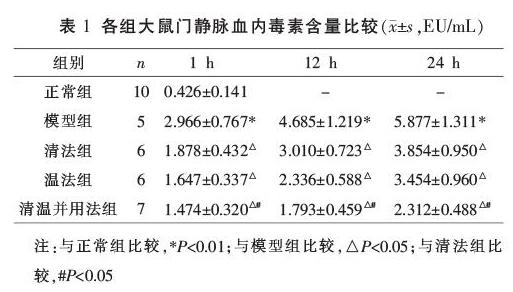
2.2 各组大鼠门静脉血内毒素含量比较
与正常组比较,模型组内毒素水平在1、12、24 h时间点均升高(P<0.01);与模型组比较,清法组、温法组、清温并用法组内毒素水平在1、12、24 h各时间点均降低(P<0.05),以清温并用法组降低最显著(分别与清法组、温法组比较,P<0.05);清法组与温法组之间内毒素水平比较差异无统计学意义(P>0.05),见表1。
2.3 各组大鼠外周血Treg/Th17细胞比值比较
与正常组比较,模型组Treg/Th17细胞频数表达在1、12、24 h时间点皆显著下降,差异有统计学意义(P<0.01);与模型组比较,清法组、温法组Treg/Th17细胞比值无明显升高(P>0.05),清温并用法组Treg/Th17比值在以上各时间点均明显升高(P<0.05),具体结果参见文献[10]。
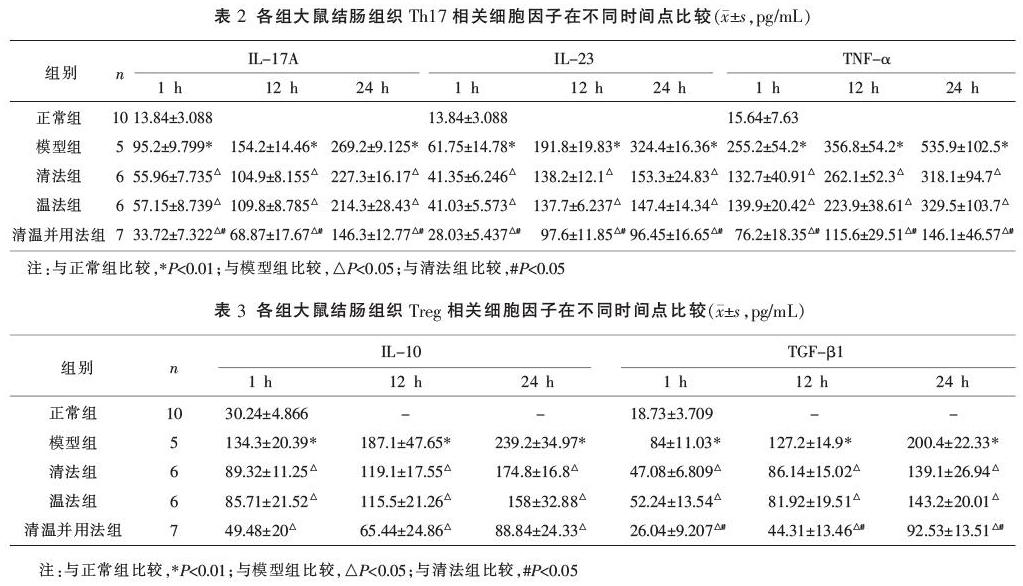
2.4 各组大鼠结肠组织Th17型细胞因子IL-17A、IL-23、TNF-α表达
与正常组比较,模型组Th17细胞相关因子IL-17A、IL-23、TNF-α在各时间点表达均升高(P<0.01);与模型组比较,清法组、温法组、清温并用法组IL-17A、IL-23、TNF-α水平降低(P<0.05),以清温并用法组降低最显著(分别与清法、温法组比较P<0.05)。见表2。
2.5 各组大鼠结肠组织Treg型细胞因子TGF-β、IL-10表达
模型组与正常组比较,Treg细胞相关因子TGF-β、IL-10在各时间点表达均明显升高(P<0.01);与模型组比较,清法组、温法组、清温并用法组TGF-β、IL-10各时间点表达下降(P<0.05),以清温并用法组降低最明显(分别与清法、温法组比较,P<0.05)。见表3。
3 讨论
肝衰竭是现代医学名称,其病情重,且发病机制复杂,中医传统医学中将其纳入于“肝瘟”“瘟黄”“急黄”等范畴,临床上一般从阴黄阳黄辨证论治,但课题组在长期临床实践中发现,肝衰竭患者在中晚期常易出现IETM,此时,黄疸中医证候学表现既非完全阳黄,又不能用单纯阴黄概而论之,而表现出虚实夹杂的证候学特点,发病机制上属于“瘀(血)、毒(热)、虚(脾)互结”[11],其治疗上注重清温并用,“清”即清热利湿,“温”即温阳健脾,疗效得到显著提高,课题组前期研究中已揭示清温并用法治疗肝衰竭的作用机制可能与减轻肠源性内毒素血症的发生发展有关[5-6],其調控机制目前尚不明确。而局部炎症反应作为ACLF内毒素血症病理生理的核心环节,其发病过程中抑炎与促炎作用失衡导致“炎症反应失控”,机体免疫应答紊乱。其中CD4+T细胞在机体免疫应答以及炎症反应中起到调节中心作用,其新的亚群Treg细胞、Th17细胞是当前炎症反应调控研究的热点。相关研究报道发现由肠、肝和免疫系统所构成的生物轴在ACLF患者IETM的发生发展中起重要作用[12]。
本研究通过研究大鼠结肠组织Treg细胞和Th17细胞分泌效应细胞因子表达水平及其与IETM之间的内在关系,旨在为探索ACLF发生IETM的可能免疫学机制提供一个全新的角度。从研究结果分析显示ACLF肠源性内毒素血症大鼠存在外周血Treg/Th17细胞失衡,其失衡具体表现为Th17细胞比例上升,Treg/Th17比值下降,门静脉内毒素水平明显升高,这一结果与Zhong Y M等[13]的研究结果基本相一致,认为ACLF在病理状态下必然存在导致 Treg/Th17细胞失衡的有关因素,外周血Treg/Th17失衡向Th17偏移,是ACLF病情发展加剧的可能病理机制。
Treg细胞作为CD4+T细胞中具有抑制炎症反应作用的新亚群,主要通过分泌TGF-β、IL-10等细胞因子来发挥其抑炎作用;相对应的,Th17细胞作为CD4+T细胞中具有促进炎症反应作用的新亚群,通过分泌IL-17A、IL-23及TNF-α等细胞因子发挥促炎作用[14-15]。正常情况下,二者处于平衡状态,一旦两者免疫平衡失调,Treg细胞不足以抑制过度炎症反应,可造成组织炎性反应失控,促进相关疾病的病情进展加剧[16]。本研究中模型组Treg/Th17细胞相关因子均较正常组有上升,但以Th17细胞相关的促炎细胞因子IL-23、IL-17A升高更为显著,其表达水平与肝组织损伤炎症坏死程度保持一致,并且与ACLF的高病死率有密切的相关性[17-18]。Wang N等[19]研究指出HBV-ACLF 病死患者血浆中的 IL-10等抑炎因子水平也明显升高,同样的,本研究在ACLF肠源性内毒素血症大鼠研究中也存在IL-10表达的上升。由此可以推测ACLF外周血在Treg/Th17细胞表达失衡的同时,也导致了其相应效应细胞因子表达水平的严重失衡,进而促进了ACLF肠源性内毒素血症的发生发展,使ACLF的病情进一步重症化。
課题组在大鼠造模成功后分别予以清法、温法、清温并用法代表方剂进行治疗干预,研究结果显示3种治疗方法都能够使Treg/Th17细胞及相关细胞因子的表达水平降低,其中Th17细胞相关因子TNF-α、IL-17A、IL-23下降趋势比Treg细胞相关因子TGF-β、IL-10的下降趋势更明显,从而促进了Treg/Th17细胞失衡的恢复,门静脉内毒素水平也下降;同时,研究发现清温并用法的效果要明显优于清法和温法,且促使Treg/Th17细胞比值升高明显的只有经清温并用法干预的大鼠,其门静脉内毒素表达水平在3种干预方案中最低。因此,可以推断,清温并用法能同时抑制慢加急性肝衰竭IETM时Treg、Th17细胞相关效应细胞因子的分泌产生,抑制相关促炎与抑炎因子释放,并促进Treg/Th17细胞比值恢复,使免疫调节趋于平衡,从而发挥减轻慢加急性肝衰竭发生IETM炎症反应的作用。
参考文献
[1] THIERRY G, JAVIER F, ELISABET G, et al. Clinical course of acute-on-chronic liver failure syndrome and effects on prognosis[J]. Hepatology,2015,62(1):243-252.
[2] 徐道振.病毒性肝炎临床实践[M].北京:人民卫生出版社,2006:266-271.
[3] RAPHEALL, NALAWADE S, EAGAR T N, et al. T cell subsets and their signature cytokines in autoimmune and inflammatory disease[J]. Cytokine, 2015,74(1):5-17.
[4] WANG X, LANG M, ZHAO T, et al. Cancer-FOXP3 directly activated CCL5 to recruit FOXP3(+) Treg cells in pancreatic ductal adenocarcinoma[J]. Oncogene,2017,36(21):3048-3058.
[5] 何 婉,陈 斌,徐嘉蔚,等.“肝病实脾”法对ACLF大鼠内毒素血症的影响 [J].湖南中医药大学学报,2015,35(3):12-15.
[6] 陈 斌,王 轩,李 武,等.温阳解毒化瘀方对肝衰竭大鼠内毒素血症的影响[J].中西医结合肝病杂志,2012,22(4):231-233.
[7] 朱起贵,方步武,竺稽能,等.牛血清白蛋白致免疫性肝纤维化动物模型的研究[J].中西医结合肝病杂志,1992,2(1):20-24.
[8] 刘旭华,孟艳英,陈 煜,等.采用免疫型肝硬化大鼠建立慢加急性肝衰竭模型方法的研究[J].胃肠病学和肝病学杂志,2008,17(10):790-793.
[9] 陈 奇.中药药理研究方法学[M].第2版.北京:人民卫生出版社.2006:194.
[10] 陈 斌,张 涛,朱文芳,等.清温并用法对慢加急性肝衰竭大鼠调节性T淋巴细胞/辅助性T淋巴细胞17表达的影响[J].临床肝胆病杂志,2018,34(12):85-90.
[11] 彭 杰,陈 斌,孙克伟,等.慢性乙型重型肝炎湿热-血瘀-脾虚证候分布与演变特点的回顾性分析[J].中西医结合肝病杂志,2011,
21(3):135-138.
[12] Microalbuminuria, systemic inflammation, and multiorgan dysfunction in decompensated cirrhosis: evidence for a nonfunctional mechanism of hepatorenal syndrome[J]. Hepatology, 2017,11(3):242-244.
[13] 钟燕明,武希润,王 琦,等.原发性胆汁性肝硬化患者外周血25-羟生素D3、Th17细胞、CD4+调节性T细胞的变化及其意义[J]. 中华肝脏病杂志,2016,24(11):829-833.
[14] XU Y, LIN H, ZHENG W, et al. Matrine ameliorates adriamycin-induced nephropathy in rats by enhancing renal function and modulating Th17/Treg balance[J]. European Journal of Pharmacology, 2016,15(7):491-501.
[15] YANG C, CUI F, CHEN LM, et al. Correlation between Th17 and nTreg cell frequencies and the stages of progression in chronic hepatitis B[J]. Molecular Medicine Reports, 2016,13(1):853-862.
[16] MING M, LUO Z, LV S, et al. Inactivated Mycobacterium phlei inhalation ameliorates allergic asthma through modulating the balance of CD4+CD25+regulatory T and Th17 cells in mice[J]. Iranian Journal Basic Medical Science, 2016,19(9):953-959.
[17] FURUYA S, KONO H, HARA M, et al. Interleukin 17A plays a role in lipopolysac charide/D-galactos-amine-induced fulminant hepatic injury in mice[J]. Journal of Surgical Research,2015,199(2):487-493.
[18] BAO S, ZHAO Q, ZHENG J, et al. Interleukin-23 mediates the pathogenesis of LPS / Gal N-induced liver injury in mice[J]. International Immunopharmacologyl, 2017,46(5):97-104.
[19] WANG N, FAN Y C, XIA H H, et al. Plasma Interleukin-10 Predicts Short-term Mortality of Acute-on-chronic Hepatitis B Liver Failure[J]. Aliment Pharmacol Ther, 2016,43(11): 1208-1221.

