硬叶兜兰菌根结构及菌根真菌空间分布特征
田凡 廖小锋 颜凤霞

摘要:为了解濒危植物硬叶兜兰菌根真菌在结构及分布方面的特征,采用切片法观察其菌根结构,分离培养不同根龄菌根真菌、根不同部位的菌根真菌,并进行观察、鉴定。结果表明,硬叶兜兰菌丝团大多数分布于根部皮层细胞,菌丝团数量由外皮层向皮层细胞逐渐增加,皮层细胞向内皮层逐渐减少,内皮层和中柱细胞内没有菌丝和菌丝团;皮层中间部位菌根真菌菌丝团数量最多,高于靠近表皮和靠近中柱部位的菌丝团数量;根基部、中部和根尖部位都有菌根真菌,但根中部的菌根真菌数量最多;菌根真菌的种类和数量随着根龄的变化而变化,随着根龄的增加,菌根真菌种类和数量也相应地增加。
关键词:硬叶兜兰;菌根真菌;菌根结构;分布;特征
中图分类号: Q934 文献标志码: A 文章编号:1002-1302(2019)02-0105-04
兰科(Orchidaceae Juss.)植物大多数依赖菌根真菌所提供的营养物质来促进种子萌发和幼苗生长[1]。部分具有绿色叶子和无叶绿素的兰科植物,整个生长周期都须要与菌根真菌共生[2]。自20世纪初由Bernard和Burgeff揭示兰科植物菌根之谜后,国内外相继开展了大量的兰科植物菌根真菌的研究。近年来也有一些学者对兜兰属(Paphiopedilum Pfitz.)植物菌根真菌进行了报道,李明等对杏黄兜兰(Paphiopedilum armeniacum S. C. Chen & F. Y. Liu)菌根真菌进行了研究[3];Yuan等利用分子系统学方法,对比了野外与移栽到温室2种不同生境的硬叶兜兰(Paphiopedilum micranthum Tang & F. T. Wang)和杏黄兜兰的菌根真菌多样性[4];Nontachaiyapoom等收集了不同生境的兜兰属植物进行菌株分离,通过形态和分子鉴定出了Epulorhiza repens和Epulorhiza calendulina(均暂无中文名)类真菌[5]。
原产于我国兜兰属的硬叶兜兰,花奇色美,具有非常高的观赏价值[6]。由于采集过度、走私出境猖獗以及生境破坏等原因,近十几年来野生硬叶兜兰的数量急剧减少,分布区逐渐萎缩,已经到了灭绝的边缘。硬叶兜兰野生资源的保护和人工繁育问题亟待引起社会各界的重视。由于硬叶兜兰的种子无胚乳,发芽率极低,虽然目前人工无菌播种已经获得成功,但是出瓶率低、移栽难的问题还没得到解决。将菌根真菌应用于种子萌发及幼苗的生长,可解决硬叶兜兰人工有性繁殖难题。本研究对硬叶兜兰菌根进行切片观察并对其菌根真菌进行分离培养,分析硬叶兜兰菌根结构及菌根真菌空间分布特点,以期为兰科植物内生菌根真菌的特征增添素材,为硬叶兜兰的人工繁殖及其保育工作提供理论基础和实践经验。
1 材料与方法
1.1 试验材料
试验材料为硬叶兜兰成年植株根部,其植株采集于贵州省铜仁地区德江县青龙镇潮水河一带。
1.2 试验方法
1.2.1 徒手切片法 将硬叶兜兰根在流水下冲洗干净,选取具有菌丝团的根段,徒手切片,用乳酸石炭酸棉蓝染色液染色,在OLYTMPUS DP70光学显微镜下观察菌根结构特点并拍照。
1.2.2 菌株的分离培养 菌株分离培养参考Zhu等的单菌丝团分离法[7-8],具体如下:
(1)根处理和含菌丝团根段的选择。截取硬叶兜兰新鲜根段分装于盛有无菌水的培养皿中,无菌状态下用解剖刀轻轻刮掉根被,显微镜检,选出具有菌丝团的根段,用0.1%氯化汞溶液消毒2~3 min,无菌水冲洗 4~5次,然后用解剖针和镊子刮菌丝团根段,使单菌丝团从皮层细胞中游离出来,24 ℃ 恒温箱培养12 h后显微镜观察。
(2)菌丝团的刮制方法。在显微镜下观察,根据第1层(靠近表皮的2~3层细胞)、第2层(中间3~4层皮层细胞)和第3层(靠近中柱2~3层细胞)3个层次分别刮制于盛有无菌水的直径为60 cm培养皿中。
(3)菌丝团的选择及分离培养。在显微镜暗视野中找到生长出菌丝的菌丝团或菌丝结,利用1 000 μL的移液枪吸取菌丝团,转接到1 cm2双抗马铃薯葡萄糖琼脂培养基(PDA)培养基块上,24 ℃恒温箱培养。
(4)菌丝团的纯化。显微镜下镜检小块培养基,将开始生长的菌丝团从小块培养基上切下,然后转接至PDA培养基,24 ℃恒温培养。
1.2.3 菌株鉴定 菌种鉴定依据菌株菌落的培养特征及菌株显微形态观察的结果,结合文献资料,综合分析对比相关特征的异同,最后确定鉴定菌株的分类地位。
2 结果与分析
2.1 硬叶兜兰菌根结构
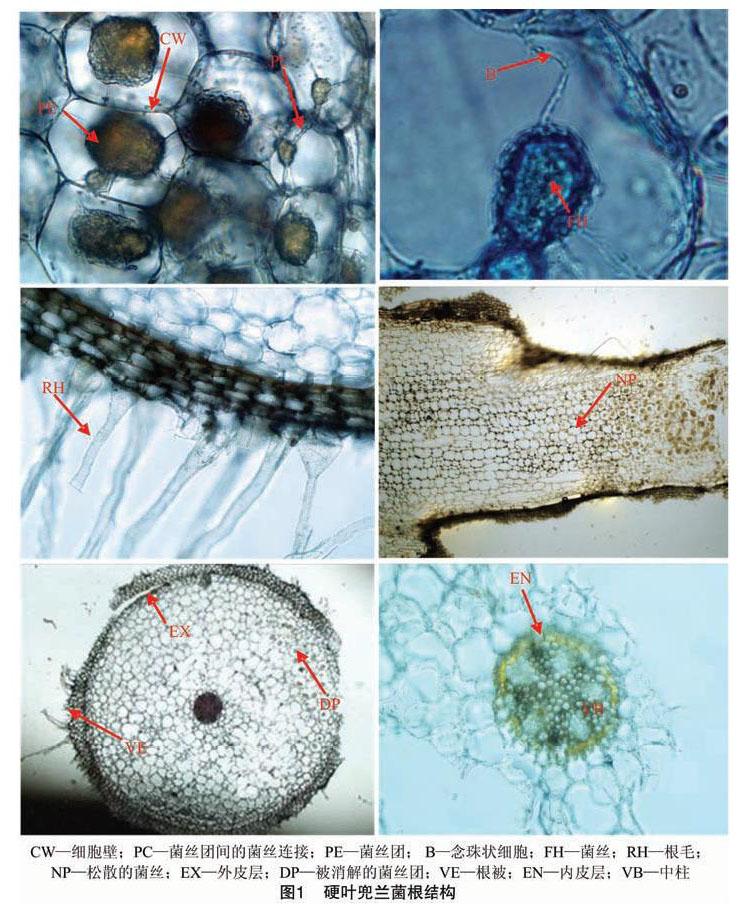
显微镜下观察硬叶兜兰根的纵切面和橫切面,从外至内依次为根毛(RH)、根被(velamen)、外皮层(exodermis)、皮层(cortex)、内皮层(endodermin)和维管柱(vascular cyhinder)。根被组织由4~5层厚壁、多角死细胞组成,细胞扁长,排列较松散。外皮层紧贴根被内侧,由1层细胞组成,细胞体积较大,排列也较规则,其中大部分细胞为胞壁增厚的死细胞。皮层由15~17层薄壁细胞组成,其中靠近外皮层与内皮层的 1~2层细胞体积相对较小,中部的皮层细胞体积较大,皮层细胞中含有针状结晶和菌根真菌形成的菌丝团。Rasmussen用苯胺蓝对兰科植物原球茎中的针状结晶研究表明,针状结晶是植物酸钙,硬叶兜兰菌根中的针状结晶可能也是这类物质[9]。内侧靠中柱(VB)的一层是内皮层,具有明显的凯氏带(casparian strip)。内层是维管柱,中柱鞘(pericycle)由1层细胞构成,木质部(xylem)与韧皮部(phloem)交替分布(图1-a至图1-f)。
在皮层薄壁组织中清晰地观察到大量的菌丝团(pelotons)和少量松散的菌丝,菌丝团近椭圆形,皮层细胞中的菌丝团还通过菌丝穿越细胞壁(CW)形成菌丝连接(PC)而侵染另一细胞(图1-a);菌丝团中或附近也观察到了念珠状细胞(B)(图1-b);在图1-c中可以看出菌丝顺着根毛进入根被。菌丝团中或附近也观察到了大量的念珠状细胞,在皮层细胞中,菌丝团常常分布在靠近细胞核(N)的部位,这与范黎等在其他兰科植物中观察到的现象[10-11]类似。菌根真菌在皮层细胞内形成菌丝结,可看到皮层细胞内分布着着色棕色或深棕色形态形状不规则的菌丝结等结构,这与丁晖等对兰花菌根结构研究的结果[12-13]类似。菌丝团主要分布于皮层细胞的3~5层中,且非均匀分布于整个横截面(图1-e)。皮层细胞中的菌丝团还通过菌丝穿越细胞壁而侵染另一细胞,并再次形成菌丝结(图1-a)。而在中柱(微管柱)中既没有菌丝团,也没有菌丝。兰科植物在真菌感染后形成菌丝团等结构是形成共生关系最直观、最可靠的证据。在硬叶兜兰根的皮层细胞中明显观察到菌丝团、菌丝团之间的菌丝连接、松散的菌丝团以及消解中的菌丝团(DP)(图1-e),强有力地证明了在自然界硬叶兜兰与真菌形成典型菌根结构,二者为共生关系。
2.2 硬叶兜兰同一根中菌根真菌纵向分布特征
由表1可知,由根尖向根基部,菌根真菌分离的数量和种类都有一定的变化特点。首先,从分离数量的变化上看,由根尖至根基逐渐减少;其次,菌丝团的萌发活力则是由根尖中菌丝团的分离率13.5%逐渐降至向根基部中菌丝团分离率的8.3%;最后,从分离种类的变化上看,根尖和根中部的种类最多,都为3种,根基部只分布1种菌根真菌。硬叶兜兰的根基部、中部和根尖部位都有菌根真菌,但其分布由根尖向根基部逐渐减少。
2.3 硬叶兜兰同一根中菌根真菌横向分布特征
由表2可知,从菌丝团分布上来看,菌丝团大多数分布于皮层细胞(皮层中间3~4层细胞);菌丝团活力上来看,由外皮层向内皮层,菌丝团活力逐渐降低,分离率由外皮层及其临近的1~2层皮层细胞中菌丝团的分离率20.5%降至内皮层及其临近的1~2层皮层细胞中菌丝团的分离率0;从种类分布上来看,硬叶兜兰3年生根皮层中间3~4层细胞中菌根真菌的种类最多,而第3层(靠近中柱2~3层细胞)没有分离到菌根真菌。
2.4 硬叶兜兰不同根龄中菌根真菌种类及数量
由表3可知,从菌丝团数量上来看,2年生根菌丝团数量最多,其次是3年生根,1年生根菌丝团的数量明显最少;萌发生长率与菌丝团的数量关系不大,1年生根菌丝团的萌发率略大于2年生根,3年生其次,但表3的比率差值不大。从菌根真菌种类上来看,2年生根分离的种类最多,1年生根中的菌根真菌种类最少。硬叶兜兰菌根真菌的种类和数量随着根龄的变化而变化,随着根龄的增加,菌根真菌种类和数量也相应地增加,反之,菌丝团的活力则减少。
3 讨论
3.1 硬叶兜兰菌根真菌入侵方式
显微结构观察表明,硬叶兜兰具有典型的兰科菌根结构。在皮层细胞内形成菌丝结,菌丝通过穿透细胞壁侵染邻近细胞,并再次形成菌丝结,皮层细胞中分布着大量的菌丝和菌丝团状,前者逐渐被植物的根细胞消解、吸收,而后者会在前者消解之后形成新的菌丝团。这种菌丝被消化又重新定殖的现象在整个植株发育过程中不断重复,再次验证了菌丝团和兰科植物之间的相互作用,进一步肯定了兰科植物与菌根真菌生长主要营养方式的理论。
丁晖等曾观察到,在具有通道细胞的兰科植物中,菌丝侵入时常不破坏根被,通过根毛或表皮细胞及外皮层薄壁通道细胞直径侵入[12,14]。在对硬叶兜兰菌根的观察中目前只在根毛或表皮细胞中观察到菌丝,由此可以认为真菌是通过根毛进入根被细胞,进一步向通道细胞和皮层细胞入侵,但其侵入机制还须要进一步深入研究。
3.2 硬叶兜兰同一根中菌根真菌纵向分布变化特征
据文献记载,兰科植物根尖的分生组织有兰酚类物质抵制真菌的侵入[15]。硬叶兜兰菌根中部的菌根真菌数量最多,这与春兰菌根的定植特点相同[16],由此可以看出土壤微生物是先从根中部入侵,随后向其两端逐渐蔓延。硬叶兜兰菌根中部分离到气生菌丝发达的mycorrhizal basidiomycete菌根真菌和气生菌丝不发达的Epulorhiza sp.、Psathyrella candolleana真菌。说明气生菌丝发达和气生菌丝不发达的菌株种类间不具有竞争性,是相互协同的共生作用。然而,是气生发达菌丝先定殖根皮层细胞,还是气生不发达菌丝先定殖根皮层细胞能更好地促进兰科植物的生长,维持长效的共生关系,这有待下一步的研究。
3.3 硬叶兜兰同一根中菌根真菌横向分布变化特征
由硬叶兜兰3年生根菌根真菌的横向分布的种类和数量可知,菌根真菌的分离率由外皮层向皮层细胞逐渐增加,由皮层细胞向内皮层逐渐减少,内皮层和中柱细胞内没有菌丝和菌丝团。经过分离培养得出,3个层次的皮层细胞都以气生菌丝不发达的菌株种类为主,这有助于维持菌根共生关系,不会因内生菌生长过快而导致兰科植物枯萎。
3.4 硬叶兜兰不同根龄中菌根真菌动态变化特征
1年生和2年生分离到的5种菌株的气生菌丝都不明显,生长较慢,其中Psathyrella candolleana菌株为优势菌,此菌株在双抗PDA培养基上不形成气生菌丝且生长较慢,而3年生根分离到的Psathyrella sp.菌株在双抗PDA培养基上,气生菌丝发达,生长速度较快。硬叶兜兰早期以生长较慢的菌根真菌为主,后期以生长较快的菌根真菌为主;早期以产生少量气生菌丝为主,后期以产生大量气生菌丝或气生菌丝不明显为主。生长慢的内生菌侵入为生长快的内生菌创造了较为适宜的生长条件,促进生长快的内生菌定殖。这样的定殖方式有助于菌根真菌的协同作用,促进和维持菌根的共生关系。
参考文献:
[1]Zelmer C D,Currah R S. Ceratorhiza pernacatena and Epulorhiza calendulina spp. nov.:mycorrhizal fungi of terrestrial orchids[J]. Canadian Journal of Botany,1995,73(12):1981-1985.
[2]Rasmussen H N,Rasmussen F N. Trophic relationships in orchid mycorrhiza-diversity and implications for conservation[J]. International Journal on Orchidology,2007,7(1/2):334-341.
[3]李 明,張 灼. 杏黄兜兰菌根研究与应用[J]. 生物学杂志,2001,18(6):17-18.
[4]Yuan L,Yang Z L,Li S Y,et al. Mycorrhizal specificity,preference,and plasticity of six slipper orchids from south western China[J]. Mycorrhiza,2010,20(8):559-568.
[5]Nontachaiyapoom S,Sasirat S,Manoch L . Isolation and identification of Rhizoctonia-like fungi from roots of three orchid genera,Paphiopedilum,Dendrobium,and Cymbidium,collected in Chiang Rai and Chiang Mai provinces of Thailand[J]. Mycorrhiza,2010,20(7):459-471.
[6]陈心启,刘芳媛. 云南几种兜兰属植物[J]. 植物分类与资源学报,1982,4(2):163-167.
[7]Zhu G S,Yu Z N,Gui Y,et al. A novel technique for isolating orchid mycorrhizal fungi[J]. Fungal Divers,2008,33(12):123-137.
[8]朱国胜. 贵州特色药用兰科植物杜鹃兰和独蒜兰共生真菌研究与应用[D]. 武汉:华中农业大学,2009.
[9]Rasmussen H N. Cell differentiation and mycorrhizal infection in Dactylorhiza majalis (Rchb. f.) Hunt & Summerh (Orchidaceae) during germination in vitro[J]. New Phytologist,1990,116(1):137-147.
[10]范 黎,郭順星,肖培根. 密花石斛等6种兰科植物菌根的显微结构研究[J]. 植物学通报,2000,17(1):73-79.
[11]Hadley G,Williamson B. Features of mycorrhizal infection in some malayan orchids[J]. New Phytologist,1972,71(6):1111-1118.
[12]丁 晖,韩素芬,王光萍,等. 卡特兰与丝核菌共培养体系的建立及卡特兰菌根显微结构的研究[J]. 菌物学报,2002,21(3):425-429.
[13]陈连庆,裴致达,韩宁林,等. 3种石斛菌根形态结构及元素构成的研究[J]. 林业科学研究,2002,15(1):96-100.
[14]Esnault A L,Masuhara G,Mcgee P A . Involvement of exodermal passage cells in mycorrhizal infection of some orchids[J]. Mycological Research,1994,98(6):672-676.
[15]潘超美,陈汝民,叶庆生. 野生建兰菌根的显微结构特征[J]. 广西中医药大学学报,2002,19(1):60-62.
[16]桂 阳,刘作易. 春兰菌根结构的研究[J]. 贵州农业科学,2006,34(2):18-19.

