加拿大一枝黄花石油醚萃取物对福寿螺肝脏的影响
李帅岚,沈校,邹峥嵘
加拿大一枝黄花石油醚萃取物对福寿螺肝脏的影响
李帅岚,沈校,邹峥嵘
(江西师范大学生命科学学院/江西省亚热带植物资源保护与利用重点实验室,南昌 330022)
【】在前期研究的基础上深入探讨加拿大一枝黄花石油醚萃取物(petroleum ether extract of,PEEE)对福寿螺()肝脏的影响,为进一步有效控制福寿螺对农业生产的危害、实现恶性外来入侵植物加拿大一枝黄花的资源化利用提供依据。【】以去氯自来水作为对照组,0.11、0.18和0.29 mg∙mL-1的PEEE悬浮液作为试验组。每组随机放入大小、活力一致的成年福寿螺10只,用一层纱布和橡皮筋封住烧杯口,防止福寿螺逃逸。在室温(23—27℃)条件下,处理48 h,每组3次重复。48 h后,分别随机挑选去氯自来水、0.11、0.18和0.29 mg∙mL-1浓度处理下的福寿螺,敲破螺壳,取出肝脏,使用扫描电镜和透射电镜观察肝脏组织的超微结构。经0.29 mg∙mL-1浓度处理后的福寿螺肝脏组织冻干后用于代谢组学研究。【】扫描电镜观察结果表明,经不同浓度的PEEE浸泡处理福寿螺48 h后,福寿螺肝脏表面均受到损伤,其损伤程度与PEEE处理液的浓度呈正相关,高浓度的PEEE可致使肝脏萎缩失去弹性,皱褶凸起被侵蚀,体表破损,出现絮状物,质地松散。透射电镜观察结果表明,经不同浓度的PEEE浸泡处理福寿螺48 h后,福寿螺肝细胞损伤明显,高浓度的PEEE使福寿螺肝细胞粗面内质网及线粒体数量减少,粗面内质网出现肿胀、断裂和颗粒脱落等现象;线粒体表现为肿胀,形状不规则。代谢组学的试验结果表明,经PEEE处理后,福寿螺肝脏中60种代谢物含量发生变化,多个代谢通路受到影响,富集程度最高的两条通路分别为糖鞘脂代谢和棕榈酰辅酶A进入线粒体基质的通路。【】加拿大一枝黄花的石油醚萃取物对福寿螺肝脏细胞结构和生理功能有巨大的损伤破坏作用,因而具有较强的灭螺活性,有望开发成为新型的天然灭螺药物。
加拿大一枝黄花;石油醚萃取物;福寿螺;肝脏;扫描电镜;透射电镜;代谢组学
0 引言
【研究意义】加拿大一枝黄花()属菊科(Compositae)一枝黄花属()植物,原产于北美地区,20世纪30年代作为庭院观赏植物引入我国南京、上海等地,后逸生至野外,成为恶性杂草,严重影响当地物种多样性[1-2]。福寿螺()属瓶螺科(Ampullariidae)瓶螺属()软体动物,原产南美洲亚马逊河流域,是世界100种恶性外来入侵物种之一[3]。该物种最早作为水产品引入我国广东省人工养殖,后因肉质欠佳、销售不畅而弃养。随后逃逸到水田等野外水域生长,以水稻或其他水生植物为食,食量极大[4]。福寿螺繁殖力惊人,在广州一只成熟雌螺1年内可繁殖30多万只幼螺[5]。已有报道表明福寿螺在亚洲每年造成的水稻等农作物经济损失达十亿美元,给农业生产和经济发展造成严重影响[6];同时福寿螺是广州管圆线虫()的中间寄主,人感染后会患嗜酸性粒细胞脑膜炎(eosinophilic meningitis),对健康造成严重损害。福寿螺既危害农业生产,破坏生态环境,也威胁到人类生命安全[3,7],因而杀灭福寿螺势在必行。【前人研究进展】经过多年的研究,主要形成了物理灭螺法、生物灭螺法和药物灭螺法[8]。物理灭螺法是比较传统的灭螺方法,包括整治河道、人工捕捞、翻耕除草和消灭福寿螺卵块等,是最环保、效果持久、节省资源的方法,但也是一次性投入成本极大、见效最慢的方法[9]。生物灭螺法是指通过改变螺的孽生环境或使用天敌,使环境不利于其生存或繁殖,打破原有的种群平衡,达到控制或消灭螺的目的。生物灭螺法包括捕食灭螺、竞争灭螺和微生物灭螺等3种[10]。生物灭螺法费用低廉、环境友好,但费时较长、见效较慢。药物灭螺法包括化学合成药物和植物源药物。目前我国常用的化学合成灭螺药物有五氯酚钠、氯硝柳胺、烟酰苯胺、溴乙酰胺、敌百虫、生石灰和杀虫丁等,但其中大部分药物会对人、动物以及农作物有害,对自然环境和生态平衡产生一定影响[10-11]。植物源药物灭螺因具有成本低廉、低毒、易生物降解和环境友好等优势而拥有广阔的应用前景。据不完全统计,自1933年Archibald[12]首次对植物果实的灭螺活性进行研究,目前已有超过1 000种植物用于试验[13]。刘席佑[14]研究表明,加拿大一枝黄花的花、茎、叶和根乙醇提取物对方形环棱螺均有抑制作用。但目前对加拿大一枝黄花的灭螺活性研究却鲜有报道。肝脏是动物体内重要的内脏器官,主要有消化和解毒两大生理功能,在新陈代谢和能量供应方面起着主要作用[15]。同时,肝脏也是对体内外环境变化最为敏感、最容易受伤害的器官[15-17]。扫描电子显微镜技术是一种可视化的表征技术,主要用来观察样品的表面形态[18]。透射电子显微镜是一种强大而独特的结构表征技术,是展示正常和疾病状态下细胞和组织超微结构的重要工具[19]。代谢组学是一种研究体内代谢谱的系统方法,它通过测量和数学建模生物体液和组织中代谢产物水平的变化,有利于判断生物体在不同环境下的代谢状态,探索药物的作用机理[20-21]。【本研究切入点】前期研究表明加拿大一枝黄花乙醇提取物、石油醚萃取物、乙酸乙酯萃取物、水饱和正丁醇萃取物和水层剩余物均具有杀灭福寿螺的作用,其中石油醚萃取物的灭螺效果最强,且主要集中在处理后的24—48 h;另外经加拿大一枝黄花石油醚萃取物(petroleum ether extract of,PEEE)处理后,福寿螺肝脏组织受到损伤,肝小叶结构不完整,细胞畸形、急性坏死甚至溶解[22]。本试验结合扫描电镜、透射电镜和代谢组学等方法综合研究PEEE对福寿螺肝脏解剖结构和代谢功能的影响。【拟解决的关键问题】以PEEE处理48 h后的福寿螺肝脏为材料,观察福寿螺肝脏表面形态、细胞内部结构及代谢物的变化,探究PEEE对福寿螺的杀灭机理,为福寿螺的防治提供理论依据。
1 材料与方法
试验于2018年在江西师范大学江西省亚热带植物资源保护与利用重点实验室完成。
1.1 加拿大一枝黄花石油醚萃取物(PEEE)的制备
加拿大一枝黄花采集于江西省南昌市孔目湖旁,株高120 cm左右,处于生长旺盛期。采集回的加拿大一枝黄花经江西师范大学生命科学学院邹峥嵘教授鉴定,标本(编号:20160712)存放于江西师范大学生命科学学院植物标本室。采集的加拿大一枝黄花取地上部分用清水冲洗(2—3次),于通风处阴干3 d,剪碎,置于真空干燥箱(40℃,上海新苗医疗器械制造有限公司,DZF-6050)烘至恒重,粉碎成粉末状后过40目筛。称量粉末480.0 g,用体积分数为70%的乙醇按1﹕10 (质量﹕体积)的比例在常温下浸泡12 h,超声波(功率500 W,昆山市超声波仪器有限公司,KQ-500DE)辅助冷浸提取30 min,重复3次,合并滤液。用旋转蒸发仪(上海爱朗仪器有限公司,N-1100)浓缩滤液,浓缩至无醇味,得乙醇提取物(EE)。取部分乙醇提取物加水,使其成为均匀混悬状态再按体积比3﹕1与石油醚混合进行萃取,重复萃取3次,合并萃取液,用旋转蒸发仪减压蒸馏浓缩回收溶剂,得到加拿大一枝黄花石油醚萃取物(PEEE)浸膏,4℃保存备用。
1.2 福寿螺肝脏的取材
福寿螺采集于广东省深圳市南山区沙河,经江西师范大学生命科学学院李言阔博士鉴定。将采集的福寿螺用清水洗净后于实验室喂养3 d(浮萍喂养)以适应实验室环境,随机挑选大小和活力一致、能正常活动、螺高为18—25 mm的成年福寿螺供试。采用浸泡法[23],配置浓度为0.11、0.18和0.29 mg∙mL-1的PEEE悬浮液[22]作为试验组,分别用量筒量取400 mL不同浓度的PEEE悬浮液于500 mL烧杯中,去氯自来水作为对照组。每个烧杯中随机放入大小、活力一致的成年福寿螺10只,用一层纱布和橡皮筋封住烧杯口,防止福寿螺逃逸,在室温(23—27℃)条件下,处理48 h,每组3次重复。48 h后,分别随机挑选去氯自来水、0.11、0.18和0.29 mg∙mL-1浓度处理下的福寿螺,敲破螺壳,取出肝脏,切取适宜大小,用提前预冷(4℃)的生理盐水冲洗,再用滤纸吸干其表面水分。将肝脏放入电镜固定液(主要成分为戊二醛)中室温固定2 h,再转移至4℃冰箱保存,用于扫描电镜和透射电镜观察。
1.3 肝脏代谢物的提取
浸泡处理48 h后,分别随机挑选去氯自来水和0.29 mg∙mL-1浓度处理下的福寿螺,敲破螺壳,取出完整肝脏。用新鲜配置、冰水预冷的生理盐水洗涤两次,再用滤纸吸干其表面水分,切取肝脏中间部位200 mg。用镊子夹取肝脏组织于离心管中,编号,记录,迅速放入-80℃冰箱。用预冷的甲醇提取肝脏组织(按照1.0 mg﹕200.0 μL的比例添加甲醇提取液),加入两颗钢珠,研磨仪(Qiagen公司,TissueLyser)power设置为50,研磨3个循环,每循环1 min;12 000 r/min,4℃离心20 min,取上清,0.5×水稀释,取其中100.0 μL至进样瓶。各取50.0 μL制作QC(quality control)样本。
1.4 扫描电镜观察
固定好的肝脏样品经0.1 mol磷酸缓冲液PB(pH 7.4)漂洗3次,每次15 min,1%的锇酸0.1 mol磷酸缓冲液PB(pH 7.4)室温(20℃)固定1—2 h,0.1 mol磷酸缓冲液PB(pH 7.4)漂洗3次,每次15 min。肝脏组织依次入30%-50%-70%-80%-90%-95%-100%- 100%酒精脱水,每次15 min。将样本放入临界点干燥仪(Quorum公司,K850)内进行干燥之后将样本紧贴于导电碳膜双面胶上放入离子溅射仪(Ixrf公司,MSP-2S)样品台上进行喷金30 s左右,最后在扫描电子显微镜(Hitachi公司,SU8010)下观察采图。
1.5 透射电镜观察
1%的锇酸0.1 mol磷酸缓冲液PB(pH 7.4)室温(20℃)固定2 h。0.1 mol磷酸缓冲液PB(pH 7.4)漂洗3次,每次15 min。肝脏组织依次入50%-70%- 80%-90%-95%-100%-100%酒精-100%丙酮-100%丙酮上行脱水,每次15 min。丙酮﹕812包埋剂=1﹕1(2—4 h),丙酮﹕812包埋剂=2﹕1(渗透过夜),纯812包埋剂5—8 h,将纯812包埋剂倒入包埋板,将样品插入包埋板后37℃烤箱过夜,60℃烤箱聚合48 h。超薄切片机切60—80 nm超薄切片,铀铅双染色(2%醋酸铀饱和酒精溶液,枸橼酸铅,各染色15 min),切片室温干燥过夜,最后在透射电子显微镜下观察,采集图像分析。
1.6 液相色谱分析和质谱分析
1.6.1 液相色谱分析条件 柱温40℃,样品温度4℃,液相流速为0.45 mL∙min-1;A相为水加0.1%的甲酸,B相为乙腈加0.1%甲酸。具体流动洗脱梯度见表1。

表1 液相色谱流动洗脱梯度
1.6.2 质谱条件 在正离子采集模式下,Masslynx软件基于MSE功能对样品进行一级、二级质谱数据采集。毛细管电压2.5 kV,锥孔电压24 V,离子源温度100℃,去溶剂气流速800 L∙h-1,锥孔气流速50 L∙h-1,14 min内对m/z为50—1 500 Da的离子进行扫描,0.2 s/循环。
1.6.3 样本分析及质控 为了更好地采集数据,确保仪器的最佳状态,在正式样品上机前用QC样本做稳定性测试。将同一个QC样本重复进样10针左右,此样本为condition QC,待仪器稳定方可进样。每10针样本中间插入一个QC,确保仪器进样过程中的稳定性。
1.6.4 数据分析 获得原始数据后导入Progenesis QI(Waters)软件进行统计分析,首先对数据进行Lockmass的质量分数校正和保留时间的峰对齐,然后对质谱数据进行多元统计分析,构建主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least square-discriminate analysis,OPLS-DA)模型。通过模型分析对代谢物进行VIP(variable importance in the projection)打分筛选(EZinfo软件),本试验选取QC样本CV值<30%、VIP>2、value<0.05的代谢物为差异代谢物进行搜库,资料库为KEGG和NIST数据库。
2 结果
2.1 福寿螺肝脏表面的扫描电镜观察
福寿螺的肝脏呈螺旋状,位于福寿螺尾部。取材时发现,对照组福寿螺的肝脏表面有光泽,质地柔软有弹性,而试验组的福寿螺肝脏表面色泽暗淡,逐渐失去弹性,容易破裂。
通过扫描电镜对福寿螺肝脏体表进行观察(图1,放大倍数见图注),发现对照组福寿螺的肝脏外表整体饱满圆润,表面平整,结构清晰(图1-A、1-B),其肝脏表面有皱褶和小丘状凸起(图1-C),凸起周围延伸有纤细丝状物,表面还有规则的圆形小孔,组织质地紧密(图1-D);经浓度为0.11 mg∙mL-1的PEEE处理福寿螺48 h后,其肝脏表面开始变得起伏不平(图1-E、1-F),丘状凸起变小,周围的纤细丝状物减少(图1-G),规则的圆形小孔出现溶解,组织质地较对照组疏松(图1-H);经浓度为0.18 mg∙mL-1的PEEE处理福寿螺48 h后,其肝脏表面出现更深的沟回,凹凸不平,呈整体萎缩的现象(图1-I、1-J),凸起继续变小变平,开始出现絮状物(图1-J、1-K),圆形小孔被溶解变形,表面组织出现小范围缺损(图1-L);在高浓度0.29 mg∙mL-1的PEEE处理下,福寿螺肝脏整体萎缩变得扁平,其表面上可见大面积松散的颗粒(图1-M、1-N),肝脏表面被大范围侵蚀,小丘状的凸起消失,与对照组福寿螺肝脏有明显区别(图1-O),其侵蚀的大小和深浅不一,缺损严重,质地松散(图1-P),这表明福寿螺肝脏受损严重。
2.2 福寿螺肝脏透射电镜观察
利用透射电镜技术观察了福寿螺肝脏的超微结构(图2),结果表明对照组福寿螺肝细胞呈不规则形,异染色体较少;胞质内含有粗面内质网,线粒体,分泌颗粒和脂滴等细胞器和内含物(图2-A)。经浓度为0.11 mg∙mL-1的PEEE处理福寿螺48 h后,其肝细胞异染色体含量增多,出现细胞胞质水肿(图2-B);经浓度为0.18 mg∙mL-1的PEEE处理福寿螺48 h后,其肝细胞内粗面内质网和线粒体的数量明显减少(图2-C);在高浓度0.29 mg∙mL-1的PEEE处理下,福寿螺肝细胞损伤明显,粗面内质网及线粒体不仅数量减少,粗面内质网还出现了肿胀,断裂,脱颗粒的现象;线粒体表现为肿胀,形状不规则(图2-D)。

A—D:去氯自来水处理(对照),分别放大50×、100×、300×和1 000× Dechlorinated tap water treatment (control), amplified by 50×, 100×, 300× and 1 000×, respectively;E—H:0.11 mg∙mL-1的PEEE处理,分别放大50×、100×、300×和1 000× PEEE treatment of 0.11 mg∙mL-1, amplified by 50×, 100×, 300× and 1 000×, respectively;I—L:0.18 mg∙mL-1的PEEE处理,分别放大50×、100×、300×和1 000× PEEE treatment of 0.18 mg∙mL-1, amplified by 50×, 100×, 300× and 1 000×, respectively;M—P:0.29 mg∙mL-1的PEEE处理,分别放大30×、100×、300×和1 000× PEEE treatment of 0.29 mg∙mL-1, amplified by 50×, 100×, 300× and 1 000×, respectively
2.3 质谱结果
在正离子模式下共检出肝脏代谢物6 364个,其中QC样本的基峰图(base peak intensity,BPI)和总离子流色谱图(total ion chromatogram,TIC)如图3所示,图右上角表示峰强度。BPI图中的峰型比较窄、数量多,表明色谱分离效果好。
2.4 PCA分析
从PCA得分图观察到对照(ep)和试验(nc)组的区分不明显,说明ep和nc组之间差异不明显(图4)。从图4还可以观察出ep组内的不同样本较nc组来说相对集中一些,说明ep组组内差异比nc组小。
2.5 OPLS-DA分析
图5为OPLS-DA模型得分图,由图可见ep和nc组有较好的区分,但nc组中有两个样本与ep组区分不明显,本试验中OPLS-DA模型的R2Y和Q2分别是73%和0,此结果显示该模型有良好的解释能力,但预测能力不佳,这可能与该模型过拟合有关。

图2 不同浓度石油醚萃取物(PEEE)处理下福寿螺肝脏超微结构

图3 QC样本正离子模式(ES+)BPI和TIC图

图中3种颜色分别代表3种样本分组,每个矩形代表这一个样本的代谢组降维处理后投射在二维平面上的位置

图中2种颜色分别代表2种样本分组,每个矩形代表这一个样本的代谢组降维处理后投射在二维平面上的位置
2.6 差异代谢物分析
本试验获得的QC样本CV值<30%、VIP>2、-value<0.05的差异代谢物共60个,其中鉴定出的代谢物46个。这60个代谢物中有36个代谢物上调,24个代谢物下调。
按照显著性由高到低(-value由小到大)进行排序,取前30个代谢物,进行层次聚类分析,如图6,颜色的深浅表示量的多少,由图可知,代谢物十六烷-1-醇(hexadecan-1-ol)的含量经PEEE处理后显著高于对照组。显著性位居前30的代谢物的名称及其变化见表2。
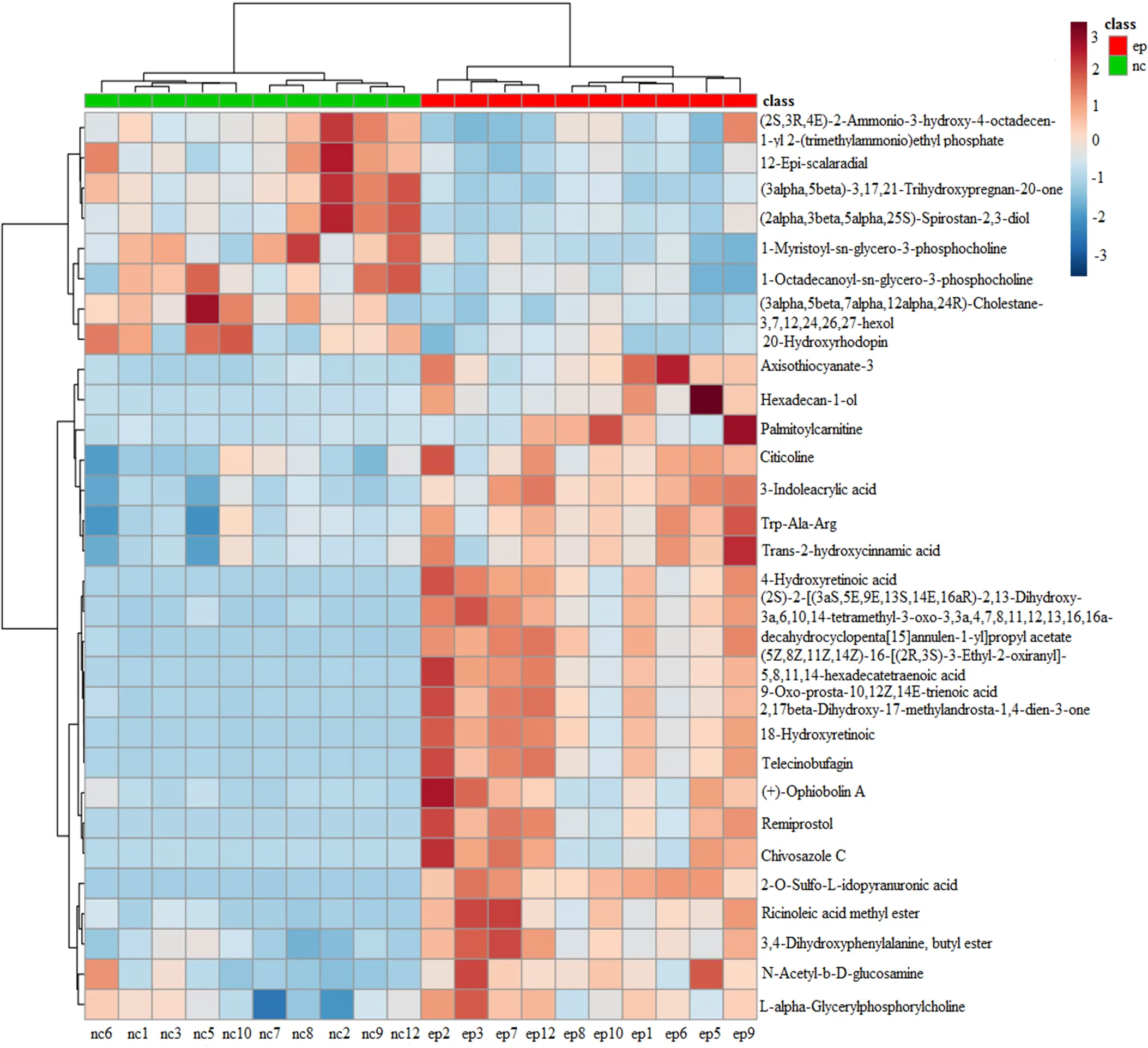
横坐标代表样品名称及样品的分类,纵坐标代表差异代谢物的聚类结果。颜色代表了代谢物峰强度。所用数据为正离子模式ep组、nc组比较的差异代谢物
2.7 代谢通路分析
将统计分析获取的差异代谢物数据输入IMPaLA中,选择超几何检验算法,将差异代谢物与数据库比对,获得差异代谢物参与通路列表,共匹配到10条显著富集的代谢通路(图7)。富集程度最高的两条通路分别为糖鞘脂代谢和棕榈酰辅酶A进入线粒体基质通路。
3 讨论
前期灭螺试验结果表明,加拿大一枝黄花乙醇提取物、石油醚萃取物(PEEE)、乙酸乙酯萃取物、水饱和正丁醇萃取物和水层剩余物对福寿螺均具有灭杀作用,且具有时间和浓度依赖性,但灭螺效果存在差异,其中PEEE的灭螺效果最佳(48 h IC50为0.18 mg∙mL-1)[22]。本试验在前期研究的基础上进一步探究了加拿大一枝黄花高效灭螺组分PEEE对福寿螺肝脏形态和超微结构的影响。由图1和图2可知,经不同浓度的PEEE浸泡处理48 h后,福寿螺肝脏失去弹性,容易破裂,有些部位已经出现破损;福寿螺肝细胞损伤严重,肝细胞内粗面内质网和线粒体数量减少,粗面内质网出现肿胀、断裂和颗粒脱落的现象,线粒体形状不规则,出现肿胀现象。夏枯草提取物和番石榴叶提取物具有增加大鼠肝糖原含量的作用[24-25]。从图2中可以观察到经PEEE处理后,肝脏细胞内出现了疑似组织肝脏特有结构,笔者推断为福寿螺肝脏受到PEEE伤害导致肝脏细胞内肝糖原含量的增加。
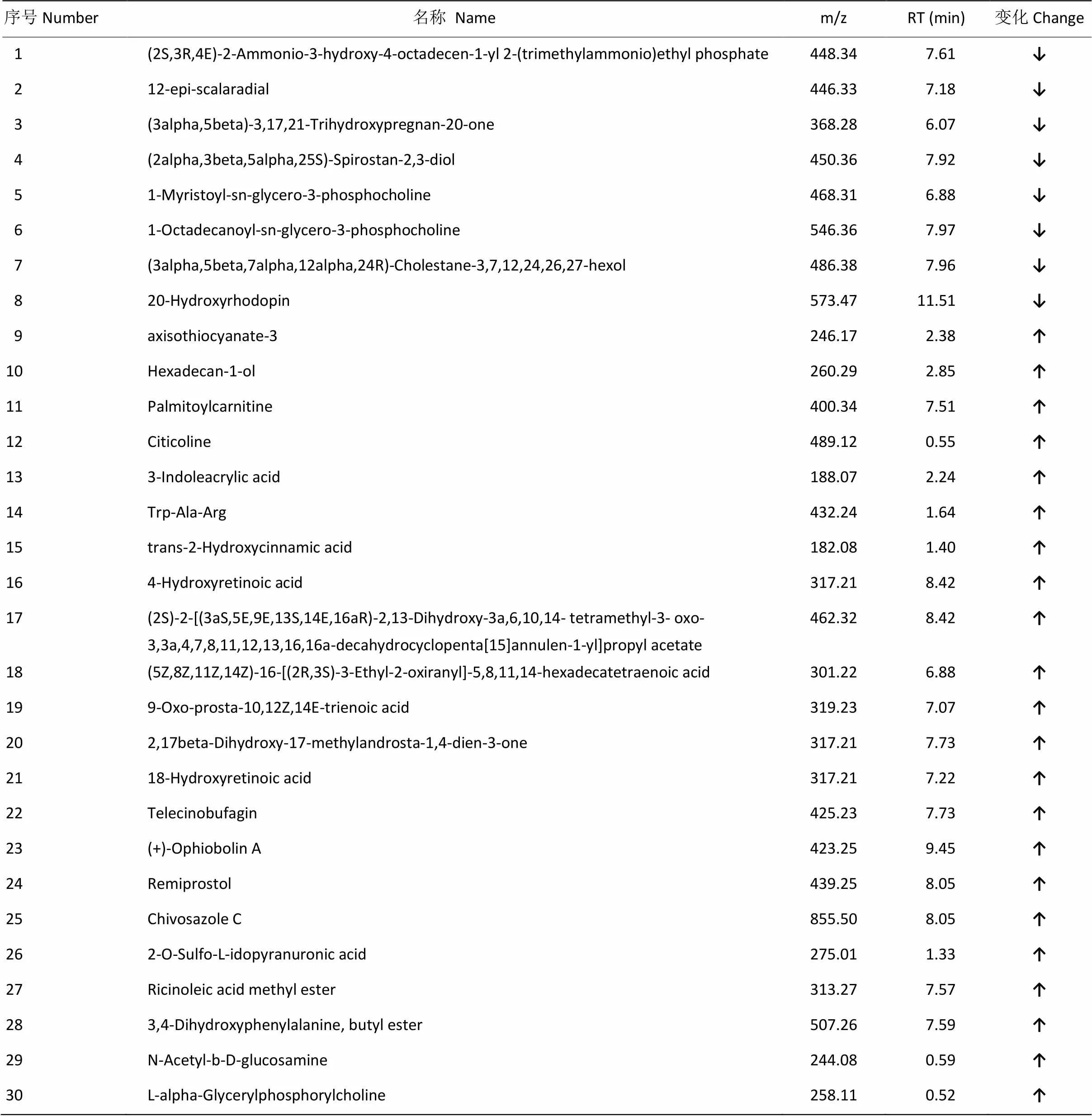
表2 福寿螺肝脏差异代谢物鉴定
代谢组学研究结果表明,经PEEE处理后,福寿螺肝脏的60种代谢物(表2)含量发生变化,多个代谢通路受到影响,富集程度最高的分别为糖鞘脂代谢和棕榈酰辅酶A进入线粒体基质这两条通路。但是对这两条代谢通路产生毒性的机理尚不明确,需要进一步的研究。肝脏在营养物质的代谢、葡萄糖和脂类的合成以及药物和异种物质的解毒中起着核心作用[26],它是新陈代谢的重要器官。推测PEEE之所以对福寿螺具有灭杀效果,是因为PEEE可导致福寿螺肝脏组织的严重损伤,导致其功能障碍和代谢紊乱,最终造成福寿螺死亡。
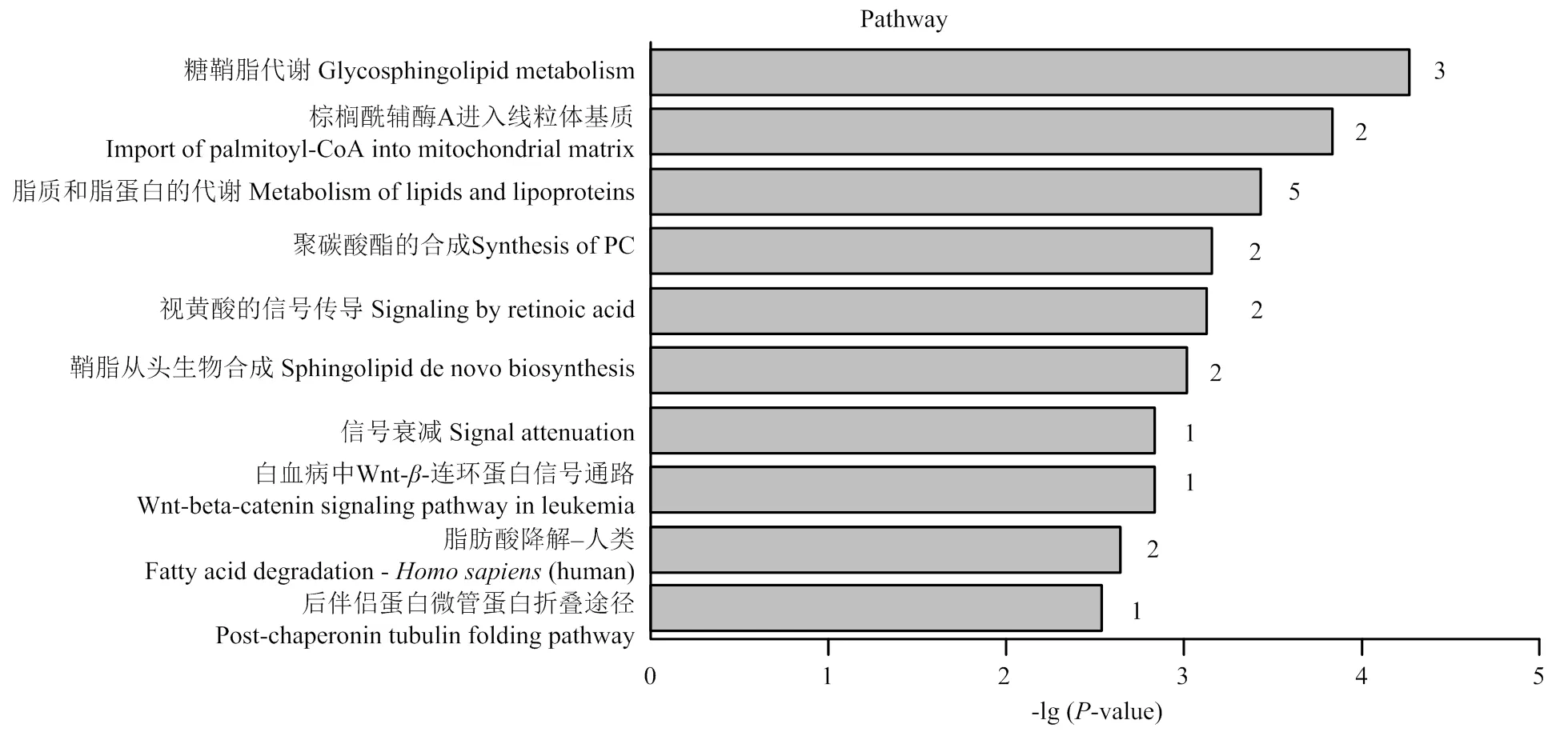
横坐标为-lg (P-value),越大表示差异表达代谢物在该通路中的富集显著性越可靠,纵坐标表示富集到的代谢通路,柱状图右侧的数字为本试验中的差异代谢物与此通路中的代谢物匹配数
近年来,植物源天然灭螺剂的研究呈上升趋势。宋春秀等研究表明,外来入侵植物薇甘菊()提取物具有一定的抑螺活性[27-28],对福寿螺的头、足、外壳及肝脏都有损伤[27];闫小红等研究表明,夹竹桃()提取物具有较强的灭福寿螺活性[29-30],可使肝脏的核膜破裂、内质网囊泡增多、扩张以及线粒体空泡化、肿胀[31];Ding等[32]研究发现,外来入侵杂草豚草()有效控制了水稻田中福寿螺的危害;刘席佑[14]研究发现,加拿大一枝黄花的根、茎、叶、花的乙醇提取物均对钉螺有一定的抑制作用。由此可见,植物源药物灭螺比化学药物灭螺更有优势,具有极大的潜在应用价值。
本研究表明,加拿大一枝黄花提取物的石油醚萃取物具有较强的灭螺活性,可望进一步研究开发并利用,使其变废为宝,实现对加拿大一枝黄花的资源化利用和有效防控,同时减少福寿螺对农业生产和人类健康的危害。
4 结论
经加拿大一枝黄花石油醚萃取物处理后,福寿螺肝脏组织失去弹性,容易破裂,表面出现破损;内部结构损伤严重,重要细胞器如线粒体遭到严重破坏;肝脏内的多个代谢通路受到影响。由此可见,加拿大一枝黄花石油醚萃取物对福寿螺肝脏的外部形态、内部结构和物质代谢均造成严重破坏,最终导致福寿螺的死亡,具有较强的灭螺活性。因此,加拿大一枝黄花提取物在抑螺药物的开发方面具有极大潜力。
[1] 中国科学院中国植物志编辑委员会. 中国植物志(第七十四卷). 北京: 科学出版社, 1985: 72-76.
Editorial Committee of Flora of China, Chinese Academy of Sciences.(). Beijing: Science Press, 1985: 72-76. (in Chinese)
[2] 毕玉科, 田旗, 卢钟玲, 李宏庆. 舟山岛外来植物及其入侵性分析. 福建林业科技, 2015, 42(1): 151-159, 172.
BI Y K, TIAN Q, LU Z L, LI H Q. Analyses on invasiveness of exotic plants in Zhoushan Island, Zhejiang, China., 2015, 42(1):151-159, 172. (in Chinese)
[3] 李小慧, 胡隐昌, 宋红梅, 王培欣, 汪学杰, 牟希东, 刘超, 罗建仁. 中国福寿螺的入侵现状及防治方法研究进展. 中国农学通报, 2009, 25(14): 229-232.
LI X H, HU Y C, SONG H M, WANG P X, WANG X J, MU X D, LIU C, LUO J R. Invasion and monitoring methods ofin China., 2009, 25(14): 229-232. (in Chinese)
[4] Cowie R H, Barker G M. Apple snails (Ampullariidae) as agricultural pests: their biology, impacts and management//. Wallingford, UK: CABI Publishing, 2002: 145-192.
[5] 杨叶欣, 胡隐昌, 李小慧, 汪学杰, 牟希东, 宋红梅, 王培欣, 刘超, 罗建仁. 福寿螺在中国的入侵历史、扩散规律和危害的调查分析. 中国农学通报, 2010, 26(5): 245-250.
YANG Y X, HU Y C, LI X H, WANG X J, MU X D, SONG H M, WANG P X, LIU C, LUO J R. Historical invasion, expansion process and harm investigation ofin China., 2010, 26(5): 245-250. (in Chinese)
[6] Naylor R. Invasions in agriculture: assessing the cost of the golden apple snail in Asia., 1996, 25(7): 443-448.
[7] 尉吉乾, 莫建初, 洪文英, 徐文, 许凤仙. 广州管圆线虫中间宿主福寿螺的综合防治研究进展. 中国媒介生物学及控制杂志, 2010, 21(5): 512-514.
WEI J Q, MO J C, HONG W Y, XU W, XU F X. Progress in integrated control of, intermediate host of., 2010, 21(5): 512-514. (in Chinese)
[8] 钟锋. 我国福寿螺防治技术研究进展. 世界农药, 2015, 37(6): 21-24.
ZHONG F. Research progress on control technology ofin China., 2015, 37(6): 21-24. (in Chinese)
[9] 吴淼生. 江西农业外来有害生物及其防治. 生物灾害科学, 2013, 36(4): 434-437.
WU M S. Prevention of agricultural exotic harmful organisms in Jiangxi Province., 2013, 36(4): 434-437. (in Chinese)
[10] 毕研云, 图立红, 李枢强, 刘月英. 我国常用的灭螺方法. 生物学通报, 2006, 41(11): 17-18.
BI Y Y, TU L H, LI S Q, LIU Y Y. The commonly used snail control methods in China., 2006, 41(11): 17-18. (in Chinese)
[11] 肖林飞, 廖列文. 新型灭螺剂的研究进展. 广东化工, 2012, 39(4): 26-27.
XIAO L F, LIAO L W. Research progress of the new molluscicide., 2012, 39(4): 26-27. (in Chinese)
[12] Archibald R G. The use of the fruit of the treein the control of schistosomiasis in the sudan., 1933, 27(2): 207-210.
[13] 黄炳生, 李明亚. 植物源灭钉螺药的研究进展. 中药材, 2012, 35(6): 1010-1013.
HUANG B S, LI M Y. Research progress of oncomelania killers from plants., 2012, 35(6): 1010-1013. (in Chinese)
[14] 刘席佑. 加拿大一枝黄花抑螺活性及其挥发油的GC-MS分析研究[D]. 南昌: 江西师范大学, 2016.
LI X Y. Studies on snails control activity and the GC-MS analysis of essential oil of[D]. Nanchang: Jiangxi Normal University, 2016. (in Chinese)
[15] Wu J P, Chen H C, Huang D J. Histopathological and biochemical evidence of hepatopancreatic toxicity caused by cadmium and zinc in the white shrimp,., 2008, 73(7): 1019-1026.
[16] Pinho G L, MOURA DA Rosa C, Yunes J S, Luquet C M, Bianchini A, Monserrat J M. Toxic effects of microcystins in the hepatopancreas of the estuarine crab(Decapoda, Grapsidae)., 2003, 135(4): 459-468.
[17] Dai L P, Wang W X, Dong X J, Hu R Y, Nan X Y. Molluscicidal activity of cardiac glycosides fromagainstand its implications for the mechanisms of toxicity., 2011, 32(2): 226-232.
[18] de Assumpção Pereira-da-Silva M, Ferri F A . 1-Scanning electron microscopy//. William Andrew, 2017: 1-35.
[19] Wang Z L. Transmission electron microscopy of shape-controlled nanocrystals and their assemblies., 2000, 104(6): 1153-1175.
[20] Nicholson J K, Lindon J C. Systems biology: Metabonomics., 2008, 455(7216): 1054-1056.
[21] Nicholson J K, Connelly J, Lindon J C, Holmes E. Metabonomics: a platform for studying drug toxicity and gene function., 2002, 1(2): 153-161.
[22] Shen X, Wang Z X, Liu L L, Zou Z Z. Molluscicidal activity ofL. extracts on the snailLam., 2018, 149: 104-112.
[23] World Health Organization. Molluscicide screening and evaluation., 1965, 33(4): 567-581.
[24] 田硕, 刘铜华, 孙文, 吴丽丽, 秦灵灵, 侯毅, 董笑克, 乐海波, 洪明昭. 夏枯草提取物对2型糖尿病ZDF大鼠肝糖原代谢的影响. 中国实验方剂学杂志, 2018, 24(10): 101-106.
TIAN S, LIU T H, SUN W, WU L L, QIN L L, HOU Y, DONG X K, YUE H B, HONG M Z. Effect ofextracts on hepatic glycogen in ZDF rats., 2018, 24(10): 101-106. (in Chinese)
[25] TELLA T, MASOLA B, MUKARATIRWA S. The effect ofaqueous leaf extract on liver glycogen enzymes, hormone sensitive lipase and serum lipid profile in diabetic rats., 2019, 109: 2441-2446.
[26] Chiang J Y L. Liver physiology: Metabolism and detoxification// McManus L M, Mitchell R N.. Elsevier, 2014: 1770-1782.
[27] 宋春秀, 章家恩, 罗明珠,赵本良,何铭谦. 薇甘菊浸提液对福寿螺主要器官组织损伤的扫描电镜观察. 生态环境学报, 2010, 19(8): 1876-1880.
SONG C X, ZHANG J E, LUO M Z, ZHAO B L, HE M Q. Damage of extracts fromon tissues of golden apple snails ()., 2010, 19(8): 1876-1880. (in Chinese)
[28] Zhao B L, Fang L, Zhang J E, An M, Wang R L, Luo M Z, Liang K M. Effects of five exotic invasive plants extracts on the survival of the invasive snail(Lamarck)., 2015, 36(1): 123-132.
[29] 闫小红, 周兵, 邹有, 蒋平, 许冬梅. 16种植物提取物对福寿螺杀螺效果的研究. 广东农业科学, 2011(4): 81-84.
YAN X H, ZHOU B, ZOU Y, JIANG P, XU D M. Efficacy of the extracts from sixteen plants againstSpix., 2011(4): 81-84. (in Chinese)
[30] 胡兴宜, 唐万鹏, 张玲, 荣新军. 夹竹桃等七种植物野外栽培灭螺效果的试验研究. 湖北林业科技, 2012(5): 7-9.
HU X Y, TANG W P, ZHANG L, LONG X J. Study on molluscicidal effect ofand other 6 kinds of plants in field cultivation., 2012(5): 7-9. (in Chinese)
[31] Dai L P, Qian X W, Nan X Y, Zhang Y J. Effect of cardiac glycosides fromon feeding rate, digestive enzymes activity and ultrastructural alterations of hepatopancreas in., 2014, 37(1): 220-227.
[32] Ding W B, Huang R, Zhou Z S, He H L, Li Y Z.as a potential resource for management of golden apple snails,(Lamarck)., 2018, 74(4): 944-949.
Effect of petroleum ether extract fromon liver of
LI ShuaiLan, SHEN Xiao, ZOU ZhengRong
(College of Life Science, Jiangxi Normal University/Key Laboratory of Protection and Utilization of Subtropical Plant Resources of Jiangxi Province, Nanchang 330022)
【】 On the basis of previous studies, the effect of petroleum ether extract of(PEEE) on the liver ofwas discussed in depth to provide a basis for further effective control the harm ofto agricultural production and realizing the resource utilization of the malignant alien invasive plant.【】Chlorinated tap water was used as the control group, and PEEE suspensions of 0.11, 0.18 and 0.29 mg∙mL-1were used as the experimental groups. In each group, 10 adultof the same size and vigor were randomly placed, and the beaker was sealed with a layer of gauze and rubber band to prevent thefrom escaping. At room temperature (23-27℃), the treatment was carried out for 48 h with 3 repetitions in each group. After 48 h, thetreated with dechlorinated tap water, 0.11, 0.18 and 0.29 mg∙mL-1were randomly selected, the shells ofwere broken and the liver was taken out, and the ultrastructure of liver tissue was observed by scanning electron microscopy and transmission electron microscopy. The liver tissue oftreated with 0.29 mg∙mL-1was lyophilized for metabonomics study. 【】The results of scanning electron microscopy showed that the liver surface ofwas damaged after soaking for 48 h with different concentrations of PEEE, and the degree of damage was positively related to the concentration of PEEE treatment solution. High concentrations of PEEE could cause liver atrophy and loss of elasticity, wrinkle bulge erosion, body surface damage, flocs and loose texture. The results of transmission electron microscopy showed that the liver cells ofwere damaged obviously after soaking for 48 h with different concentrations of PEEE. The number of rough endoplasmic reticulum and mitochondria in liver cells ofdecreased with high concentrations of PEEE, and the rough endoplasmic reticulum appeared swelling, breaking and degranulation. Mitochondria showed swelling and irregular shape. The results of metabonomic experiments showed that after PEEE treatment, the content of 60 metabolites in the liver ofchanged, and several metabolic pathways were affected. The two pathways with the highest enrichment were glycosphingolipid metabolism and palmitoyl-CoA entering mitochondrial matrix pathway.【】PEEE ofhas great damage and destruction to the liver cells of, so it has strong molluscicidal activity and is expected to be developed into a new natural molluscicidal drug with great potential development and application value.
; petroleum ether extract;; liver; scanning electron microscope; transmission electron microscope; metabonomics
2019-04-08;
2019-04-22
国家自然科学基金(31760099)、江西省教育厅科技项目(GJJ14249)
李帅岚,Tel:0791-88120393;E-mail:1499742358@qq.com。
邹峥嵘,E-mail:zouzhr@163.com
(责任编辑 岳梅)

