miR-106b在胃癌中对BTG3蛋白表达的调控机制
刘 培, 梁 坤, 杨玉玲, 孙力文, 边 城, 江月萍, 姜相君
1.青岛大学附属医院感染科,山东 青岛266555; 2.青岛市市立医院消化内科
恶性肿瘤治疗困难和预后不良的主要原因在于其易侵袭、转移,这也是胃癌死亡率居高不下的原因,胃癌的侵袭、转移与胃癌细胞的增殖活性密切相关。 BTG3蛋白属于抗增殖基因家族成员[1],是潜在的抑癌基因,研究显示,BTG3蛋白在多种肿瘤中表达降低,对肿瘤细胞的增殖及侵袭起负向调控作用[2-4],但其在胃癌中相关表达调控因素尚未阐明。miR-106b作为微小RNA,研究发现其异常表达可导致胃癌、肝癌等多种肿瘤的发生[5-6],有报道显示,其可通过调控BTG3蛋白的表达影响肺癌细胞的生长增殖[7],在胃癌细胞中两者之间的关系需要进一步证实。本实验通过分析胃癌、癌旁、癌前病变组织及对照组石蜡标本中BTG3蛋白表达情况,探讨BTG3蛋白在胃癌发生、发展中的作用及其与胃癌临床病理特征的关系。通过分析miR-106b在胃癌中的表达及其对BTG3蛋白表达的影响,进一步探讨BTG3蛋白在胃癌中的相关调控机制。
1 材料与方法
1.1 主要材料及试剂胃癌细胞株SGC-7901、正常永生化的胃壁细胞株GES-1购自上海中国科学院细胞库;RPMI-1640培养基、胎牛血清购自Gibco公司;S-P免疫组化试剂盒、DAB显色试剂盒北京中杉金桥;Lipofectamine 2000、Trizol试剂购自美国Invitrogen公司;M-MLV 逆转录酶购自Promega 公司,SYBR Premix Ex Taq试剂盒购自TaKaRa公司,miR106b模拟剂及抑制剂由GenePharma公司合成。BCA蛋白浓度测定试剂盒、RIPA裂解液购自Beyotime公司;PVDF膜购自Millipore公司;超敏ECL化学发光试剂盒购自Thermo Fisher公司;兔抗人BTG3一抗、兔抗人β-actin一抗、山羊抗兔二抗购自Abcam公司;荧光素酶活性检测试剂盒购自Promega 公司;荧光素酶报告载体Promega 公司合成。
选取2014年6月至2016年8月青岛大学附属医院和青岛市市立医院病理室存档的石蜡标本,包括手术切除胃癌组织及相应癌旁组织120对(癌旁组织取自距癌组织边界5 cm),男72例,女48例,年龄(55±0.5)岁(32~75岁);有淋巴结转移76例,无淋巴结转移44例;低分化腺癌56例,中分化腺癌34例,高分化腺癌30例;H.pylori阳性69例,H.pylori阴性51例。同期慢性萎缩性胃炎伴上皮内瘤变(伴或不伴肠化生)组织116例为癌前病变组,男54例,女62例,年龄(56±0.5)岁(35~72岁),高级别上皮内瘤变61例,低级别上皮内瘤变55例。胃镜活检的浅表性胃炎石蜡标本110例作为对照组,男66例,女44例,年龄(53±0.5)岁(28~75岁)。所有胃癌患者术前未行化疗、放疗和其他辅助治疗,并确认手术标本切缘为阴性,癌前病变组织所对应患者均无其他合并症,本实验经过青岛大学附属医院和青岛市立医院医学伦理委员会同意。
1.2 研究方法
1.2.1 免疫组化及结果判定:石蜡包埋的各胃黏膜组织,包括胃癌组织、癌旁组织、癌前病变组织及对照组织,常规行石蜡切片,厚4 μm。按照S-P免疫组化染色试剂盒说明书操作,光镜下计数和拍照,观察BTG3蛋白表达情况。结果判定:BTG3蛋白阳性表达于细胞质中,呈黄色颗粒。随机选取5个视野,每个视野计数100个细胞。检查组织染色强度:按切片中细胞显色有无及染色深浅记分,细胞无染色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。检查肿瘤细胞阳性染色比例:<10%为1分,10%~50%为2分,>50%为3分。然后按照“染色深浅程度×阳性细胞得分”计总分(0分,-;1~2分,+;3~5分,++;6~9分,+++)。用已知阳性片和PBS代替一抗分别作为阳性对照及空白对照。
1.2.2 细胞培养:胃癌细胞株SGC-7901及人胃黏膜细胞GES-1培养体系为质量浓度为100 g/L的FBS、100 U/ml链霉素和100 U/ml青霉素的1640培养液,在体积分数为5%的CO2,37 ℃,饱和湿度的培养箱中常规培养。将生长90%汇合的细胞加入质量浓度为2.5 g/L胰蛋白酶消化细胞进行传代。
1.2.3 qRT-PCR检测胃癌细胞中BTG3、miR-106b表达:Trizol法提取细胞总RNA,紫外分光光度计检测RNA的浓度和纯度。mRNA采用M-MLV操作说明逆转录合成cDNA,miRNA采用miRNA逆转录试剂盒合成cDNA。SYBR Premix Ex Taq试剂盒进行实时PCR。PCR反应条件为: 95 ℃ 预变性30 s,95 ℃ 变性5 s,60 ℃退火30 s,45个循环,延伸阶段读取吸光值。PCR结束后,95 ℃变性1 min,后冷却至55 ℃,制作熔解曲线分析。mRNA以GAPDH为内参,miRNA以U6为内参,应用2-ΔΔCt法进行结果分析,所用引物见表1。

表1 qRT-PCR引物序列Tab 1 Primer sequences of qRT-PCR
1.2.4 Western blotting检测BTG3蛋白表达:miR-106b 模拟物及抑制物分别转染胃癌细胞SGC-7901,收集转染后的对数生长期细胞,加入RIPA裂解液,进行蛋白定量,95 ℃加热变性,对样品进行SDS-聚丙烯酰胺凝胶电泳,转至PVDF膜,一抗二抗孵育后,用ECL方法显色,获取BTG3蛋白质信号条带图像并分析。用目的蛋白条带的灰度值与内参β-actin条带的灰度值之比即为目的蛋白的相对含量。
1.2.5 双荧光素酶报告实验:生物信息学方法预测BTG3与miR-106b的结合位点并体外克隆扩增,设计具有预测靶位点的BTG3-3′UTR 野生序列或突变序列,构建入pGL3-basic载体中,突变的3′-UTR区作为对照组。转染前1 d将SGC7901细胞种植到24孔板(2×104个/孔)上,并与构建的荧光素酶报告载体(0.5 μg)和20 μmol/L miR-106b 模拟物或阴性对照模拟物共转染,使用双荧光素酶报告基因测定试剂盒,转染48 h后进行光密度测定。实验重复3次。
1.3 统计学分析采用SPSS 22.0和Graph Pad Prism 5软件进行统计学分析。t检验用于两项指标间的比较,单因素方差分析用于多项指标间的比较,计数资料以例数/%表示,率的比较采用χ2检验、Fisher确切概率法或Mann-WhitneyU检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同胃黏膜组织中BTG3的表达BTG3蛋白阳性表达于细胞质中,呈黄色或棕色颗粒(见图1)。BTG3阳性表达率分别为胃癌组 32.50%(39/120)、癌旁组65.00%(78/120),慢性萎缩性胃炎组60.34%(70/116)、浅表性胃炎对照组71.82%(79/110)。胃癌组BTG3蛋白表达率较低,与其他各组比较,差异有显著统计学意义(P<0.01)。癌旁组、慢性萎缩性胃炎组与对照组比较,差异无统计学意义(P>0.05)。
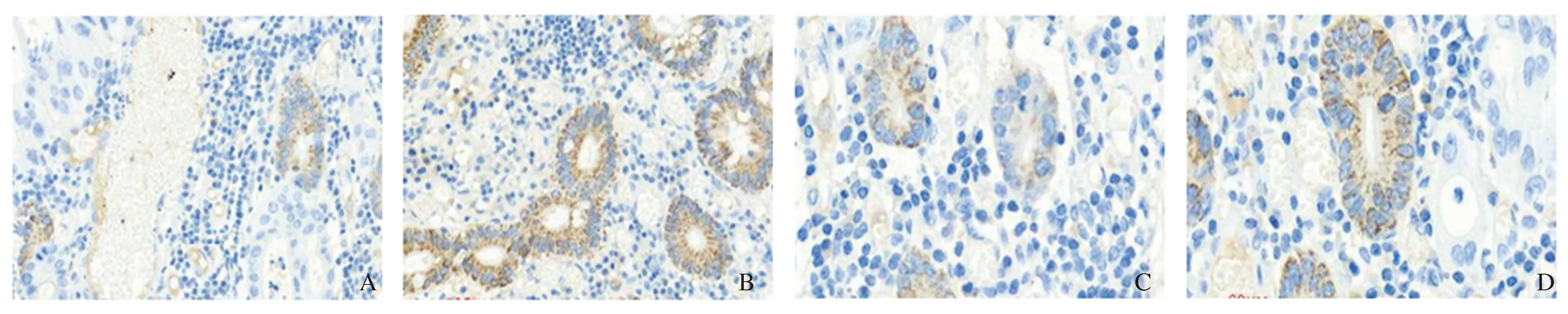
图1 胃癌及癌旁组织BTG3蛋白表达(S-P免疫组化染色) A:胃癌(100×);B:癌旁组织(100×);C:胃癌(300×);D:癌旁组织(300×)Fig 1 Expression of BTG3 protein in gastric cancer and adjacent tissues (SP immunohistochemical staining) A: gastric cancer (100×);B: adjacent tissues (100×); C: gastric cancer (300×);D: adjacent tissues (300×)
2.2 BTG3蛋白表达与胃癌临床病理特征的分析120例患者胃癌组织按临床病理特征分组比较,结果显示,BTG3蛋白表达与胃癌肿瘤分期(P=0.041)及肿瘤分化程度(P=0.021)有关,胃癌分期越晚或肿瘤分化程度越低,BTG3蛋白表达也随着明显降低;与年龄(P=0.581)、性别(P=0.524)、淋巴结是否转移(P=0.275)无明显相关性,本课题组首次分析了胃癌中H.pylori感染与BTG3蛋白表达之间的关系,H.pylori阳性胃癌组织中BTG3蛋白表达率与H.pylori阴性组比较,差异有统计学意义(P=0.017)(见表2)。
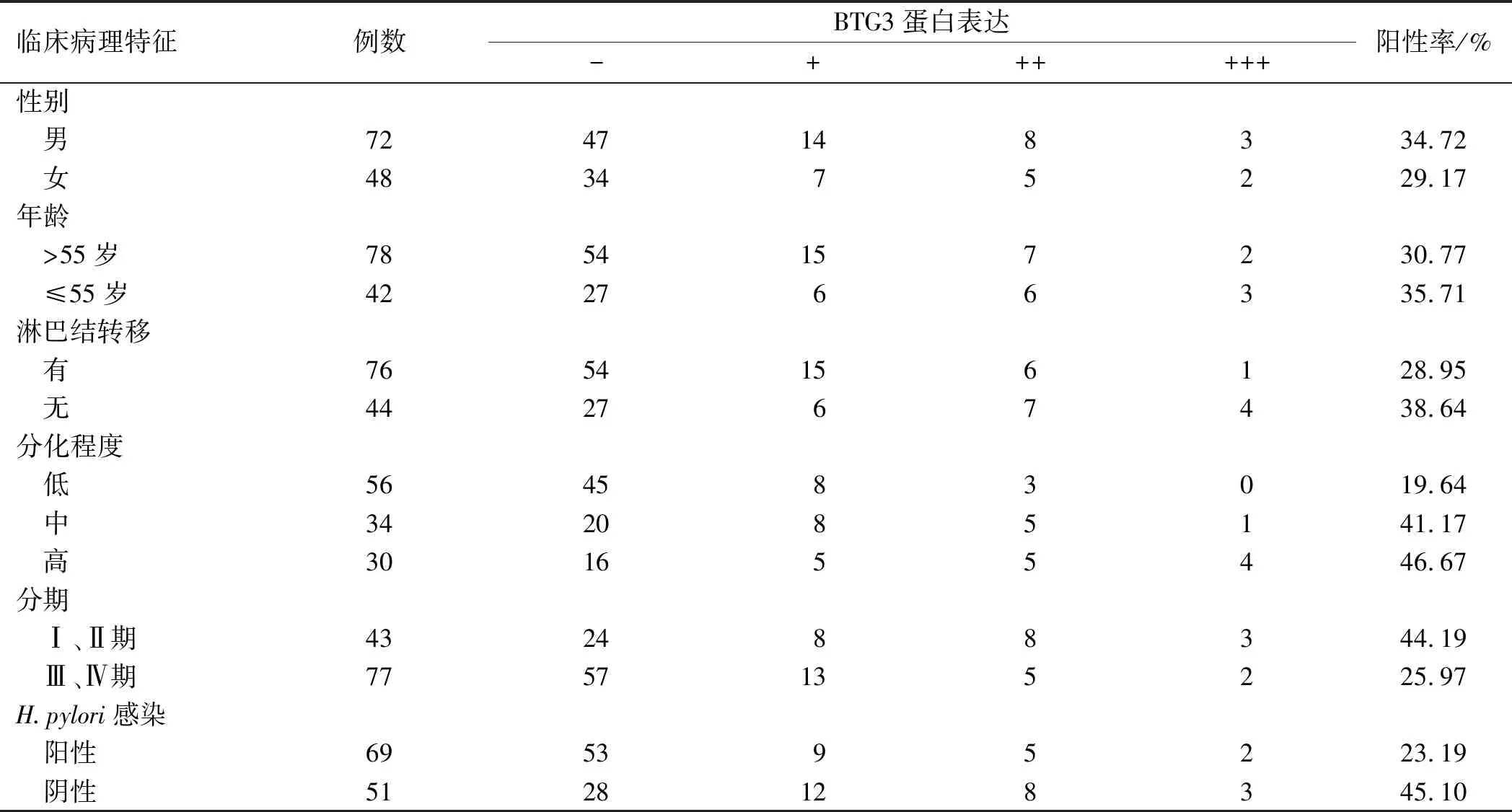
表2 BTG3蛋白表达与临床病理特征分析Tab 2 Expression of BTG3 protein and analysis of clinicopathological features
2.3 BTG3在胃癌细胞中的表达qRT-PCR结果显示,BTG3 mRNA在胃癌细胞SGC-7901组(0.43±0.24)、永生化胃壁细胞GES-1组(1.137±0.58)、胃癌细胞中BTG3蛋白表达水平与对照组比较,差异有显著统计学意义(P<0.001)(见图2)。
2.4 miR-106b在胃癌细胞中的表达miR-106b mRNA在胃癌细胞SGC-7901组(4.099±0.115)、永生化胃壁细胞组(1.037±0.034),miR-106b在胃癌细胞中mRNA表达水平较高,差异有显著统计学意义(P<0.001)(见图2)。
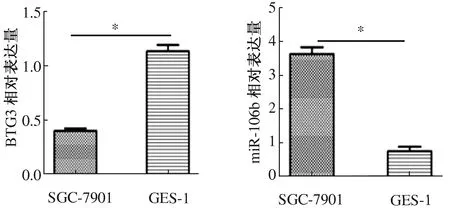
注:*P<0.001。
2.5 上调及下调胃癌细胞中miR-106b对BTG3蛋白表达的影响将miR-106b模拟物(miR-106b-mimic)及抑制物(miR-106b-ASO)分别转染胃癌细胞SGC-7901,采用Western blotting方法检测BTG3蛋白表达差异。结果显示,转染miR-106b模拟物后,胃癌细胞miR-106b表达上调,而BTG3蛋白表达水平明显降低(P<0.001),转染miR-106b抑制物后,胃癌细胞miR-106b表达下调,而BTG3蛋白表达水平明显升高(P<0.001),结果提示BTG3受miR-106b负调控(见图3)。
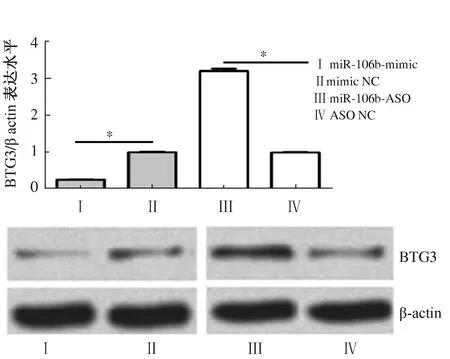
注:*P<0.001。
2.6 双荧光素酶报告实验为了研究miR106b在胃癌细胞SGC-7901中是否直接调控BTG3表达,设计构建荧光素酶报告基因载体,将pGL3-BTG3-3′UTR或pGL3-BTG3-3′UTR mut与miR-106b模拟物(或模拟物阴性对照)共转染胃癌细胞系SGC-7901,采用荧光素报告基因实验进行检测。BTG3-3′UTR与miR-106b结合区序列及突变位点如图4所示。结果显示,转染miR-106b模拟物后,含有野生型BTG3-3′UTR的报告质粒荧光素酶活性明显下降(P<0.001);含有突变型BTG3-3′UTR报告质粒的荧光素酶活性无明显影响(P>0.05),结果提示在基因水平上BTG3受miR-106直接调控。
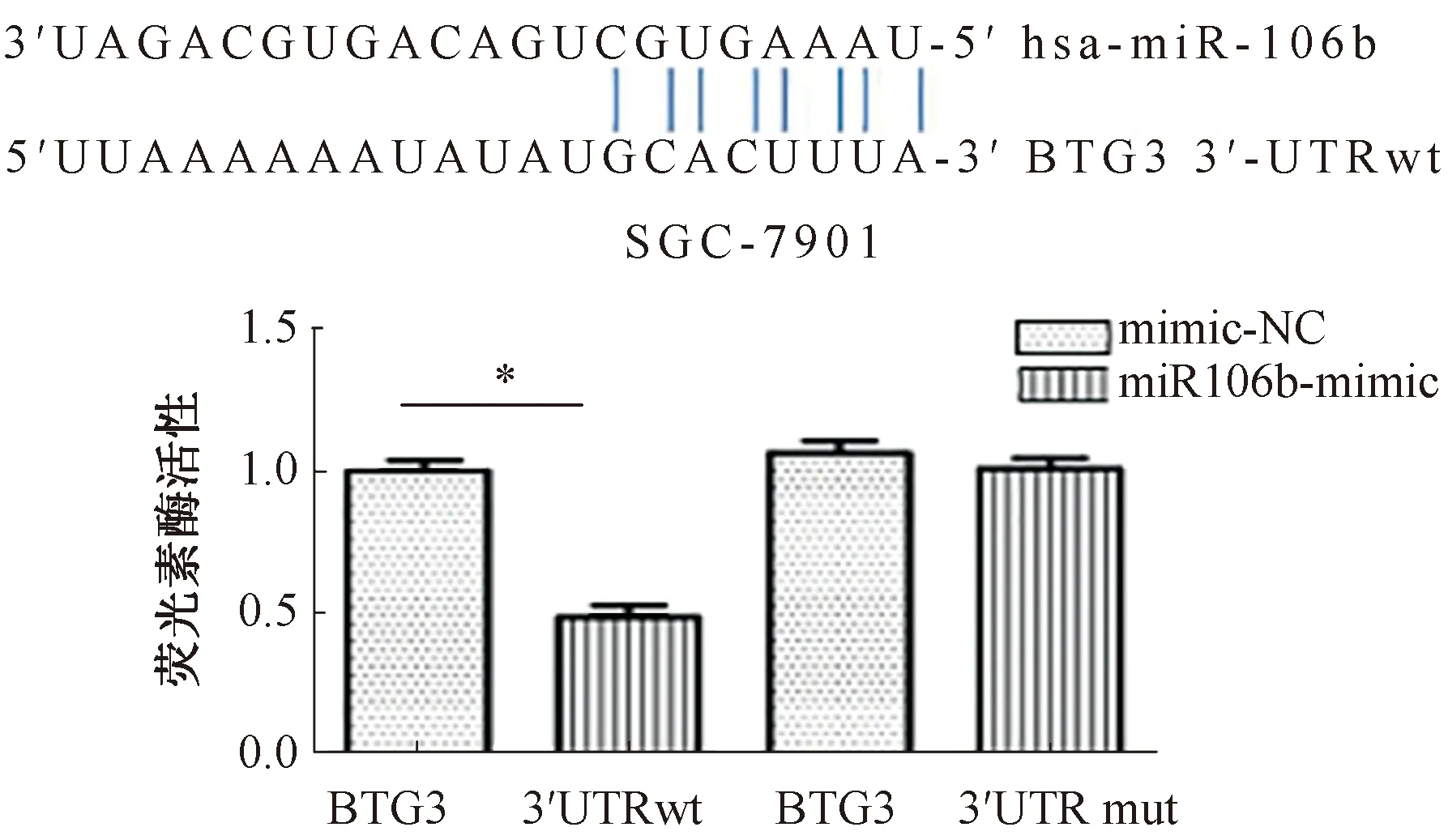
注:*P<0.001。
3 讨论
BTG3属于BTG/Tob(B-cell translocation gene/transducer of erbB2,B细胞迁移基因/erbB2转录因子)家族,具有抑制细胞增殖、调控细胞生长、促使细胞分化、参与细胞DNA损伤修复等功能。文献报道[2-4]显示,BTG3在胃癌等多种肿瘤中表达降低,但在胃癌前病变组织中研究较少,本研究选取癌前病变组织为慢性萎缩性胃炎伴上皮内瘤变组织,通过免疫组化方法研究胃癌组及癌前病变等组织中BTG3蛋白的表达。结果显示,BTG3 蛋白主要定位于细胞胞浆内,慢性浅表性胃炎对照组织及癌前病变组织均有不同程度的表达,两组BTG3蛋白表达无明显差别,而胃癌组织中BTG3蛋白表达较对照组明显降低,与既往研究[2-4]一致。与胃癌各临床病理特征研究中发现,BTG3蛋白表达与胃癌肿瘤分期及分化程度有关,肿瘤组织的分化程度越低,胃癌分期越晚,BTG3蛋白的表达也越低。另外qPCR结果也发现胃癌细胞中BTG3表达也较低,故本研究证实BTG3低表达与胃癌发生发展密切相关。另外本研究首次分析了胃癌中H.pylori感染与BTG3蛋白表达的关系,发现BTG3在H.pylori阳性的胃癌组织比H.pylori阴性组织中表达降低,差异有统计学意义,其间相关联系需要深入研究。
BTG3虽在多种肿瘤中表达异常,但其表达调控机制尚未完全阐明。miRNA作为新的基因调控的形式,其异常表达与肿瘤发生、发展相关[8],miR-106b在多种肿瘤中已做探讨,如在胶质瘤中通过靶向调控RBL1、RNL2和CASP8发挥直接的促癌作用[9]。在喉癌中通过影响RUNX3来对肿瘤细胞增殖、侵袭调控[10]。本研究也发现在胃癌细胞SGC-7901中miR-106b表达较高。有研究[7]发现其非小细胞肺癌中可通过调控BTG3在发挥作用,本实验探讨其在胃癌细胞中是否也能调控BTG3。Westen blotting方法检测结果发现,在胃癌细胞SGC-7901中上调或下调胃癌细胞miR-106b后,BTG3蛋白表达水平也相应降低或升高,荧光素酶报告基因实验显示转染miR-106b模拟剂后报告质粒荧光素酶活性降低。两种实验结果提示在胃癌细胞中miR-106b可负性调控BTG3表达,BTG3与细胞增殖活性有关,故miR-106b有可能通过BTG3来发挥其对胃癌细胞的恶性调控。
综上所述,BTG3在胃癌发生、发展中起着重要作用,与miR-106b关系密切,表达受miR-106b直接调控。对BTG3上下游调控基因的探讨,有利于阐明其在肿瘤发生发展中作用机制,有可能成为胃癌基因治疗新靶点。

