半乳糖流加对CHO细胞生长代谢及其表达的Fc融合蛋白糖基化的影响
肖政 范里 谭文松
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
哺乳动物细胞尤其是CHO细胞因具备完善的糖基化等翻译后修饰系统,成为目前表达药用蛋白最重要的宿主细胞[1]。葡萄糖作为最主要的碳源物质被广泛运用于CHO细胞的培养过程。作为主要负责CHO细胞中转运葡萄糖的转运蛋白,Glut-1具有很高的跨膜转运活性(Km=1-2 mmol/L),因此培养液中的葡萄糖会被快速转运至胞浆内,经糖酵解途径生成大量丙酮酸。但丙酮酸进入线粒体受到细胞的严格调控,因此多余的丙酮酸会经乳酸脱氢酶作用转化为乳酸[2]。乳酸的累积对细胞的生长、代谢和产物表达都会造成不利的影响[3]。糖基化作为一种重要的蛋白质翻译后修饰,对药用蛋白的生物学活性、溶解性以及半衰期等均发挥着重要作用[4]。唾液酸是蛋白类药物糖基化修饰的一种重要形式。糖代谢过程中产生的UDP-半乳糖作为糖基单元参与唾液酸前体合成,随后在细胞质中合成唾液酸并经载体转运到高尔基体中,在唾液酸转移酶的作用下将唾液酸连接到蛋白糖链末端的半乳糖上[5]。
半乳糖结构与葡萄糖类似,不过它主要通过细胞膜上的转运蛋白Glut-4(Km=10 mmol/L)进入胞内,在半乳糖激酶和1-磷酸半乳糖尿嘧啶转移酶的作用下生成UDP-半乳糖[6]。UDP-半乳糖可以通过异构酶的作用生成6-磷酸葡萄糖,作为碳源进入糖酵解和TCA循环供给能量。由于转运蛋白Glut-4的转运活性远低于Glut-1,因此半乳糖进入细胞的速率也远小于葡萄糖进入细胞的速率,培养液中乳酸的累积浓度也低于采用葡萄糖作为碳源的培养过程。由此可见,半乳糖是葡萄糖理想的碳源替代物,具有显著改善细胞代谢和提高蛋白质量的可能。
本研究在补料分批培养过程中,通过将补料培养基中的葡萄糖用等摩尔的半乳糖进行替换考察以半乳糖为碳源的培养过程中CHO细胞的生长代谢和Fc融合蛋白的合成特性,了解营养物消耗和代谢副产物累积的规律,认识半乳糖浓度对细胞生长、营养物消耗、乳酸代谢、产物合成和产物糖基化的影响,旨为建立高产、高质的流加培养过程。
1 材料与方法
1.1 材料
实验用细胞为表达Fc融合蛋白的CHO细胞株。传代及基础培养基由21.21 g/L的EX-CELL 302无血清培养基配制而成,并添加1.6 g/L的NaHCO3和2 mmol/L的Glutamine;补料培养基由我室自主研发,由多种氨基酸、维生素以及葡萄糖组成,从接种第2天起每天补加初始培养体积的3%,补料培养基中半乳糖等摩尔替代葡萄糖的实验设计如表1所示。本文中提到的试剂如未特殊说明均购自Sigma公司。
1.2 方法
1.2.1 种子细胞培养 从细胞库中复苏CHO细胞,以5.0×105cells/mL的活细胞密度接种于125 mL摇瓶中(Corning),接种体积为30 mL,置于37℃、5%CO2饱和湿度的培养箱中进行悬浮培养,摇床转速为110 r/min。每隔2 d进行种子细胞传代扩增,传代后活细胞密度控制在5.0×105cells/mL左右。
1.2.2 摇瓶内补料培养 取指数生长期的CHO种子细胞经1 000 r/min离心5 min,弃上清,用新鲜基础培养基进行重悬并以1.0×106cells/mL的起始密度接种于125 mL摇瓶内,初始工作体积为40 mL,摇床转速设置为110 r/min,培养箱条件设置为5%的CO2浓度和37℃的温度,每个条件重复3次。每天取0.8 mL细胞液用于细胞计数、生长代谢和产物表达的检测分析。
1.2.3 反应器内补料培养 反应器内的流加培养过程于 2 L的 BIOSTAT®B(B.Braun,Germany)反应器中进行。接种密度为1×106cells/mL,初始工作体积为1 L。培养条件设置:搅拌转速设置为80 r/min,溶氧为40%,pH设置为7.0,采用通入CO2或补加NaOH的方式进行pH控制,培养温度设定为37℃。
1.2.4 细胞计数 取样0.1 mL 置于48孔板内,稀释到适宜密度后,加入等体积0.4%台盼蓝溶液进行染色,吹打均匀后,用血球计数板计数,每个样品计数3次,结果取平均值。
1.2.5 Fc融合蛋白表达量的检测 采用的高效液相系统为Waters 2487 HPLC System(1525 Binary HPLC Pump ;717 plus Autosampler,2487 UV Detector,Waters), 色 谱 柱 为 PA immune detection sensor cartridge(2.1 mm×3 cm,Applied Biosystem,USA),流动相为A相:pH为7.4的PBS缓冲液,B相:pH为3的磷酸缓冲液。进样量为20 μL,检测波长为280 nm,A相前3 min以1 mL/min的流速平衡,第3分钟到第12分钟以1 mL/min的B相进行等梯度洗脱。
1.2.6 培养液中氨基酸浓度的检测 氨基酸浓度采用高效液相色谱(1525 Binary HPLC Pump;717 plus Autosampler;2475 Multi λ Fluorescence Detector,Waters)测定。样品采用AccQ·Fluor 试剂(Waters)按使用说明进行柱前衍生和检测。
1.2.7 培养液中葡萄糖、氨和乳酸浓度的测定 葡萄糖、乳酸和氨浓度采用全自动生化分析仪BioProfile 400 Analyzer(Nova Bio-medical,USA)测定。
1.2.8 培养液中半乳糖浓度的检测 采用EnzyChromTMGalactose Assay Kit(BioAssay System),分别按相应使用说明进行测定。
1.2.9 Fc融合蛋白的纯化 Fc融合蛋白采用亲和层析的方法进行纯化,层析柱为HiTrap Protein A HP(GE Healthcare),具体方法步骤见产品说明书。
1.2.10 总唾液酸含量的检测 总唾液酸含量依据《中国药典》(第三部)中间苯二酚的方法进行检测。
1.2.11 N -连接糖基化分布的检测 N-连接的糖基化分布采用Kim等[7]检测方法。
1.2.12 数据分析 Fc融合蛋白的比生成速率qFcfusionprotein(mg/109cells/day)通过以下公式进行计算:
其中P为Fc融合蛋白浓度(mg/L);IVCC为活细胞密度对时间的积分(109cells·day/L)。
2 结果
2.1 半乳糖替代葡萄糖补料培养对细胞生长代谢和产物表达的影响
2.1.1 对CHO细胞生长的影响 以1×106cells/mL的密度接种后细胞立即进入指数生长期,6个培养过程在前期体现出相似的生长趋势,平均比生长速率约为0.73 day-1,96 h后细胞生长明显减慢(图1)。96 h后,GF5细胞出现快速死亡,168 h后其活细胞密度跌至3.88×106cells/mL,活性降为28.8%。同样,GF4过程(80%替代比例)在192 h也出现了快速死亡的现象,240 h时其活细胞密度仅为2.16×106cells/mL,活性仅为26.3%,而其他培养过程细胞均维持较好的活性,同时培养终点时的活细胞密度也维持在9×106cells/mL左右。
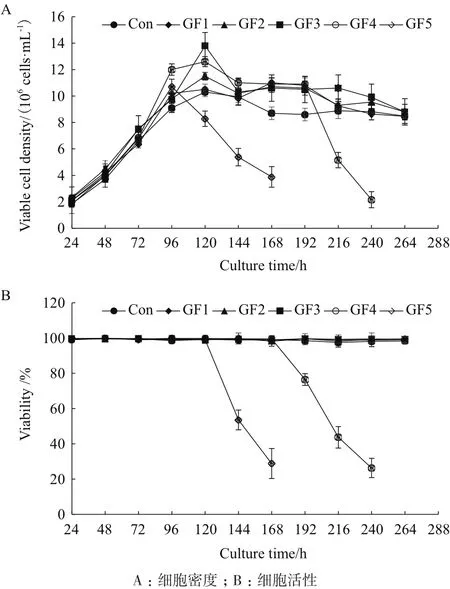
图1 补料培养基中半乳糖替代对细胞生长的影响
2.1.2 对CHO细胞代谢的影响 代谢方面,GF5过程葡萄糖在接种后48 h即消耗至零。随着半乳糖替代比例的降低,葡萄糖耗竭的时间依次推后,GF4在96 h时葡萄糖浓度跌至0 mmol/L,GF3在120 h时葡萄糖浓度跌至0 mmol/L。而0%-60%半乳糖替代范围内由于补料培养基中的葡萄糖被替代程度更低,足以满足细胞对葡萄糖的需求,因此GF2的葡萄糖浓度在整个培养过程中都维持在10-15 mmol/L之间,Con和GF1的葡萄糖浓度则是随着培养时间的延长而不断升高,出现逐渐累积的现象(图2-A)。
与葡萄糖代谢对应的,48 h葡萄糖浓度跌至0 mmol/L后,GF5的乳酸生成速率比开始明显降低,72 h后乳酸由生成转化为消耗状态,最终到144 h其浓度跌至16.4 mmol/L。GF4也是当96 h葡萄糖耗竭时,乳酸被重新利用,最终减少至20 mmol/L左右。虽然GF3后期的葡萄糖浓度也跌至0 mmol/L,但并没有引起的乳酸的再利用。其他几组由于未出现葡萄糖耗竭的情况,乳酸浓度都随着培养过程的进行而不断升高,最终达到了45 mmol/L左右,3组之间的乳酸代谢没有显著性差异(图2-B)。以上结果说明,在葡萄糖充足的情况下,CHO细胞以利用葡萄糖为主,当葡萄糖耗竭后,乳酸会被细胞重新利用[8]。
半乳糖的替代流加也引起了CHO细胞氨代谢的变化。GF5的氨浓度从96 h开始快速累积,最终达到了12 mmol/L左右,GF4过程中氨的浓度从120 h开始同样有明显升高,终浓度也达到了10 mmol/L以上。与乳酸代谢类似,Con、GF1、GF2和GF3最终的氨浓度也都随着培养过程的进行而缓慢升高,最终达到了6 mmol/L左右(图2-C)。
通过生化分析仪对各个培养过程的pH进行离线检测(图2-D),从对应过程的pH变化趋势来看,GF4和GF5过程中pH值的升高很有可能与氨浓度的升高密切相关[9]。GF5的pH值从48 h开始快速上升,到120 h达到最高为7.8。同样,GF4的pH值在96 h后开始快速升高,后期维持在7.6左右。而其他各组在整个培养过程中的pH均维持在6.7-7.0之间,在CHO细胞的正常耐受范围内。
因为GF5的细胞较早地出现了死亡,因此只考察了其他过程的氨基酸代谢情况。图3所示为244 h时培养液中各氨基酸的浓度情况。由图可知,244 h时各过程下氨基酸的浓度基本一致,只有Glu、Gln和Ala三者显示出了较大的区别。随着半乳糖替代比例的增加,Glu的浓度不断升高,其中GF5过程达到了2 146 μmol/L,是Con过程的1.7倍。同时,随着半乳糖浓度的升高,胞外Gln的浓度逐步减少,其中GF5的最终浓度仅为112 μmol/L,几乎消耗殆尽。结合各个过程中Gln和Glu的浓度趋势以及氨代谢,说明在半乳糖替代比例较高的情况下,可能是葡萄糖代谢提供的能量有限,细胞转向消耗Gln以提高能量供应,因此其胞外的Gln浓度会随着半乳糖替代比例的增加而逐步降低,而Gln的代谢产物Glu和氨会逐渐增加。此外,Ala浓度随着半乳糖替代比例的增加而升高,这可能与乳酸代谢有关。
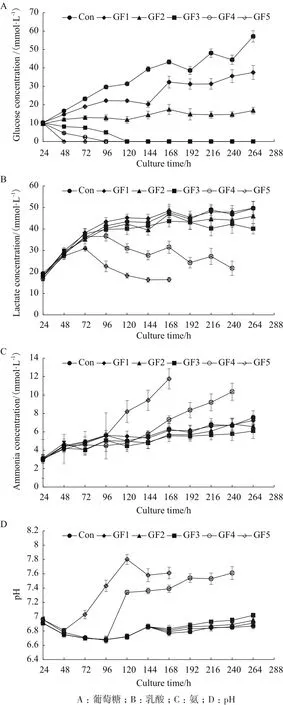
图2 补料培养基中半乳糖替代对细胞代谢和pH的影响
2.1.3 半乳糖替代补料培养对Fc融合蛋白表达的影响 蛋白表达方面,在较低半乳糖替代范围内(0%-
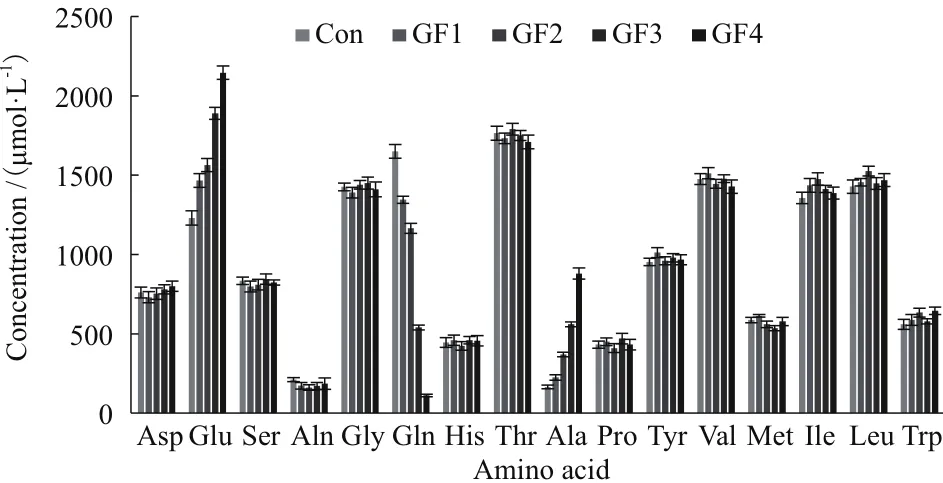
图3 补料培养基中半乳糖替代对氨基酸代谢的影响
40%),随着半乳糖替代程度的增加蛋白表达量逐步增加,其中GF2最终达到了853 mg/L,是Con的1.21倍(图4-A)。随着替代比例的进一步增加,Fc融合蛋白的表达量反而逐渐下降,其中GF4仅为633 mg/L,是Con的85%,这可能是由于后期细胞的代谢出现更大的转变,细胞维持能力变差引起的。
唾液酸是Fc融合蛋白最重要的质量属性之一,半乳糖的流加对其影响趋势与其对蛋白表达量的影响十分一致(图4-B)。同样是在较低半乳糖替代比例(0-40%)内,Fc融合蛋白的唾液酸含量随着半乳糖浓度的升高而升高,其中GF2达到了57.02 μg/mg,比对照组提高了30%左右。但进一步增加半乳糖的替代比例,并没有增加Fc融合蛋白的唾液酸含量,其中GF4过程反而比对照组减少了16%(图4-B)。结合对应过程的氨代谢及pH,很有可能是在更高半乳糖的替代情况下,氨的过量生成抑制了胞内GDP-GNAc的合成,造成了Fc融合蛋白唾液酸合成前体的缺乏。
2.2 全部半乳糖替代对培养过程的影响
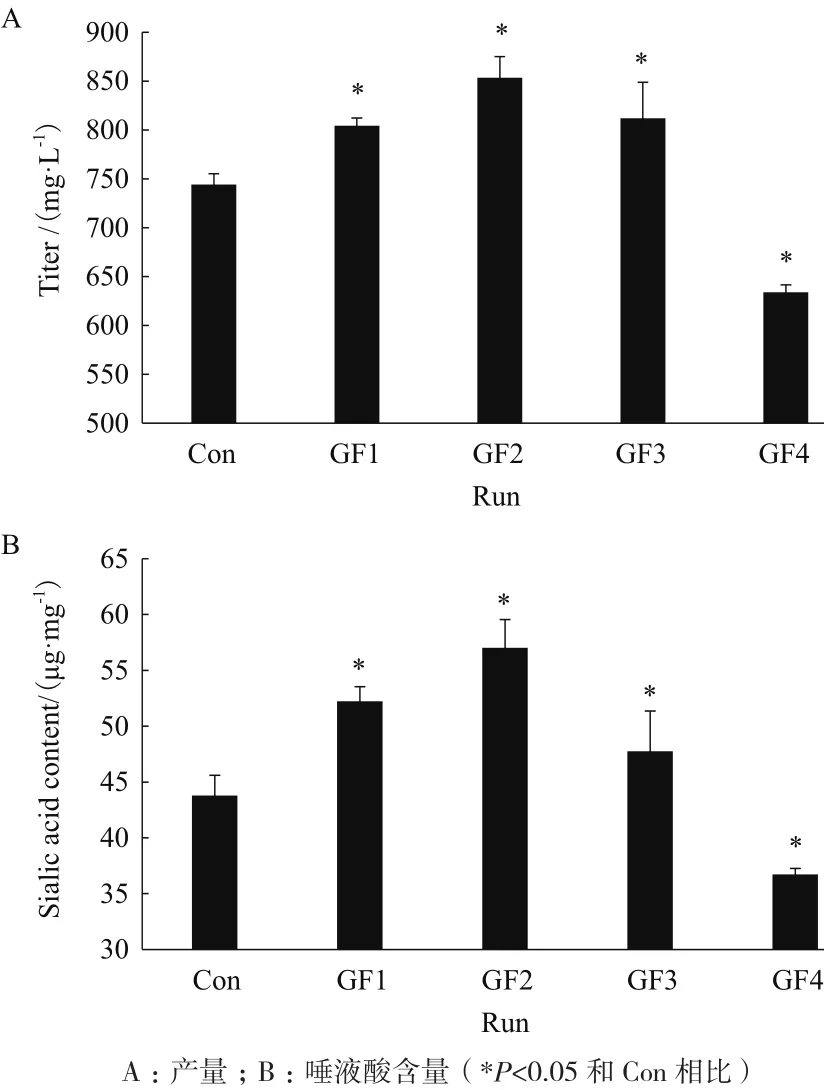
图4 补料培养基中半乳糖替代对Fc融合蛋白表达的影响
为排除pH对培养过程的影响,在反应器内将pH控制在7.0左右,进一步考察了全部半乳糖替代对细胞生长和产物唾液酸的影响。结果显示,全部半乳糖替代的情况下,并未对细胞的生长造成不利影响,其最大活细胞密度甚至达到了1.41×107cells/mL(图5-A),比摇瓶中的Con提高了40%,虽然其活细胞密度从192 h后开始明显下降,最终仅为8.7×106cells/mL,但其细胞活性仍维持在99%左右。葡萄糖相对摇瓶内更晚出现耗竭,第96小时葡萄糖浓度才跌至0 mmol/L(图5-B)。从半乳糖的代谢趋势来看,在0-192 h期间,细胞持续消耗半乳糖,其比消耗速率达到了0.54 mmol/(109cells·day),但是在192 h后,可能由于细胞状态的改变,其并未进一步消耗半乳糖。乳酸代谢可以分为3个阶段,0-120 h内乳酸持续生成,最高达到了27.5 mmol/L,其比成速率为1.96 mmol/(109cells·day)。随后转为消耗阶段,比消耗速率为1.23 mmol/(109cells·day),当培养到192 h时,乳酸浓度也跌至0 mmol/L。氨浓度相对于摇瓶过程有明显减少,最终浓度为9.36 mmol/L。虽然全部半乳糖替代对细胞生长代谢没有不利影响,但其产物的比生成速率仅为10.3 pg/(cell·day),比摇瓶中的对照组减少了50%(图5-C)。同时,虽然将整个培养过程的pH控制在适合产物表达和唾液所修饰的范围内,但是和摇瓶的Con相比,最终产物的唾液酸含量仍然有所下降,仅为40.8 μg/mg(图5-D)。以上结果说明,虽然在半乳糖全部替代的情况下,将pH控制在细胞的生理范围内,有效地降低了乳酸的生成,充分地支持了细胞的生长,但对于产物的表达和糖基化修饰会造成不利影响,可能是由于胞内能量供应不足引起的。
2.3 40%比例半乳糖替代对培养过程的影响
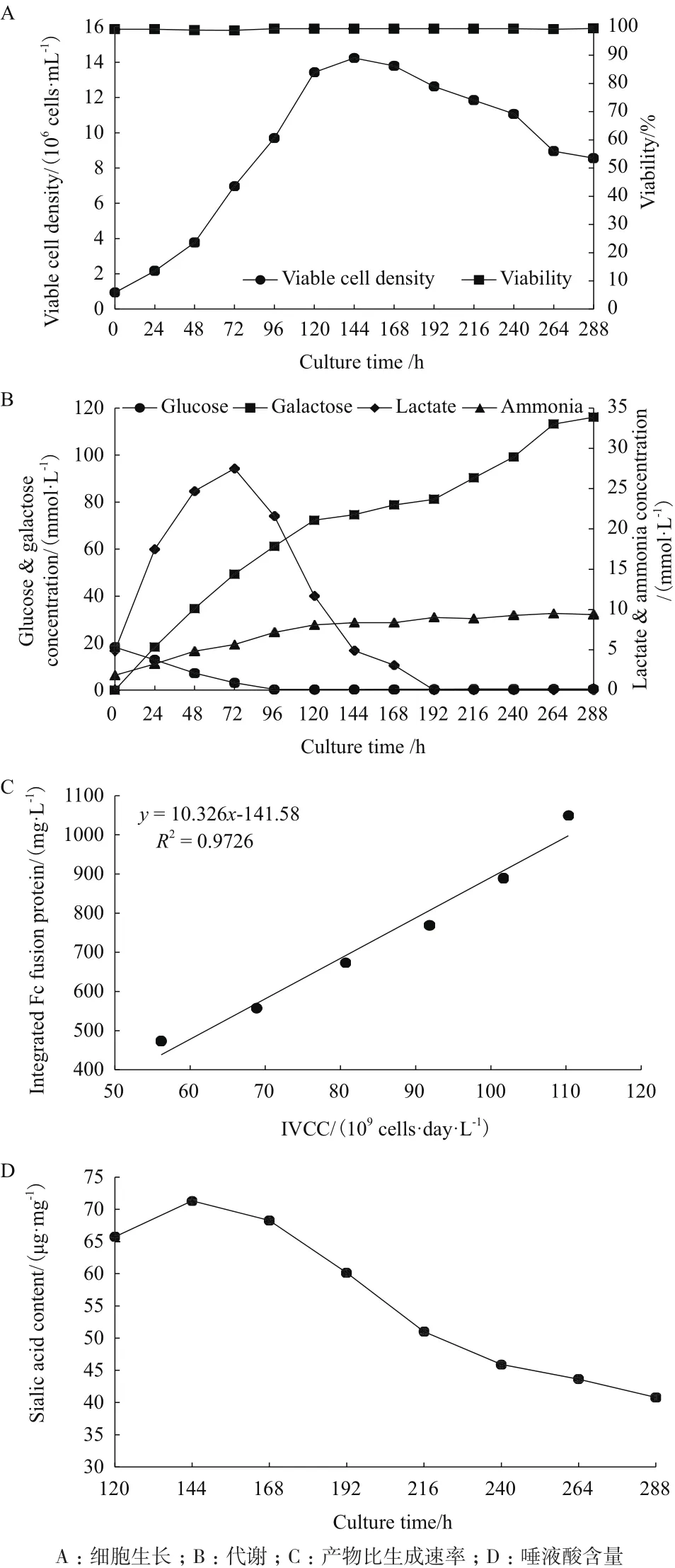
图5 反应器内全部半乳糖替代对细胞生长和产物糖基化的影响
为了平衡细胞的代谢和糖基化的合成,进一步在反应器内考察了40%比例半乳糖替代对培养过程的影响。将补料中40%比例的葡萄糖用半乳糖替代后,虽然最高活细胞密度较摇瓶内更低一些,只有7.9×106cells/mL,但后期却一直维持在6×106cells/mL以上,活性也在98%左右(图6-A)。最终Fc融合蛋白的表达量达到了1 106 mg/L,比摇瓶的Con提高了43%。此外,培养过程中Fc融合蛋白的总唾液酸含量在168 h前呈上升趋势,最高达到了71.2 μg/mg,随后总唾液酸含量随培养时间的延长而下降,最终维持在60 μg/mg左右(图6-B),但仍比摇瓶的Con提高了37%。对N-连接的糖基化分布检测结果显示,使用40%的半乳糖替代葡萄糖后,G0F(不带半乳糖和唾液酸的糖型结构)的含量从15.6%减少到了10.8%,而唾液酸含量则从35.6%提高到了42.2%,减少的G0F糖型都转化为带唾液酸化修饰的糖基结构(图6-C)。说明在Fc融合蛋白的表达过程中,半乳糖化修饰可能是限制蛋白唾液酸修饰的重要因素,因此半乳糖的加入可以有效地增加胞内糖基前体的合成,提高了最终唾液酸的含量。
3 讨论
作为CHO细胞重要的能源物质,糖代谢在细胞的生长、代谢、蛋白的表达以及质量等方面都发挥着重要的作用。本研究以一株表达Fc融合蛋白的CHO细胞为对象,综合考察了半乳糖替代流加对细胞生长、蛋白表达以及糖基化的影响。
细胞生长方面,在pH没有控制的摇瓶中,60%比例以上的半乳糖替代条件下,细胞后期的活率出现了显著的下降,这可能与过高的氨浓度直接有关[10],也可能是由于过高的氨浓度引起了摇瓶内pH的上升,进而引起细胞的死亡[11]。在后续的反应器实验中,通过对pH的稳定控制,氨浓度得到了有效控制,细胞活率也得到有效维持,可见使用半乳糖替代葡萄糖的流加培养并不会对细胞生长造成不利影响。
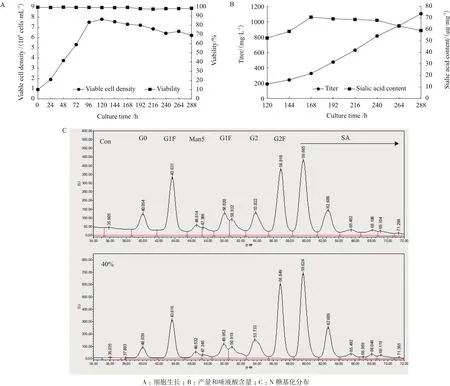
图6 反应器内40%替代半乳糖对细胞生长和产物糖基化的影响
代谢方面,60%以上半乳糖替代比例情况下,会出现葡萄糖耗竭的现象,细胞进而转向利用半乳糖和乳酸,因此GF4和GF5过程中的代谢副产物乳酸浓度有明显的下降。60%替代比例的GF3过程虽然葡萄糖也控制在0 mmol/L左右,但是乳酸并没有降低,和0-60%替代比例内维持一致,说明葡萄糖和半乳糖的代谢相互关联。糖酵解阶段,氧化还原力平衡引起的ATP能力维持对于乳酸的代谢十分重要[12],本研究中在60%以上半乳糖替代比例下,当半乳糖提供的ATP的速率未能弥补葡萄糖浓度降低带来的ATP损失时,乳酸开始明显减少[13-14]。此外,结合TCA循环相关的氨基酸代谢,随着半乳糖替代比例的增加,Glu的浓度不断升高,胞外Gln的浓度则逐步减少。说明在半乳糖替代比例增大的情况下,可能是葡萄糖提供的能量代谢有限,细胞转向消耗Gln以提高能量供应,因此其胞外的Gln浓度会随着半乳糖替代比例的增加而逐步降低,而其代谢产物Glu和氨会逐渐增加。
蛋白表达和糖基化方面,0-40%以内半乳糖替代比例情况下,蛋白的表达量和总唾液酸含量都会随着替代比例的增加而升高,而较高半乳糖替代范围内(60%-100%),两者反而随着替代比例的增加而有所减少。蛋白表达也与代谢紧密相连,较高替代范围内,基于TCA能量供应有所减少,会进一步降低线粒体的ATP势能,从而造成产量的降低[15]。唾液酸方面,虽然更多半乳糖的加入可以增加唾液酸前体的合成,但是同时细胞有可能并不能对其进行有效吸收。在全部添加半乳糖的情况下,半乳糖出现了大量的累积,在能量供给不充分的情况下,全部替代半乳糖的情况反而降低了唾液酸的含量,同时由于代谢的迁移,过多的氨的生成也会抑制糖基化的合成[10-11]。Gramer等[16]的研究结果表明适量的半乳糖添加可以有效增加抗体半乳糖化,Liu等[17]通过寡糖分析表明半乳糖化是融合蛋白唾液酸合成的限制步骤,20 mmol/L半乳糖使Fc融合蛋白的半乳糖化糖型和唾液酸化糖型比分别提高23.5%和20.3%,Lee等[18]添加 40 mmol/L半乳糖则使凝血因子Ⅱ的唾液酸含量提高了26%。因此在本研究中40%比例替代情况下,当唾液酸前体的合成和能量供应达到有效平衡,部分G0F糖型转化为半乳糖型,进而转化为带唾液酸化修饰的糖基结构,最终总唾液酸含量得到了有效提高。
4 结论
本研究以表达Fc融合蛋白的CHO细胞为对象,通过补料培养基中用半乳糖替代葡萄糖的方式有效地提高了最终的蛋白表达量和总唾液酸含量,但机制仍值得进一步研究,以利于建立高产高质的培养过程。

