高密度发酵重组大肠杆菌产海藻糖合成酶
晏星辰,黄 璞,王鑫沂,姜艳芝,李斯斯,辛 松,江 凌,黄 和
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.南京工业大学食品与轻工学院,江苏南京211800; 3.南京工业大学 药学院,江苏南京211800)
海藻糖是美国食品药品监督管理局(FDA)认证的功能性低聚糖,在食品、医药、化妆品、农业及精细化学品等领域都具有广阔的市场前景和应用价值[1-2]。目前,工业上酶法生产海藻糖被广泛应用,海藻糖合成酶(trehalose synthase,TreS)以麦芽糖为底物,通过分子内转糖基一步催化反应生成海藻糖[3-4]。海藻糖合成酶的异源表达已经有相当好的基础。Wang等[5]在大肠杆菌BL21(DE3)中表达恶臭假单胞菌的海藻糖合成酶基因,转化率可达59%;Chen等[6]构建的重组大肠杆菌海藻糖合成酶菌株,转化率可达68%。通过进一步对发酵工艺优化,快速、高效地获得高质量的海藻糖合成酶,从而降低生产成本,成为非常有价值的课题。
高细胞密度发酵(high cell density cultivation,HCDC)是指在一定的条件和培养体系下,更多地或更高效地获得细胞量,最终提高单位体积单位时间内目的产物的比生产率[7]。通常认为菌体密度超过50 g/L(以细胞干质量来计算,用DCW表示)即为高密度发酵。目前认为大肠杆菌最高的菌体密度为200 g/L[8-9]。高密度发酵大肠杆菌X90产胰蛋白酶,菌体密度可达92 g/L[10];高密度发酵大肠杆菌HB101产青霉素酰化酶,菌体密度可达145 g/L,均极大地提升了产酶效率[11]。高密度发酵可以减少培养体积,缩短生产周期、减少设备投资,进而降低生产成本。高密度发酵重组大肠杆菌对发酵条件有非常高的要求。满足细胞生长所需的营养物质、细胞生长过程中代谢抑制物的积累、培养温度、pH、溶氧浓度、诱导方式和补料方式等都对高密度发酵有非常重要的影响[12-14]。其中最重要的则是补料方式的选择,分批补料技术为目前普遍采用的发酵方式。分批补料方式包括非反馈补料法和反馈补料法[15-16]。非反馈补料法包括恒速流加补料法、变速流加补料法和指数流加补料法。其中,指数流加法可以比较精确地控制细胞的比生长速率,对细胞的生长和蛋白的表达效果较好。但是,它对发酵环境的适应性和调节性不强,不能根据发酵环境和菌体生长的变化作出相应的反馈调节。反馈补料法包括残糖浓度反馈法,恒溶氧反馈流加法和pH-stat反馈流加法。但是,反馈式补料法有一定的滞后性,无法进行精确的实时调控。因此,研究出既能克服非反馈补料法的适应性和调节性差的缺点,又能避免反馈补料法的滞后性的全新补料方式,具有十分重要的现实意义。
本研究中,笔者首先在揺瓶中对高细胞密度发酵重组大肠杆菌产海藻糖合成酶的培养基组成、培养条件和诱导条件进行确定,再在5 L发酵罐中对该菌进行批次补料的发酵实验,最后采用变指数-恒pH法的发酵方式进行高密度发酵实验,以期系统地优化重组大肠杆菌产海藻糖合成酶高细胞密度表达的工艺条件。
1 材料与方法
1.1 实验菌种
重组基因工程菌大肠杆菌BL21(Escherichiacoli),笔者所在课题组构建,目的基因来自于异常球菌(Deinococcussp.)。
1.2 主要试剂
葡萄糖、麦芽糖、海藻糖标准品,Sigma公司;蛋白胨、酵母粉,OXOID公司;氨苄青霉素、异丙基β-D-硫代半乳糖苷(IPTG),上海生工生物工程股份有限公司。
1.3 主要仪器
SW-CJ-1B(U)型生物净化工作台,苏州净化有限公司;HYL-A型恒温摇床,太仓市强乐实验设备厂;GA88-II型超声破碎仪,无锡上佳生物科技有限公司;UltiMate 3000型戴安高效液相色谱仪,Dionex公司;RI-101型示差折光检测器,Shhodex公司。
1.4 主要溶液与培养基
IPTG(1 mmol/L):10 mL无菌水溶解2 g IPTG,经0.22 μm滤膜过滤除菌,-20 ℃贮存。
氨苄青霉素(Amp,100 mg/mL):10 mL无菌水溶解1 g氨苄青霉素钠,经0.22 μm滤膜过滤除菌,-20 ℃贮存。
LB固体培养基:蛋白胨10 g、酵母粉5 g、NaCl 10 g、琼脂 20 g,定容至1 L。灭菌冷却后加入Amp母液,使其终质量浓度为50 mg/L。
LB液体培养基:蛋白胨10 g、酵母粉5 g、NaCl 10 g,定容至1 L。接种时加入Amp母液,使其终质量浓度为50 mg/L。
发酵培养基:葡萄糖10 g/L(单配)、KH2PO413.5 g/L、MgSO4·7H2O 1.39 g/L、酵母粉3 g/L、(NH4)2HPO44 g/L、NH4Cl 2.7 g/L、一水柠檬酸 1.89 g/L。微量元素为FeSO4·7H2O 5 mg/L、MnSO4·H2O 2 mg/L、ZnSO4·7H2O 1.4 mg/L、CoCl21.6 mg/L。
1.5 试验方法
1.5.1 重组大肠杆菌发酵生产海藻糖合成酶
揺瓶培养:初始种子接入到含有50 mg/L的LB培养基中,于37 ℃、200 r/min条件下培养。转接体积分数2%的种子液到新鲜的发酵培养基(含50 mg/L Amp)中,温度37 ℃,转速200 r/min,培养种子6~7 h时,加入诱导剂IPTG,使其终浓度为0.8 mmol/L。
发酵罐培养:在5、15和50 L发酵罐中装入1/3体积的初始发酵培养基,补料体积为1/3发酵罐体积。接种量5%。初始溶氧可控阶段,通过串联搅拌和通气量使溶氧(DO)保持在15%以上,直至不可控。发酵初始pH为7.0,控制发酵pH维持在7.0±0.1。
指数流加:根据菌体生长需要营养物质和发酵液体积的变化,指数补料流加葡萄糖,控制平均比生长速率在0.1及0.2 h-1左右。
变指数-恒pH混合流加:在发酵开始阶段,控制比生长速率0.2 h-1,在诱导阶段控制比生长速率0.1 h-1,并在整个发酵过程中,保持pH恒定。
酶液的制备:发酵培养出来的发酵液经离心、洗涤、1/2体积重悬。细胞悬液经超声破碎、离心之后获得酶液。酶液保存于4 ℃,用作催化生产海藻糖。
1.5.2 海藻糖合成酶的酶活力测定方法
取麦芽糖试剂(化学纯)5.4 g,溶解于100 mL、pH 7.4的磷酸缓冲液(PBS)中,使其终浓度为150 mmol/L。800 μL麦芽糖溶液与200 μL细胞悬浮液混匀(每组3个平行),1 mL反应体系在25 ℃反应30 min,之后沸煮8 min,用来灭酶。6 000 r/min离心8 min,取上清液用来测定得到的海藻糖的含量。
酶活力定义:在25 ℃下,每1 min生成1 μmol海藻糖所需要的海藻糖合成酶的量为1个酶活力单位U。
1.5.3 高效液相色谱法测定产物与底物
使用高效液相色谱法测定样品中麦芽糖、葡糖糖和海藻糖的含量。测定条件为流动相V(乙腈)∶V(水)=3∶ 1,流速0.6 mL/min;选用氨基柱(柱温35 ℃),Shodex RI-101示差检测器。
2 结果与讨论
2.1 最佳接种时间的确定
分批培养种子的过程中,细胞从延滞期开始慢慢复苏,之后进入比生长速率最大的对数生长期;进入发酵后期,细胞的增殖速度减慢甚至为负增长[17]。所以选择对数生长的中后期为接种时间,此时细胞活力和质粒的稳定性都较强,可以缩短发酵周期,降低染菌的可能性,保证重组蛋白的高效表达。通过摇瓶实验测定一代种子和二代种子的生长曲线,以确定最佳接种时间,结果如图1所示。

图1 一代种子和二代种子生长曲线Fig.1 Growth curves of the first and second seed
由图1可知:一代种子的2~8 h为菌体的对数生长期,二代种子的2~6 h为菌体的对数生长期。在对数生长期之后,菌体的比生长速率开始下降。因此,一代种子培养6~7 h即可接种,二代种子培养4~5 h即可接种,即当达到该体系下最大OD600的1/3至1/2时即可接种。由此可以看出,二代种子的活性明显强于一代种子。为了避免传代次数过多而导致质粒丢失,种子活化到二代即可。
2.2 发酵培养基的优化
2.2.1 葡萄糖浓度的优化
大肠杆菌高密度发酵使用的半合成培养基,其各成分的浓度及比例对发酵影响很大[18]。碳源是大肠杆菌高密度发酵的最关键因素,而目前最常用的碳源是葡萄糖。如果葡萄糖浓度过高,一方面会导致菌体生长过快,造成质粒丢失,影响目的蛋白的表达;另一方面,后期会抑制菌体生长,导致葡萄糖效应,使得菌体总量偏低[19]。笔者研究不同葡萄糖浓度对OD600和酶活的影响,结果如表1所示。

表1 葡萄糖质量浓度对OD600和酶活的影响
由表1可知:重组大肠杆菌在10 g/L葡萄糖的培养基中生长迅速,培养10 h后,菌体OD600达到5.6±0.3,海藻糖合成酶酶活也达到(3 245±250) U/mL,高于含5 g/L和15 g/L葡萄糖的培养基所获得的OD600和酶活。同样的,培养基中初糖质量浓度为10 g/L时,重组大肠杆菌的菌体密度以及其他异源蛋白(如谷胱甘肽(GSH)、重组人骨形成蛋白-2A)的表达量亦均达到了高值[20-21]。研究表明,如果培养基中糖浓度过高,则会导致大量乙酸形成,而糖质量浓度超过50 g/L时,重组大肠杆菌的生长将受到抑制[22]。
2.2.2 氮源的选择
除碳源外,培养基中的氮源对大肠杆菌发酵也有较大影响[23]。常用的氮源包括有机氮源和无机氮源。微生物吸收无机氮源快于有机氮源,但在含有有机氮源的培养基中常表现出生长旺盛、菌体浓度较高的特点。因此,笔者选用酵母粉、(NH4)2HPO4、NH4Cl、有机氮源和无机氮源相结合的培养基,不同氮源对OD600和酶活的影响,结果如表2所示。

表2 氮源对OD600和酶活的影响
由表2可知:选用有机氮源和无机氮源相结合的培养基,发酵10 h得到菌体OD600为5.2±0.1,酶活为(6 500±150) U/mL,高于只含单一有机氮源培养基得到的OD600和酶活。所以选择有机氮源和无机氮源一起作为培养基的氮源,酵母粉3 g/L、(NH4)2HPO44 g/L、NH4Cl 2.7 g/L。
2.2.3 微量元素的选择

表3 微量元素对OD600和酶活的影响
由表3可知:加入微量元素的培养基发酵10 h得到的OD600为5.2±0.3,酶活为(3 221±270) U/mL,高于不添加微量元素的培养基相同培养条件下得到的OD600和酶活。所以,培养基中添加一定浓度的微量元素。
2.3 培养条件及诱导条件的优化
2.3.1 pH的优化
培养基的初始酸碱度直接影响培养基中的物质和菌体中间代谢产物的解离,从而影响菌体对营养物质的新陈代谢[25],大肠杆菌适合生长的pH为6.5~7.5,如果生长pH不在此范围内,菌体的生长就会受到抑制甚至死亡。本实验中,笔者考察发酵培养基初始pH分别为6.6、7.0和7.4时对菌体生长和蛋白表达的影响,结果如表4所示。

表4 pH对OD600和酶活的影响
由表4可知:初始pH 为7.0时,OD600达到5.2±0.3,酶活达到(3 345±250) U/mL,均高于初始pH 6.6和初始pH 7.4时的OD600以及酶活。尤其在偏碱性条件下,重组大肠杆菌质粒丢失严重,几乎没有酶活。因此,选用初始pH 7.0作为发酵条件。
2.3.2 诱导温度的优化
培养温度是菌体生长和新陈代谢的重要因素。在不同发酵阶段,基因工程菌的最适温度需要综合考虑。在菌体处于生长期、重组产物还没有表达时,较高的温度有利于菌体量的积累,并可缩短培养周期。较高培养温度会降低基因工程菌的质粒稳定性,并且较低的温度培养能提高目的重组产物的表达量[26]。所以,发酵到目的重组产物表达时期,应该采用低温培养。笔者研究不同温度对OD600和酶活的影响,结果如表5所示。

表5 温度对OD600和酶活的影响
由表5可知:本实验在发酵生长期采用37 ℃条件培养菌体,在产物表达时期采用32 ℃条件诱导菌体。相较于采用37 ℃恒温条件培养,OD600基本保持不变,但酶活有显著提高。因为高温条件下利于菌体生长,当菌体积累到一定数量时,发酵受到各种限制因子的影响,菌体数量不再增加。此时,采用低温条件培养,菌体生长活性降低,将更多的能量用于自身蛋白的表达,有利于获得更多的目的蛋白。因此,后期选用32 ℃作为诱导条件。
2.3.3 诱导剂添加时间的优化
由于IPTG对菌体有毒害和增加菌体代谢负担的作用,所以添加IPTG的时间对菌体的高密度发酵和产物的积累有直接影响。添加时间过早不利于获得较高的生物量和产物总量,添加时间过晚,增加了发酵后期的生产成本。分别在发酵2、4和6 h,即分别为揺瓶最大生物量的1/6、1/2和2/3时添加IPTG,其他培养条件相同,发酵10 h,研究IPTG添加时间对OD600和酶活的影响,结果如表6所示。

表6 IPTG添加时间对OD600值和酶活的影响
由表6可知:发酵4 h时添加IPTG效果最佳,OD600为6.2±0.3,酶活为(6 345±250) U/mL;发酵2 h时添加IPTG,由于菌体浓度过低,IPTG对菌体的毒害效果显著,导致菌体数量和酶活都非常低;而发酵6 h时添加IPTG,虽然对菌体数量没有影响,但是由于菌体此时表达蛋白能力的降低和诱导时间的不足,获得的酶活效果并不理想。如果增加诱导时间,则会导致发酵时间的增加,也增加了成本。因此选用OD600为最大生物量的1/2时添加IPTG。
2.4 分批发酵
经过摇瓶培养的初步研究,基本确定了培养的各个参数,但摇瓶的培养环境和参数与发酵罐相比相差很大。发酵过程中,发酵罐对pH、溶氧等因素的可控程度很高。因此,先在5 L发酵罐上进行分批发酵实验,作为发酵罐的分批补料发酵实验的基础,结果如图2所示。
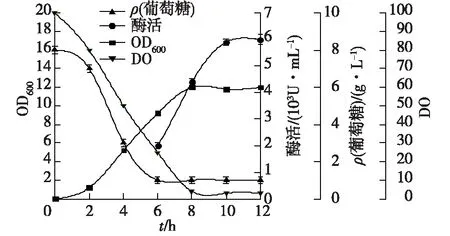
图2 分批方式下重组大肠杆菌的发酵曲线Fig.2 Fermentation curves of recombinant E. coli underthe conditions of batch fermentation
由图2可知:在发酵过程中,利用NaOH控制pH在7.0,通过搅拌和改变通气量来维持溶氧20%以上,至达到搅拌和通气量上限,便不再维持。由于pH值和溶氧在发酵罐培养过程中是可控参数,发酵罐中的环境特别适合菌体生长,菌体密度比揺瓶有了显著提高。OD600达到12,酶活最终达到了(6 010±120) U/mL。发酵6 h,葡萄糖已经基本消耗完毕,之后菌体生长放缓。由于营养物质缺乏,所以菌体密度和海藻糖合成酶活力还有很大的提升空间。此分批发酵实验为分批补料奠定了基础。
2.5 分批补料技术
2.5.1 指数流加法
分批补料技术是指在微生物分批发酵过程中流加一定营养物质,用来提高菌体密度和目的蛋白含量的技术[27]。Riesenberg等[28]采用非反馈分批补料技术中的指数流加法,控制大肠杆菌比生长速率为0.11 h-1,获得110 g/L的生物量(以DCW计)。非反馈控制的系统中,物料的程序是预先设定的。但在实际培养过程中,菌体的生长不会和理论设想一致,非反馈补料法便不能发挥其原有的调节作用。因此,非反馈补料法灵活性不强,不能根据菌体生长的实际情况作出相应的调节,所以往往蛋白表达量不理想。表7为指数流加试验结果。

表7 指数流加试验结果
由表7可知,指数流加方式极大地提高了菌体密度。当比生长速率μ为0.2 h-1时,在较短的时间里获得了较高的菌体密度。采用指数流加策略,可以控制基本恒定的比生长速率(0.2 h-1)。
2.5.2 变指数流加-恒pH法


图3 5 L罐变指数流加-恒pH流加方式下重组大肠杆菌发酵曲线Fig.3 Fed-batch fermentation profiles using combinedfeeding strategy in 5-L fermentator
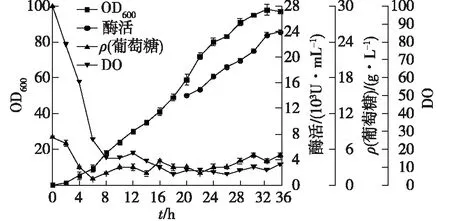
图4 50 L罐变指数流加-恒pH流加方式下重组大肠杆菌发酵曲线Fig.4 Fed-batch fermentation profiles using combinedfeeding strategy in 50-L fermentator
由图3可知:在发酵初始阶段,首先采用指数流加培养(μ=0.2 h-1),开始诱导时,降低比生长速率为μ=0.1 h-1,在整个发酵过程中,保持恒定的pH值在7.0左右,直到发酵结束。这种补料方式成功克服了单一流加方式的缺点,成功地避免了发酵过程中乙酸的大量积累,为大肠杆菌的高密度生长创造了条件。50 L罐的发酵结果如图4所示。由图4可知:由于50 L罐设备的环境更好,各个参数可控程度更高,溶氧充足,发酵32 h后,OD600达到97,酶活达到(24 000±350) U/mL,实现了大肠杆菌的高密度发酵。
3 结论
采用全新的变指数-恒pH法高密度发酵重组大肠杆菌,对生产海藻糖合成酶条件进行系统优化。首先在揺瓶中,根据大肠杆菌高密度发酵条件范围,对本实验的基因工程菌进行培养基、发酵条件和诱导条件的优化。得到培养基组成:葡萄糖10 g/L(单配),KH2PO413.5 g/L、MgSO47H2O 1.39 g/L,酵母粉3 g/L、(NH4)2HPO44 g/L、NH4Cl 2.7 g/L、一水柠檬酸 1.89 g/L。微量元素为FeSO4·7H2O 5 mg/L、MnSO4·H2O 2 mg/L、ZnSO4·7H2O 1.4 mg/L、CoCl21.6 mg/L。发酵条件:二代种子培养4~5 h接种,pH 7.0,发酵初期温度37 ℃,诱导温度32 ℃,当达到发酵体系最大生物量的1/3~1/2时添加诱导剂。然后采用优化后的培养基和发酵条件,在5 L和50 L发酵罐中,对该菌进行批次发酵和批次补料发酵实验。最后确定变指数-恒pH法高密度发酵重组大肠杆菌,OD600达到97,海藻糖合成酶酶活达到(24 000±350) U/mL,实现了重组大肠杆菌高密度发酵生产海藻糖合成酶。

