葡萄糖醛酸木聚糖酶在枯草芽孢杆菌中的表达及发酵条件优化
郭亚兰,周雨朦,吴 斌,何冰芳
(1.南京工业大学生物与制药工程学院,江苏南京211800; 2.南京正大天晴制药有限公司,江苏南京222062;3.南京工业大学药学院,江苏南京211800)
木聚糖是除纤维素外含量最丰富的植物细胞壁多糖[1]。自然界中,绝大多数木聚糖结构复杂且具有高度分枝。因此,木聚糖的完全降解是一个复杂的过程,需要各种酶协同作用,包括β-1,4-内切木聚糖酶、β-木糖苷酶、D-葡萄糖醛酸酶和L-阿拉伯呋喃糖苷酶等[2]。其中,β-1,4-内切木聚糖酶,通常定义为木聚糖酶,是木聚糖降解酶系中最关键的酶。它能作用于木聚糖分子的主链骨架,将木聚糖水解为低聚木糖以及少量的木糖和阿拉伯糖[3]。
迄今为止,大多数的木聚糖酶属于糖苷水解酶10家族(GH10)和11家族(GH11)[4]。然而,这些酶的活性受木聚糖取代基的数量和密度的影响。高取代的侧链,如甲基葡萄糖醛酸(MeGA)和乙酰基等,破坏了GH10和GH11家族的木聚糖酶对主链的可及性,降低了酶水解木聚糖的能力。来自GH30家族的木聚糖酶能特异性地降解富含D-葡萄糖醛酸(GlcA)和甲基葡萄糖醛酸等侧链残基的木聚糖[5],在硬木木聚糖等高侧链取代的木聚糖降解中起到重要的补充作用。目前研究者已在欧文氏菌(Erwiniachrysanthe)[6]、热纤维梭菌(Clostridiumthermocellum)[7]及类芽孢杆菌(Paenibacillusbarcinonensis)[8]等菌株中纯化获得了GH30的木聚糖酶。此外,许多GH10和GH11的木聚糖酶已在大肠杆菌[9]、枯草芽孢杆菌[10]和巴斯德毕赤酵母[11]中异源表达。枯草芽孢杆菌表达系统具有诸多优点,如非致病性、增加蛋白质可溶性表达、重组表达蛋白的内毒素低、更好的生物活性以及胞外分泌表达等[12-13]。然而目前还未见有GH30家族木聚糖酶在枯草芽孢杆菌中表达的研究报道。
笔者所在课题组在前期研究中从枯草芽孢杆菌LC-9中筛选到一个葡萄糖醛酸木聚糖酶。本文中,笔者克隆葡萄糖醛酸木聚糖酶基因,并利用大肠杆菌-枯草芽孢杆菌穿梭载体pMA05在枯草芽孢杆菌WB800中进行该酶的异源表达,优化其表达条件,以期为该酶的应用提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
枯草芽孢杆菌BacillussubtilisLC-9、大肠杆菌E.coliDH5α、枯草芽孢杆菌BacillussubtilisWB800以及大肠杆菌-枯草芽孢杆菌穿梭质粒pMA05保存于何冰芳教授实验室。
1.1.2 主要试剂
各种限制性内切酶、DNA聚合酶、DNA maker、标准蛋白,TaKaRa公司;溶菌酶、DNA琼脂糖凝胶回收试剂盒、质粒提取试剂盒,Axygen公司;胰蛋白胨、酵母提取物、琼脂糖,Oxoid公司;Beechwood木聚糖、NaCl、Tris-base,市售分析纯。
1.1.3 培养基
LB培养基[14](g/L):蛋白胨 10.0、NaCl 10.0、酵母粉5.0;固体培养基中另加琼脂20.0。
抗生素培养基:LB培养基灭菌后冷却至60 ℃再加入过滤除菌的氨苄青霉素(Amp)、卡那霉素(Kana)使其终质量浓度分别为100 或50 mg/L。
1.2 大肠杆菌、枯草芽孢杆菌的DNA操作
质粒提取、DNA酶切、电泳、转化等DNA操作参照文献[14]进行。
1.3 葡萄糖醛酸木聚糖基因的克隆
根据实验室前期所得序列设计PCR引物,其基因带有自身信号肽。上下游引物的5′端分别设计了BamHⅠ、NdeⅠ酶切位点。上游引物BsXyn30-F:5′-A ̄A ̄A ̄A ̄G ̄G ̄A ̄G ̄C ̄G ̄A ̄T ̄T ̄T ̄A ̄C ̄A ̄T ̄A ̄T ̄G ̄A ̄T ̄T ̄C ̄C ̄A ̄C ̄G ̄C ̄A ̄T ̄A ̄A ̄A ̄A ̄A ̄A ̄A-3′,下游引物BsXyn30-R:5′-G ̄A ̄G ̄C ̄T ̄C ̄G ̄A ̄C ̄T ̄C ̄T ̄A ̄G ̄A ̄G ̄G ̄A ̄T ̄C ̄C ̄T ̄T ̄A ̄A ̄C ̄G ̄A ̄T ̄T ̄T ̄A ̄C ̄A ̄A ̄C ̄A ̄A ̄A ̄T ̄G ̄T ̄T ̄G ̄T-3′。
以枯草芽孢杆菌LC-9为DNA模板,进行PCR扩增。PCR的反应体系为50 μL。其中,模板2 μL、上下游引物各2 μL、2×Priemix 25 μL、重蒸水19 μL。
反应条件:95 ℃预变形5 min后,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,进行32个循环,72 ℃延伸10 min。将PCR扩增产物经DNA快速胶回收待用。
1.4 表达载体的构建
将pMA05质粒用BamHⅠ、NdeⅠ进行双酶切,得到线性质粒与葡萄糖醛酸木聚糖酶基因,进行同源臂重组连接,之后转入E.coliDH5α,菌落PCR验证阳性克隆子。
1.5 葡萄糖醛酸木聚糖酶的发酵培养及表达
将质粒pMA05-BsXyn30转入枯草芽孢杆菌WB800,得到重组菌WB800/pMA05-BsXyn30,加入含卡那霉素的LB种子培养基中,在37 ℃、180 r/min摇床中培养12 h。以2%(体积分数)的接种量接入LB发酵培养基中,在37 ℃、180 r/min摇床中培养36 h,室温下8 000 r/min离心20 min后收集上清。
1.6 表达产物的分析鉴定
利用SDS-PAGE对收集的胞外上清液进行表达产物的分析,采用二硝基水杨酸(DNS)法[15]测葡萄糖醛酸木聚糖酶的酶活。取稀释好的酶液0.5 mL加入到孵育好的1 mL 10 g/L的木聚糖中,在55 ℃下反应10 min后立即加入3 mL DNS试剂,沸水浴5 min,冷却后在540 nm的波长下用分光光度计测相应吸光值。
葡萄糖醛酸木聚糖酶酶活定义:每分钟生成1 μmol还原糖所需酶量定义为1个酶活单位(U)。
1.7 发酵条件优化
1)培养时间对菌株生长及产酶的影响。挑取单菌落,接入含卡那霉素的LB培养基中培养过夜,以2%的接种量接入液体LB培养基中进行发酵,在37 ℃、180 r/min摇床中培养。分别在3、6、9、12、24、36、48、60、72和84 h取样,测定菌液OD600以及发酵上清液中的木聚糖酶酶活。
2)培养温度对菌株生长及产酶的影响。将重组菌株接种于液体LB培养基中培养12 h(37 ℃、180 r/min)作为种子液,以2%接种量接种后分别于25、30、37和45 ℃中振荡培养36 h后,对菌体的生长和产酶分别进行检测。
3)培养基起始pH对菌株生长及产酶的影响。菌株经种子液培养,以2%接种量接种分别于初始pH为6.5、7.0、7.5和8.0的LB基础培养基中,36 h后对菌体的生长和产酶分别进行检测。
1.8 培养基碳源优化
1)碳源对菌株生长及产酶的影响。菌株经种子液培养,以2%接种量接种于LB培养基中,分别添加1%的麦芽糖、葡萄糖、山梨醇、甘露醇,36 h后检测菌株的生长和产酶情况。
2)碳源浓度对菌株生长及产酶的影响。以2%接种量接种于LB培养基中,分别添加5、10、15、20、25和30 g/L的山梨醇,36 h后检测菌株的生长和产酶情况。
2 结果与讨论
2.1 葡萄糖醛酸木聚糖酶基因克隆
从枯草芽孢杆菌LC-9中提取基因组总DNA,以此为模板,通过PCR扩增得到编码葡萄糖醛酸木聚糖酶的基因,并进行分析,结果见图1。由图1可知,克隆条带大小与理论基因的长度一致,说明成功从模板中扩增出该片段。将扩增得到的片段与pMD18-T vector连接,导入大肠杆菌中并送至测序公司测序。

图1 葡萄糖醛酸木聚糖酶基因的PCR扩增产物Fig.1 PCR amplification product of glucurono-xylanase gene
葡萄糖醛酸木聚糖酶的基因为1 266 bp,编码 422个氨基酸,基因的开放阅读框(ORF)含有信号肽及成熟肽序列。其中,成熟肽的基因序列为1 170 bp,编码389个氨基酸(BsXyn30)。
BsXyn30与其他GH30家族木聚糖酶的多序列进行比对,结果见图2。由图2可知:BsXyn30与来自枯草芽孢杆菌168的XynC有99%的同源性[16],与来自Bacillussp.strain BP-7的Xyn5B同源性为93%[17],与来自P.barcinonensis的Xyn30D同源性为79%[8]。
2.2 重组工程菌的构建结果
2.2.1 质粒的构建结果
双酶切质粒并与木聚糖酶基因片段进行同源臂重组连接,转入大肠杆菌中得到重组质粒,经菌落PCR验证,结果见图3。由图3可知,PCR扩增出来的片段与目的基因大小一致,表明重组质粒成功插入了大小约为1 200 bp的木聚糖酶基因片段。
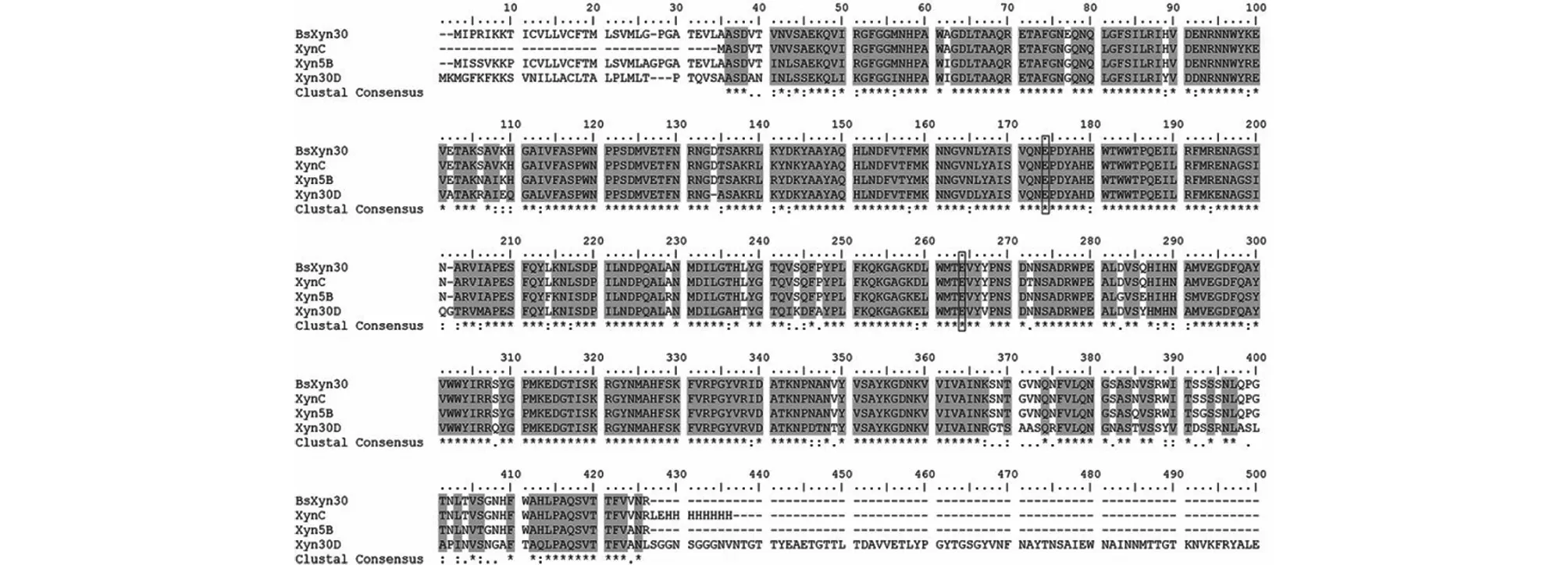
图2 序列比对结果Fig.2 Amino acid sequence alignment of BsXyn30 from B.subtilis LC9,XynC from Bacillus subtilis 168,Xyn5B from Bacillus sp.strain BP-7,Xyn30D from Paenibacillus barcinonensis
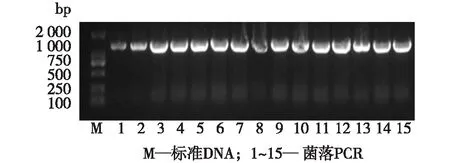
图3 菌落PCR验证Fig.3 Verification of colony PCR
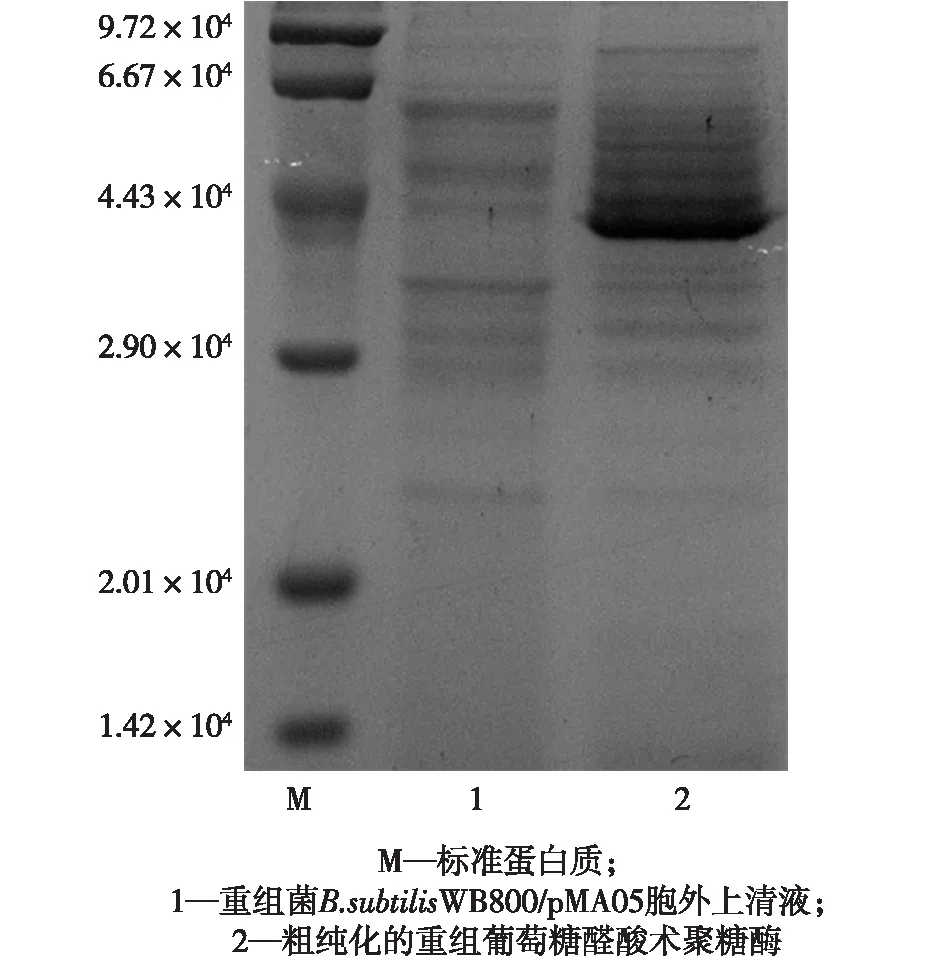
图4 重组酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the recombinantglucurono-xylanase
2.2.2 葡萄糖醛酸木聚糖酶在枯草芽孢杆菌中的表达
将重组质粒化转入枯草芽孢杆菌WB800,37 ℃发酵36 h后离心得到胞外上清液,进行酶活检测以及SDS-PAGE电泳分析,结果见图4。由图4可知:木聚糖酶自身信号肽在枯草芽孢杆菌中可以正常发挥作用,其表达产物能有效分泌到胞外,通过DNS法[15]检测胞外上清液的木聚糖酶活力可达14 U/mL,其表观分子量为4.3×104。
2.3 葡萄糖醛酸木聚糖酶发酵条件的优化
2.3.1 发酵时间对产酶的影响
图5为重组菌株的生长及产酶曲线。从图5可以看出,在最开始的3 h细菌生长缓慢,之后生长速度加快进入对数期并在24 h达到生长的最高峰,之后进入衰亡期。前期培养基中营养丰富,细胞处于生长状态,在后期发酵液中营养匮乏以及细菌产生的次级代谢产物使细菌生长受到抑制甚至死亡,造成总生物质大幅下降。
在葡萄糖醛酸木聚糖酶BsXyn30的产酶时间上,在对数前期酶活增长缓慢。到对数期后期以及稳定期前期酶活增长迅速,并在36 h时达到最高,之后缓慢下降。因为在稳定期前期,细菌生长速度开始下降,但细菌内部的质粒拷贝数仍然在迅速增长。在36 h菌液酶活达到最高值,为13.2 U/mL,而后酶活开始下降。接下来以此酶活为对照(100%),进行发酵条件优化。

图5 重组菌的生长与产酶曲线Fig.5 Growth curves and enzyme production ofrecombinant strain
2.3.2 发酵温度对产酶的影响
考察温度对重组菌株的产酶的影响,结果见图6。由图6可知:重组菌最佳生长温度在37 ℃,并且在37 ℃具有最高的葡萄糖醛酸木聚糖酶酶活。当温度达到45 ℃,菌体量明显下降导致酶活力降低,而且重组菌的最适生产温度与大多数枯草芽孢杆菌的生长温度一致[18-19]。
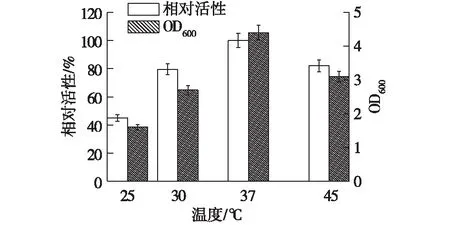
图6 温度对重组菌产酶的影响Fig.6 Effects of temperatures on enzymeproduction of recombinant strain
2.3.3 培养基起始pH对产酶的影响
考察pH对重组菌株的产酶的影响,结果如图7所示。由图7可知:在pH 6.5~8.0的范围内,重组菌都能生长良好,在pH为7.5时重组菌生长得最好,酶活也最高,达到13.8 U/mL。总体来看,培养基起始pH在7.0~8.0的范围内,葡萄糖醛酸木聚糖酶的表达都较好,而且酶活变化与菌体生长状态一致,正常的培养基初始pH在7.4左右,故不需要调节pH。
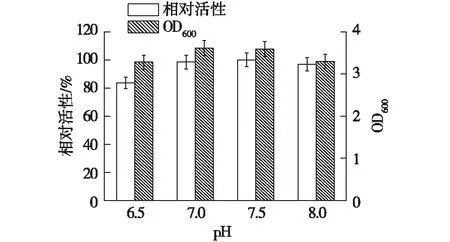
图7 初始 pH 对重组菌产酶的影响Fig.7 Effects of medium initial pH on enzymeproduction of recombinant strain
2.4 培养基碳源优化
碳源是微生物生长及产酶过程中非常重要的影响因子。考察不同碳源对重组菌生长及产酶的影响,结果如图8所示。由图8可知:碳源对重组菌的生长和产酶有重要影响,山梨醇作为碳源可以被重组菌很好地利用,酶活和菌体量都达到最大。其他碳源也可以被菌很好的利用,但相比而言,以山梨醇作为碳源时,菌体量最大,相对酶活也最高,为56.2 U/mL,约为普通LB培养下的3倍。而且周煌凯等[18]在研究木聚糖酶XynA在枯草芽孢杆菌中表达时发现,山梨醇是重组菌B.subtilisGJ148-XynA生长和产酶的最佳碳源。
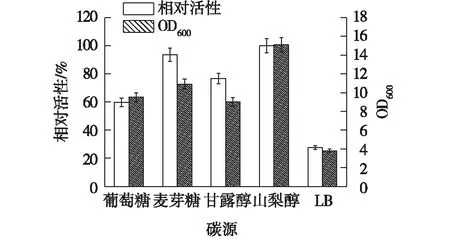
图8 碳源对重组菌产酶的影响Fig.8 Effects of carbon sources on enzymeproduction of recombinant strain
2.5 培养基碳源浓度的优化
碳源对菌株产酶及生长的影响非常大。因此,笔者进一步优化碳源浓度对菌株产酶及生长的影响,结果如图9所示。由图9可知:在5~20 g/L的碳源条件下,菌株的生长及产酶随着碳源浓度的增加而增加,并在20 g/L时酶活及OD达到最高,酶活最高为76.0 U/mL,为优化前产酶的5.4倍。
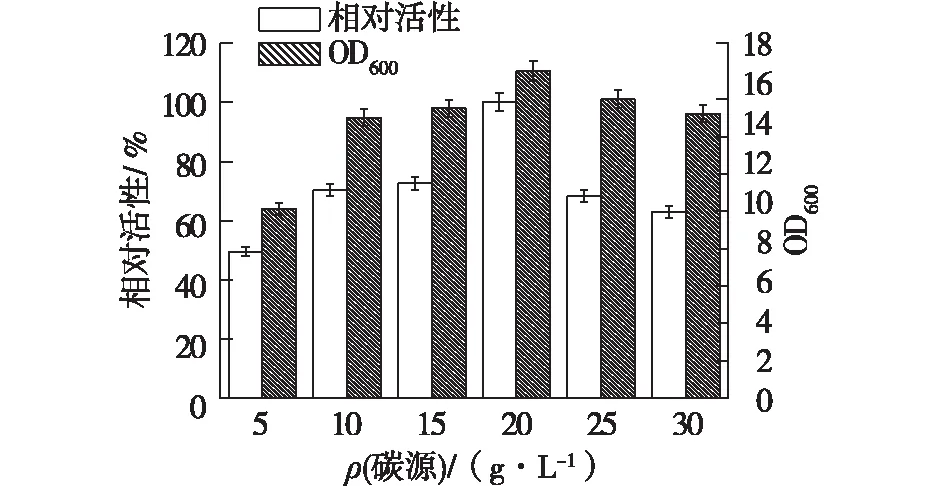
图9 碳源浓度对重组菌产酶的影响Fig.9 Effects of carbon sources concentration onenzyme production of recombinant strain
当碳源浓度过高时,菌株生长及产酶反而会下降。重组菌生长及产酶的最适碳源为20 g/L。在枯草芽孢杆菌中表达淀粉酶的研究发现,最适碳源为淀粉,添加量为20 g/L[20]。
3 结论
成功克隆了葡萄糖醛酸木聚糖酶基因,并构建了重组质粒,在枯草芽孢杆菌WB800实现了其高效表达。通过对重组菌的碳源及发酵条件优化,在37 ℃下重组菌发酵产酶,酶活最高可达76.0 U/mL,约为优化前产酶的5.4倍,表明达到了高效分泌表达。为今后葡萄糖醛酸木聚糖酶BsXyn30在食品、造纸以及饲料工业上的应用奠定了基础。

