葡萄SAP家族的鉴定与表达分析
丁兰,顾宝,李培楹,舒欣,张剑侠
(西北农林科技大学园艺学院/旱区作物逆境生物学国家重点实验室 陕西杨凌712100)
0 引言
【研究意义】葡萄(Vitis viniferaL.)是世界第三大水果,也是我国重要的果树作物,但冻害一直是葡萄生产中存在的突出问题[1],干旱、盐碱等生长环境都给葡萄生产者和葡萄产业造成了不便和严重损失[2]。因此,研究逆境胁迫相关基因,有针对性地对葡萄进行基因改造,对提高葡萄的抗逆性具有重要意义[3]。SAP(Stress Associated Protein)蛋白家族是一类响应和调控多种逆境胁迫的锌指蛋白,在植物抵抗逆境胁迫中发挥着重要作用,开展葡萄SAP家族鉴定、生物信息学和表达分析,将为了解葡萄响应逆境胁迫的分子机制奠定基础。【前人研究进展】锌指蛋白是一类具有手指状结构域的转录因子,能够调控逆境相关基因,参与植物对生物和非生物胁迫的应答反应[4]。SAP家族具有AN1或A20保守结构域,在动物中的研究较为成熟,现已研究得出位于蛋白N端的A20结构域,由多个Cys2/Cys2锌指基元组成,保守序列为 CX2-4CX11CX2C(X代表任意氨基酸),在免疫、发育和细胞增殖中都发挥了重要作用[5-6]。而对于C端的AN1结构域,目前仅了解到它最早在编码非洲爪蟾动物半球母体 RNA的蛋白中被发现,保守序列为CX2Cx9-12CXl-2CX4CX2HX5HXC,其具体功能并未明确[7]。在植物中,关于SAP家族的研究主要集中在水稻(Oryza sativa)[8]和拟南芥(Arabidopsis thaliana)[9]中,已分别鉴定出 18和 14个SAP家族基因,并已对其进行了较为系统的研究;在番茄(Solanum lycopersicum)[10]、棉花(Gossypium hirsutum)[4]、甘蔗(Saccharum officinarum)[11]、香蕉(Musa nanaL.)[12]、羊草(Leymus chinensis)[13]等植物中也对SAP有研究报道。目前在植物中鉴定出的SAP均响应多种非生物胁迫,例如,水稻OsiSAP7负调控种子萌发早期对 ABA胁迫信号的响应[14],在水稻和烟草中过表达OsiSAP8可增强其对盐碱、干旱、低温胁迫的耐受性[15],在水稻中过表达高粱SbSAP14可提高其耐盐性[16],过表达AlSAP可以提高旱地中水稻的产量[17]。【本研究切入点】葡萄作为重要的经济果树,迄今在葡萄中未有关于SAP的克隆和功能研究的报道,对于葡萄中SAP的数量、理化性质和功能尚不清楚。【拟解决的关键问题】本研究通过SAP的保守结构域,在NCBI数据库和葡萄全基因组中搜索,鉴定SAP家族成员,分析基因理化性质、染色体定位及系统发育等信息,同时研究葡萄SAP家族在多种逆境下的表达特征及生物节律特征,为进一步探究SAP功能提供依据。
1 材料与方法
试验于 2018年在西北农林科技大学旱区作物逆境生物学国家重点实验室进行。
1.1 试材与处理
前期对于葡萄寒胁迫下转录组分析所用试验材料为山葡萄‘双优’(Vitis amurensiscv.Shuangyou)和欧洲葡萄‘红地球’(Vitis viniferacv.Red Globe),保存于西北农林科技大学葡萄种质资源圃。本试验所用试材为‘红地球’试管苗,保存于本实验室。2018年4月将生长情况一致的试管幼苗(长约12 cm)移栽至人工气候室(条件设置为 25℃,200 μmol·m-2·s-1光照16 h,暗培养8 h)中培养3个月。对材料进行激素处理(50 μmol·L-1ABA、100 μmol·L-1SA)(等体积蒸馏水处理为对照),高盐处理(400 mmol·L-1NaCl)和低温处理(4℃)。具体步骤如下:在室温下,将50 μmol·L-1ABA、100 μmol·L-1SA 和 400 mmol·L-1NaCl分别喷施在葡萄叶片上;低温处理采用RXZ型人工气候箱(条件设置为 4℃,200 μmol·m-2·s-1光照16 h,暗培养8 h);每个处理设置3组重复,分别在0、0.5、1、2、4、8、12和24 h采集叶片,并分别于北京时间 0:00、3:00、6:00、9:00、12:00、15:00:18:00、21:00采集未处理的葡萄叶片用于昼夜节律分析。将采集的材料用液氮速冻后,保存于-80℃冰箱备用。
1.2 葡萄SAP家族成员鉴定
根据SAP家族的AN1和A20保守结构域,在NCBI数据库(http://www.ncbi.nlm.nih.gov/)和葡萄全基因组数据(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中查询和确定葡萄中的SAP家族成员,手动去除重复序列,最终获得葡萄中的SAP家族成员。
1.3 葡萄SAP家族的生物信息学分析
在Grape Genome Browser(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/) 中获得葡萄SAP家族各基因的染色体位置、CDS编码区序列及基因组DNA序列,利用在线软件GSDS2.0(http://gsds.cbi.pku.edu.cn/index.php)绘制基因结构示意图[18],并运用Adobe Illustrator软件进行染色体定位作图;利用在线网站 EXPASY(http://web.expasy.org/protparam/)中ProtParam工具对葡萄SAP家族所编码蛋白的氨基酸组成、疏水性、等电点等理化性质进行分析;利用WoLF PSORT(http://www.genscript.com/wolfpsort.html)在线软件进行亚细胞定位预测[19];利用在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析二级结构;基序预测利用在线软件 MEME(http://meme-suite.org/tools/meme)进行motif系列分析;利用本地软件DNAMAN进行蛋白多序列比对;利用 MEGA6软件,用最大似然法(Maximum likelihood)对已鉴定的葡萄、拟南芥和水稻SAP家族蛋白进行系统进化树构建,Bootstrap值设置为1 000。
1.4 葡萄SAP家族表达分析
根据基因序列设计实时荧光定量 PCR 特异引物(表1),以葡萄Actin(XM_002265440)作为内参基因,采用OMEGA试剂公司的植物RNA提取试剂盒提取经过处理后的葡萄叶片RNA,利用TaKaRa公司的反转录试剂盒 PrimeScriptTM1st Strand cDNA Synthesis Kit反转录合成cDNA第一条链,将cDNA稀释到相同浓度后用作实时荧光定量 PCR的模板。qRT-PCR的反应体系为20 μL,包括1 μL cDNA模板,上、下游引物分别0.8 μL,SYBR Green荧光染料为10 μL,ddH2O 7.4 μL。反应程序为:95℃变性 1 min,95℃变性10 s,58℃退火20 s,72℃延伸20 s,40个循环。每个处理设置3个重复,基因相对表达量采用2-ΔΔCt法进行分析。
2 结果
2.1 葡萄SAP家族鉴定及序列分析
从葡萄基因组和NCBI数据库中共鉴定出15个SAP家族基因,根据其保守结构域和在染色体上的位置,依次命名为VvSAP1-VvSAP15。15个VvSAPs(图1)分别位于第1、2、6、7、8、13、14、16和18条染色体上,其中VvSAP5、VvSAP6和VvSAP14位于第 8条染色体,第2、6、13和16条染色体分别分布在两个VvSAP。结果(表2)显示,葡萄SAP家族基因编码区长度为330—882 bp,编码109—293个氨基酸,等电点为7.99—9.68,均为碱性蛋白。氨基酸序列的平均亲水系数在-0.300—-0.904,均为负值,表明这些蛋白均为亲水蛋白,但亲水程度不同。对VvSAP家族基因进行亚细胞定位预测,结果显示(表3)它们都存在于细胞核中,大部分存在于叶绿体和细胞骨架中,初步推测该家族主要存在于进行光合作用的器官中,并参与了细胞壁的形成。其中,只有VvSAP14和VvSAP15不存在于叶绿体和细胞骨架,VvSAP9、VvSAP10还定位于过氧化物酶体和细胞质中。通过二级结构预测表明(表4),VvSAP二级结构以无规则卷曲和α-螺旋结构为主,拓展链结构和β-转角结构所占比例较小,其中 VvSAP9、VvSAP14和VvSAP15的无规则卷曲结构所占比例最大,分别为60.13%、62.12%和73.02%;VvSAP1、VvSAP3和VvSAP10的α-螺旋结构所占比例最大,分别为为30.26%、31.4%和34.87%。

表1 VvSAP家族表达分析的实时荧光定量引物Table1 qRT-PCR primers for expression on analysis of VvSAP

图1 葡萄SAP家族在染色体上的位置Fig.1 The chromosome location of the SAP family in Vitis vinifera
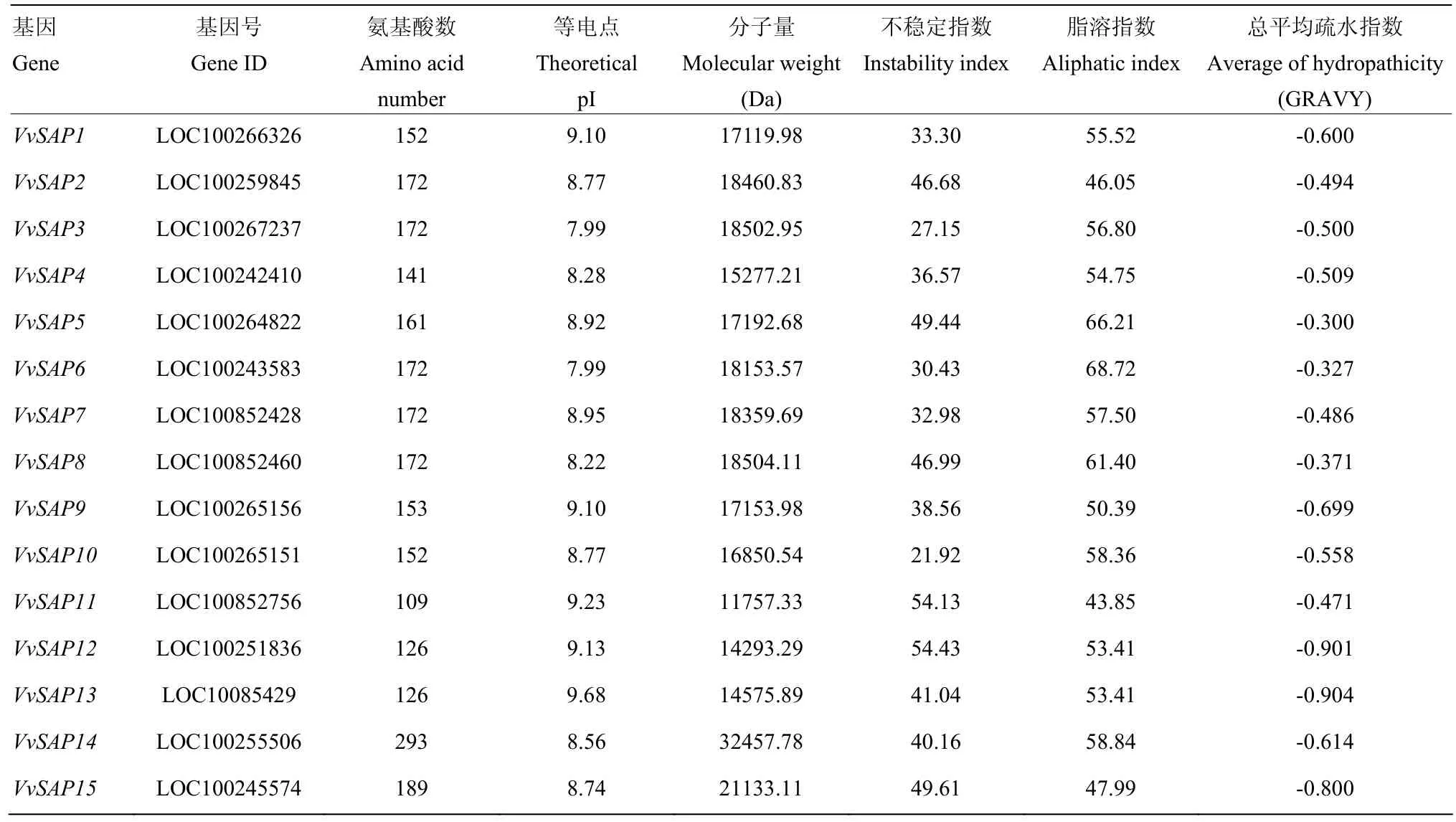
表2 VvSAP家族成员蛋白质的理化性质Table2 Physicochemical property of VvSAP proteins

表3 葡萄SAP家族亚细胞定位预测Table3 Subcellular location prediction of SAP family in Vitis vinifera
2.2 葡萄SAP家族motif和保守结构域分析
利用 MEME在线工具预测 VvSAPs蛋白保守基序,由图2可知,VvSAPs中含有8个保守基序,主要的保守基序有5个:VvSAP1—VvSAP10的N端均含有保守的motif1,VvSAP1—VvSAP13的C端均含有保守的motif2、3;VvSAP14和VvSAP15包含保守基序 motif7、8。除此之外,VvSAP3、VvSAP6和VvSAP8还包含保守基序motif5和motif6。
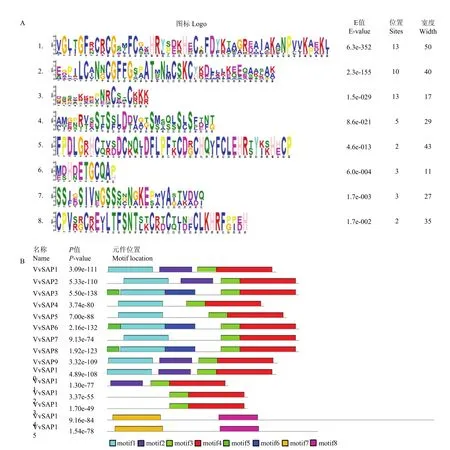
图2 葡萄SAP家族的序列分析Fig.2 SAP family sequence analysis in Vitis vinifera
通过对15个VvSAP蛋白序列进行多序列比对(图3),发现VvSAP1—VvSAP10蛋白序列都在N端含有1个由21个氨基酸LCXNXCGFXGX2ATXNXCXKC组成的A20保守结构域,VvSAP1—VvSAP13蛋白序列在C端均含有1个由32个氨基酸CX2CX4GX2GFX3CG 2FCX2HRX4HXCX2DX组成的 AN1保守结构域,VvSAP14、VvSAP15蛋白序列含有 2个 AN1结构域,不含A20保守结构域。多序列比对结果和motif分析结果基本吻合,进一步说明该基因家族序列高度保守,所有基因都含AN1保守结构域,大部分基因含有A20保守结构域,在葡萄体内可能行使相似功能。

图3 葡萄SAP氨基酸序列一致性分析Fig.3 Identify analysis of grape SAP proteins

表4 VvSAP蛋白的二级结构Table4 The secondary structure of VvSAP
2.3 葡萄SAP家族基因结构和进化树分析
通过对VvSAP家族基因进行结构分析,如图4所示,发现VvSAP1—VvSAP12均无内含子,VvSAP13—vSAP15均含有1个内含子,说明该基因家族相对保守。
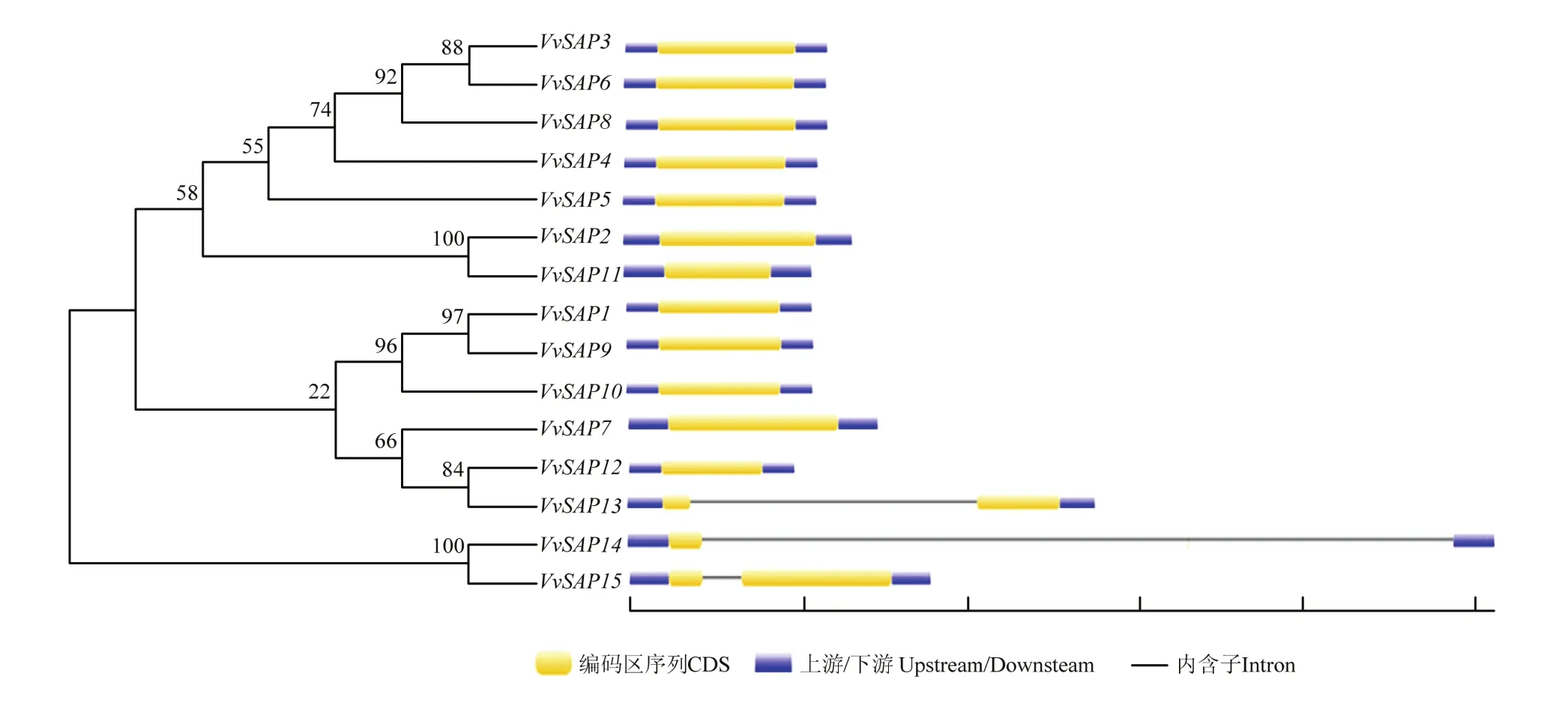
图4 葡萄SAP家族进化树及基因结构Fig.4 The phylogenetic tree and gene structure of SAP family in Vitis vinifera
为了了解葡萄SAP成员间的亲缘关系和进化特性,推测其生物功能,利用MEGA6软件构建拟南芥、水稻和葡萄SAP家族的系统进化树(图5)。结果表明,这3个物种的SAP成员相互嵌合在一起,形成3大分支(Class Ⅰ、Class Ⅱ和Class Ⅲ),表明植物SAP在进化过程中相对保守。其中,Class Ⅲ含有成员最多,共计21个,包括7个葡萄VvSAPs,5个拟南芥AtSAPs和9个水稻OsSAPs;Class Ⅱ所含成员最为保守,都具有A20/AN1保守结构域,共计15个,包括葡萄中 6个(VvSAP3—VvSAP8),拟南芥中 5个(AtSAP2—AtSAP6)和4个水稻OsSAPs;Class Ⅰ包括2个葡萄VvSAPs,4个拟南芥AtSAPs和5个水稻OsSAPs,其成员保守结构域为AN1/AN1-AN1/AN1-AN1-C2H2-2H2。在这些成员中VvSAP6—VvSAP8分别与AtSAP4和AtSAP6、AtSAP5、OsSAP4的亲缘关系较近,VvSAP11—VvSAP15分别与AtSAP7、AtSAP8、AtSAP10、AtSAP14、AtSAP12的亲缘关系较近,推测这些SAP可能具有类似的生物功能。
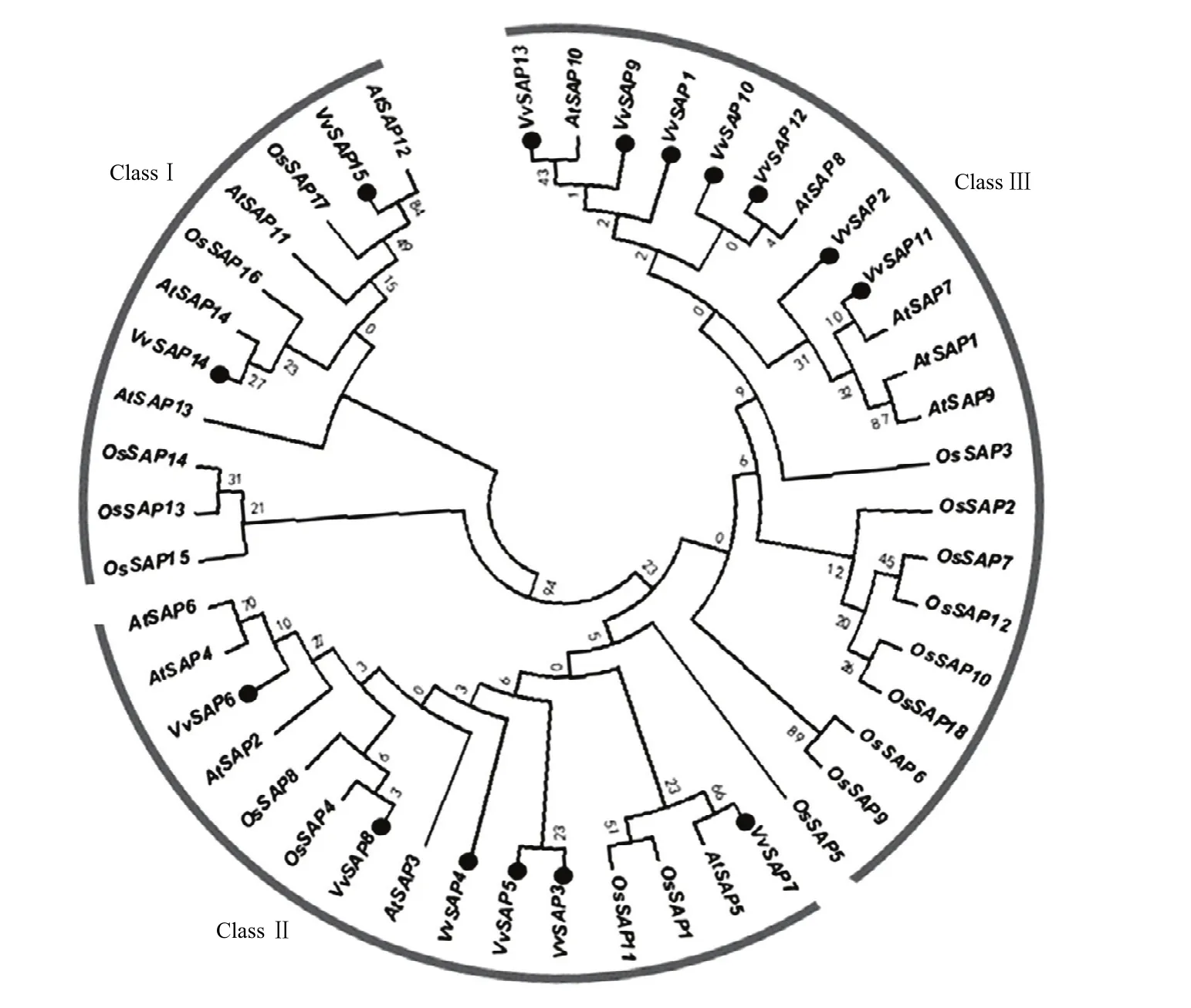
图5 葡萄(●)、拟南芥和水稻SAP家族的系统发育进化树Fig.5 Phylogenetic tree of SAP gene family in V.vinifera(●), A.thaliana and O.
2.4 葡萄SAP表达特征分析
为了明确葡萄SAP的生物钟节律和在逆境胁迫下的表达模式,利用qRT-PCR技术对葡萄叶片中的SAP在不同时间点和不同处理下的相对表达量进行分析。结果显示(图6),VvSAP1和VvSAP9在各种处理下均表达非常低或不表达,初步预测VvSAP1和VvSAP9为假基因。
VvSAP7、VvSAP14、VvSAP15在0:00时,其相对表达量最高,VvSAP5、VvSAP10和VvSAP13在18:00时表达量较高,初步推断葡萄叶片中的SAP在北京时间0:00、18:00相对表达量最高。
VvSAP家族受 50 μmol·L-1ABA、100 μmol·L-1SA、400 mmol·L-1NaCl和4℃低温的诱导,各基因在各处理下表达量具有较显著的差异。在50 μmol·L-1ABA处理条件下,VvSAP家族均呈现上调表达,VvSAP3、VvSAP5、VvSAP6和VvSAP15分别在处理后12 h、8 h、8 h、24 h相对表达量达到最高值;其余SAP相对表达量均在处理 24 h时达到最高值,其中VvSAP7、VvSAP10、VvSAP11、VvSAP12、VvSAP13和VvSAP14在处理24 h时分别是0 h的17.51、37.19、36.63、21.68、58.34和266.83倍,初步推测SAP家族受50 μmol·L-1ABA强烈诱导,且为中后期响应,其中VvSAP14响应最为剧烈。相比之下,100 μmol·L-1SA处理后的SAP家族中,VvSAP11、VvSAP13、VvSAP14在处理4 h内,相对表达量明显上调,表明这3个基因可以迅速响应SA信号,其他基因在处理后期相对表达量较高。
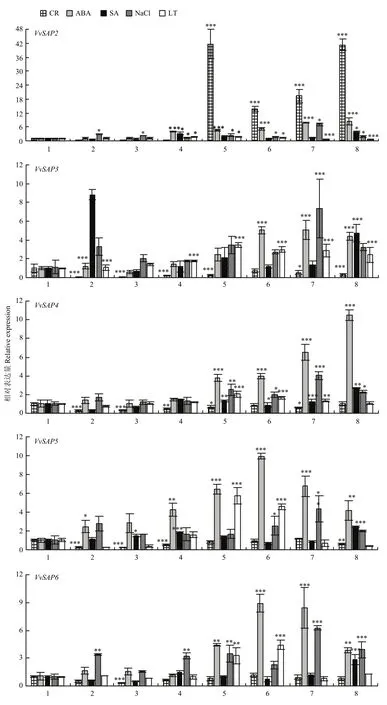

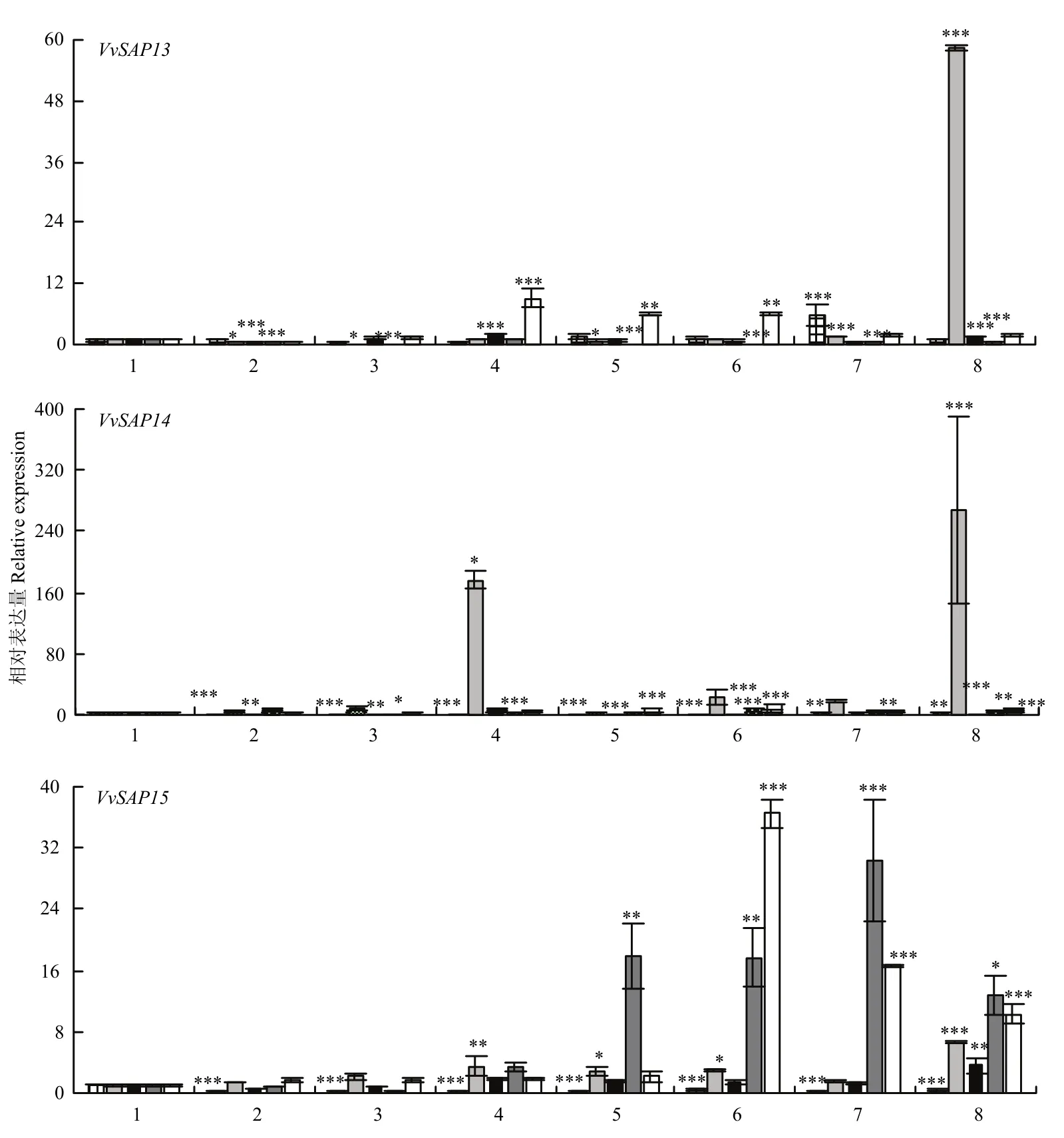
图6 葡萄SAP家族的生物钟节律和在不同处理下的相对表达量Fig.6 Relative expression of SAPs under circadian and different treatments
NaCl盐胁迫和 4℃低温胁迫结果显示,在 NaCl胁迫下,VvSAP10在0 h相对表达量最高,虽然在2 h、12 h时候表达量略微上升,但总体呈下调趋势;其余SAP均受盐胁迫诱导,VvSAP3、VvSAP4、VvSAP5、VvSAP6、VvSAP7、VvSAP12、VvSAP15的相对表达量均在处理后期达到最高值。4℃低温处理下,VvSAP2、VvSAP3、VvSAP4、VvSAP5、VvSAP8、VvSAP10在处理4 h时相对表达量最高,VvSAP15在处理8 h时相对表达量达到最高,为0 h的35.90倍。初步推测葡萄中SAP家族基因对盐胁迫的响应多在后期,其中,VvSAP11表达量上调最明显;对低温胁迫的响应多在中期,其中,VvSAP15表达量上调最明显。上述结果表明,VvSAP家族基因参与了葡萄的非生物胁迫应答,且只有VvSAP10在盐胁迫下表达受到抑制,其他基因在盐胁迫和低温胁迫下表达均受到诱导。
3 讨论
葡萄的生长受多种非生物胁迫的影响,分子生物学的不断发展为提高葡萄的抗逆性提供了一条崭新途径。迄今,已有一些抗逆性相关基因被从葡萄中克隆分离出来,但对葡萄抗逆相关基因的功能及响应冷胁迫的信号转导通路仍然知之甚少[20-25]。SAP是一类含A20或AN1保守结构域的C2H2双锌指蛋白,可直接参与植物对逆境胁迫的响应。A20/AN1型蛋白在动物细胞凋亡、免疫、炎症和植物响应胁迫中都起着重要作用[26-30]。研究表明,A20/AN1蛋白是植物响应逆境胁迫分子机制中的上游调控因子,通过抑制或激活信号传递相关蛋白进而调控下游基因表达[4]。
SAP家族成员已从多个物种中被分离鉴定出来,但不同物种中SAP家族成员数量不同。本研究利用葡萄基因组数据库,共鉴定出VvSAP15个,比拟南芥(14个)[31]、番茄(13个)[10]中的成员数量均多,但少于水稻(18个)[31]和胡杨(18个)[32]。对VvSAP家族的保守结构域进行分析,发现所有VvSAP都含有AN1保守结构域,66.67%的VvSAP中含有A20和AN1两个保守结构域,这和其他物种中的 SAP家族特征相符。在低等生物酿酒酵母(Saccharomyces cerevisae)和烟曲霉(Aspergillus fumigatus)中仅发现了AN1蛋白,在植物SAP家族中仅发现OsSAP18只含有A20结构域,因此预测AN1在进化上可能比A20更为古老[31]。通过分析葡萄、拟南芥和水稻的进化树,发现结构相似的SAP往往亲缘关系较近,此规律在ClassⅡ类SAP中最为明显,所有此类SAP均含A20/AN1结构域。大片段重复和串联重复是植物基因家族扩展的两个主要原因[33],为了更深入地了解葡萄SAP家族的扩张模式,本研究在植物基因组复制数据库发现SAP2和SAP10,SAP6和SAP8,SAP6和SAP12,SAP8和SAP12为片段复制基因,未发现串联重复,因此初步推测大片段复制可能是葡萄SAP家族进化的主要动力。
外显子-内含子结构多样性在基因家族进化中发挥着重要作用,可为系统发育分析提供依据[34-35]。SAP家族的一个重要特征是普遍缺乏内含子,在水稻中,11个OsSAPs没有内含子,6个只有1个内含子,只有一个成员(OsSAP8)有2个内含子[31]。在拟南芥中,3个AtSAPs没有内含子,9个有 1个内含子,只有AtSAP2和AtSAP14分别有2和3个内含子。这些无内含子的SAP可以减少转录后的加工,在非生物胁迫下可以被快速转录和翻译[36-37]。然而,VvSAPs并不完全符合这一假设,VvSAP13—VvSAP15都包含1个内含子,但它们在低温、NaCl、SA和ABA处理下的响应速度和表达变化与其他家族成员没有明显差别。
通过对VvSAPs表达模式进行分析,发现多数VvSAP都具有生物节律,且在0:00和18:00表达量较高,初步推测原因可能因为夜间的生长环境相比于白天较恶劣。所有VvSAPs均受ABA诱导,部分家族成员受 NaCl、SA和低温诱导。其中,具有 A20和AN1两个结构域的Class Ⅱ亚族中的VvSAPs在ABA处理下表达量持续上升。VvSAP6、VvSAP8和OsSAP8[15]同源性较高,且均响应盐胁迫和低温胁迫;VvSAP3、VvSAP5、VvSAP7和 OsSAP1[38]亲缘关系较近,在 NaCl胁迫下的表达模式相似,相对表达量均为上升-下降-上升趋势;VvSAP15和 AtSAP12在进化树上属于同一分枝,且都具有2个AN1保守结构域,其相对表达量在低温和盐胁迫下均上调,根据现有研究,推测VvSAP15为一个氧化还原剂感应器,在氧化还原剂的处理下,其构象改变,与蛋白结合,激活或抑制调控信号传递[39]。根据SAP家族的进化树分析和表达模式分析,推测SAP家族高度保守的结构域使不同物种间亲缘关系较近的SAP表达模式相似,但与所含A20和AN1蛋白的数量无明显关联。
4 结论
从葡萄基因组中鉴定出15个SAP,均含有SAP蛋白特有的A20或AN1保守结构域,可分为3大类。除VvSAP13—VvSAP15含有1个内含子外,其余成员均无内含子。亚细胞定位预测显示,葡萄SAP家族成员在细胞核中均存在。通过实时荧光定量PCR技术对葡萄SAP家族进行表达分析,结果表明VvSAP1和VvSAP9为假基因,其余VvSAP均具有生物节律,且在0:00和18:00相对表达量较高。在响应不同时间、不同逆境胁迫时,不同的基因具有不同的表达模式。

