新型电化学传感器在药物电分析化学中的应用
唐俊彦,王飞,李曹龙
(中国药科大学理学院化学系,江苏 南京 211198)
当前,药物电分析化学在药品质量控制、药物代谢研究、天然药物分析、毒物兴奋剂检测等领域均有广泛的应用。相对于传统分析方法,电化学分析法具有操作简便、灵敏度高、检测限低、响应速度快、易实现原位在线检测等优势[1]。常用的电化学检测方法包括循环伏安法(CV)[2]、线性伏安扫描法(LSV)[3]、差分脉冲伏安法(DPV)[4]、方波溶出伏安法(SWV)[5]、计时电流法(I-t)[6]、交流阻抗法(EIS)[7]等,通过建立目标物浓度与物理参数的定量关系,可实现对药物分子的检测。随着现代科学技术的发展,研究者已开始尝试将多种功能性材料修饰于电极表面,通过材料对电化学信号的放大作用、与目标待测分子之间的特异相互作用等,来进一步提高传感器的综合性能。本文将简要介绍无机纳米材料、分子印迹聚合物、酶、DNA在药物电分析化学中的应用,并对药物电分析化学未来的发展趋势进行简单评述。
1 化学功能材料在药物电分析化学中的应用
1.1 无机纳米材料在各类型代表药物电化学检测中的应用
1.1.1 非甾体抗炎药与镇痛药 非甾体抗炎药(NSAIDs)作为全球使用最多的药物种类之一,临床上被广泛用于多种炎症和发热的治疗及各种疼痛的缓解,代表药物包括扑热息痛(paracetamol)、阿司匹林(aspirin,ASA)、布洛芬(ibuprofen,IBF)等。以吗啡为代表的中枢性镇痛药则主要用于重度疼痛的治疗。由于上述药物使用频率很高,其潜在的不良反应和依赖成瘾性让临床用药安全备受关注。目前已报道的多数药物电化学传感器也与之相关。
在众多NSAIDs中,扑热息痛即对乙酰氨基酚的电化学检测研究最多,其电化学氧化还原行为也研究得最为透彻。Karikalan等[8]深入研究了扑热息痛在丝网印刷碳电极(BPSCE)表面的电化学行为。扑热息痛在电极表面通常较易发生两电子和两质子参与的准可逆氧化反应,生成氧化产物N-乙酰亚胺醌(NAPQI),在pH 7.0的介质中,扑热息痛具有较高的氧化还原活性,可以此作为检测扑热息痛的最佳条件。Liu等[9]对g-C3N4纳米片进行质子化处理后,质子化g-C3N4导电性较原g-C3N4大大增强,比表面积也随之增大。作者通过密度泛函理论计算研究了质子化g-C3N4的结构和电子性质,发现质子化g-C3N4的能带宽度显著降低,呈现导体特征。得益于优异的电化学性质,质子化g-C3N4在检测时,扑热息痛在电极表面的氧化电位更低,产生电流强度更大,线性响应范围较宽,达到1.70~2 020 μmol ·L-1。在检测扑热息痛的相关修饰电极中,碳纳米管(CNT)、石墨烯(GR)、还原氧化石墨烯(rGO)等代表性碳材料[10-11]有着广泛的应用,Cernat等[12]对碳材料在电化学检测扑热息痛中的应用进行了综述。由于CNT、GR等碳材料中富含较多的sp2碳原子,具有良好的导电性,作为电极的修饰材料往往可增强电极对待测物质的电化学响应信号,提高传感器的检测性能,Kurbanoglu等[13]综述了以碳材料为基础的电化学药物传感器研究进展,并在文中列举了多种检测扑热息痛的碳材料传感器。此外,很多碳材料在与金属材料复合后,材料之间所产生的协同效应可进一步提高电极对扑热息痛的检测性能[14-15]。Wang等[15]通过化学还原和电沉积法构建了Au/Pd/rGO复合物。该复合材料利用了rGO和Au良好的导电性和较大的比表面积,且Pd和Au这2种贵金属自身具备良好的催化活性,扑热息痛和对氨基苯酚(4-AP)的氧化峰电位相差324 mV,修饰电极可在不同电位处分开测定两组分的含量,从而实现了对扑热息痛及其制剂中高毒性降解产物4-AP的同时检测。
除扑热息痛外,有关水杨酸(salicylic acid,SA)[16]、ASA[17]、IBF[18]、 贝 诺 酯(benorilate,BEN)[19]的电化学检测也有较多研究。Muthusankar等[17]通过恒电位沉积结合CV法,可控合成了氮掺杂碳量子点(N-CQDs)修饰的Cu2O。该Cu2O暴露有高催化活性的{111}晶面,与N-CQDs复合后导电性提升,稳定性增强,对ASA 的检测限达到 2 nmol · L-1。Montes等[18]则发现不同长径比的多壁碳纳米管(MWCNT)的性质及在电化学检测方面的性能存在差异,短径MWCNT较长径MWCNT在结构中存在更多表面缺陷,具有更低的电荷转移阻抗及更大的电化学活性面积,可更加灵敏地检测IBF。
1.1.2 抗感染药物 抗生素是人类对抗细菌感染的有效武器,但新型耐药菌的产生让抗生素的滥用问题愈发受到重视,人们需要开发能够灵敏检测抗生素的电化学传感器,以更好地检测食品、水体等周边环境中残存的抗生素。Simioni等[20]将纳米金刚石(ND)修饰于玻碳电极(GCE)表面,ND在电极上形成的粗糙表面可提高电极的电化学活性面积,加快电子传输速度,使电极对吡嗪酰胺(pyrazinamide,PZA)的电催化能力增强。Karthik等[6]通过水热反应制备了方块状的钼酸铈(CeM),CeM可对氯霉素(chloramphenicol,CAP)进行检测和降解,同时表现出良好的电催化和光催化活性,如图1所示。将CeM与具有良好导电性和较大比表面积的氧化石墨烯(GO)复合并修饰于GCE表面,可灵敏地检测CAP,检测限达到2 nmol · L-1。此外,GO作为一种良好的负载材料,有效避免了CeM在光催化降解过程中的团聚,维持了材料稳定的光催化活性,除检测功能外还能对CAP本身进行降解处理,实现了材料的多功能化应用。基于金属钼酸盐材料的特点,Karthik等制备的钼酸锡(SnM)材料同样可对具有神经毒性的氯碘羟喹(clioquinol,CQL)进行电化学检测和光催化降解[21]。Shahrokhian等[3]通过电化学聚合方法在MWCNT表面原位制备有机共轭聚合物聚吡咯(PPY),PPY包覆于MWCNT之上,表面呈多孔薄膜结构,能够更好地富集阿昔洛韦(acyclovir,ACV)分子,可对ACV片剂、注射剂及人体血浆中的ACV进行定量检测。
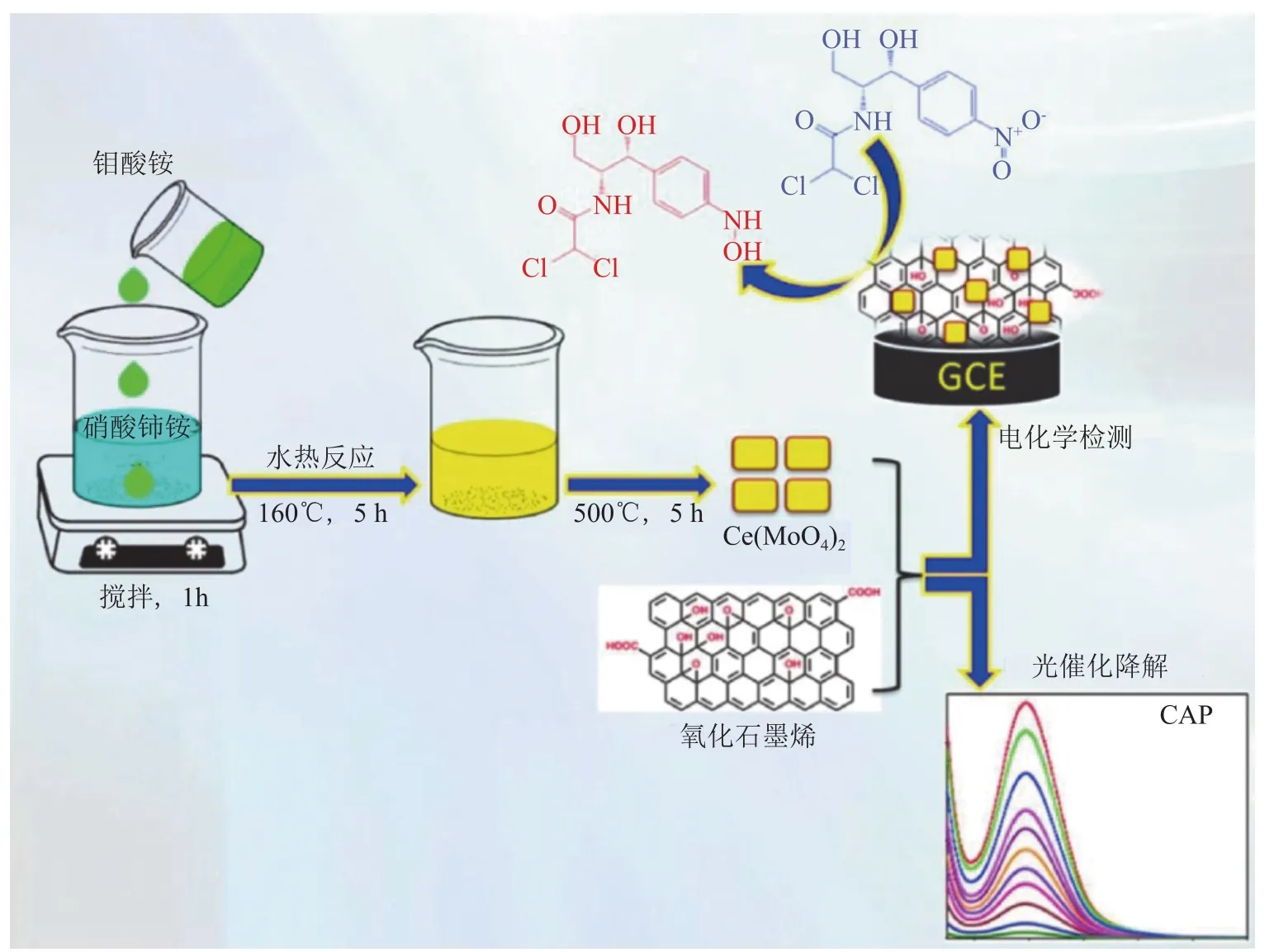
图 1 CeM/GO的制备过程及其在电化学检测和光催化降解CAP中的应用[6]Figure 1 Preparation process of CeM/GO and its application in electrochemical detection and photocatalytic degradation of CAP
1.1.3 精神疾病治疗药物 治疗精神疾病的药物多作用于人体神经系统,可调节人体内异常的神经递质。在临床治疗过程中,维持合适的血药浓度才可更好地调控病人的情绪精神状态,故此类药物的检测也被密切关注。精神阻断剂如氯丙嗪(chlorpromazine,CPZ)[22-25]、氯氮平[26]、利培酮[27]等,抗抑郁药物如丙米嗪[28]、曲唑酮[29]、文法拉辛[30]等,抗癫痫药物如卡马西平(CBZ)[31-32]、加巴喷丁[33]、拉莫三嗪[34]等均有电化学检测的研究报道。Kumar等[23]和Kokulnathan等[25]通过超声化学反应一步制备了钼酸锶(SrM)和钨酸锡(SnW),用于CPZ的电化学检测。以SnW为例,β-SnW表面呈负电荷,其表面的活性位点可与CPZ分子中的N原子之间产生较强的静电相互作用,使之能够快速灵敏地检测CPZ 分子,线性范围为 0.1 ~ 457 μmol · L-1,检测限达到3 nmol · L-1。Pruneanu等[32]利用气相沉积法在GR表面沉积金纳米颗粒(Au NPs),并将此复合材料用于CBZ的检测。GR中的sp2碳原子可与CBZ分子中的芳香环发生π-π相互作用,同时加快电子的传输;Au NPs则扮演了电子在CBZ和石墨烯界面之间传递通道的角色,从而使得修饰电极对CBZ的电催化活性大大提高。
1.1.4 激素类药物 电分析化学中常研究的激素类药物主要包括一些天然激素和抗激素药物。由于自然界中残存的激素类物质在生物体内蓄积会对其生长发育带来诸多不良影响,设计能够灵敏检测激素的传感器将在一定程度上降低其潜在的危害性。Luo等[35]使用聚脯氨酸对介孔碳进行功能化修饰,在3种自然雌激素中,该材料对雌二醇(estradiol,E2)的响应最为理想。以此材料构建的传感器可对女性血清样品雌激素中的E2进行准确定量测定,且检测结果与HPLC-MS/MS法相吻合。Pavinatto等[36]将壳聚糖(CTS)和CNT修饰于FTO导电玻璃表面,CTS中带有正电性的氨基与CNT表面负电性的羧基发生静电相互作用,可在FTO表面形成稳定的层叠状膜结构,并减小电子转移的阻抗大小。CNT中排列的六元环中存在大量π电子,可与炔雌醇(ethinylestradiol,EE2)中的苯环之间产生 π-π作用力,使得修饰电极能够对EE2分子产生特异性吸附,得到选择性较好的检测结果。氟他胺( fl utamide,FLT)和尼鲁米特(nilutamide,NLT)是2种用于治疗前列腺癌的抗雄激素药物,分子结构中均存在硝基,故在电极表面的电化学反应过程一致,如图2所示[37-39]。Zhou等[37]设计了一种由Fe3O4和α-Fe2O3组成的铁氧化物(FeOx)修饰材料,FeOx中同时存在的Fe(III)和Fe(II)构成了理想的氧化还原电对,有利于电子的转移与传输,降低了电荷转移阻抗,提高了电极对FLT的电催化性能。将FLT作用于前列腺癌VCaP细胞后,对细胞进行裂解处理,该修饰电极可对细胞裂解液中的药物含量进行测定,为治疗过程中药物剂量的监控提供了新的检测方法。

图 2 FLT和NLT 2种含硝基药物分子的电化学反应机制[37-39]Figure 2 Electrochemical reaction mechanism of two nitro-containing drugs FLT and NLT
1.1.5 抗肿瘤药物 许多抗肿瘤药物在低浓度条件下亦具有较大毒性,对人体和生态环境的危害性不可忽视。正因如此,对生物体液和环境样本中抗肿瘤药物的灵敏检测尤为重要。电化学传感器对抗肿瘤药物的分析在癌症早期诊断、动态监测药物治疗情况方面具有多种优势。Lima等[40]对抗肿瘤药物的电分析研究进行了系统而详细的综述。目前已报道的抗肿瘤药物电化学传感器几乎涵盖了各大分类中的代表性药物,如紫杉醇[41]、戊柔比星[42]、培美曲塞[43]等。由于篇幅有限,本文挑选了部分代表性研究进行简要介绍。
Zahed等[44]用银纳米颗粒(Ag NPs)对聚苯胺(PANI)进行修饰,PANI不仅提高了复合材料的导电性,同时避免了Ag NPs的自身团聚,有效保留了Ag NPs的电催化活性,从而灵敏地检测5-氟尿嘧啶(5- fl uorouracil,5-FU)。Zhou等[45]通过热解聚多巴胺,NaH2PO2低温磷化的方法,在氮掺杂碳纳米管(N-CNT)表面负载了高导电性的磷化钨(WP)。WP和N-CNT之间形成的协同作用使得复合材料兼具优异的导电性和催化性能,可高效催化甲氨蝶呤(methotrexate,MTX)的电化学氧化反应,从而快速灵敏地检测小体积全血样品中的MTX。此外,该修饰电极可多次循环使用,稳定性良好,为癌症治疗过程中药物浓度的监测提供了一个便携检测平台。Cui等[2]在N型半导体TiO2的基础上,将其与P型半导体NiO结合,通过二者之间形成异型p-n异质结,加快电荷传输速度,提高电化学活性。研究发现,向肺癌细胞中加入苄基鸟嘌呤(O6BG)后,细胞在电极表面所产生的特征氧化还原峰消失,这主要是由O6BG改变了细胞膜的膜结构所导致。由于该电极可同时对抗肿瘤药物和肿瘤细胞进行分析检测,在诊断医学和分子生物学中具有巨大的应用前景。
1.1.6 多组分药物同时检测 除了设计开发对某一特定药物分子具有优异检测性能的电化学传感器,在实际情况下,样本中往往存在不只一种电活性物质,如何使得传感器对各活性组分的检测保持良好的选择性,确保各组分之间在同时检测的条件下不会相互干扰,需要研究者加以考虑。以Mahmoud等[5]的研究工作为例,他们通过水热反应一步制备了BiO纳米棒,并将其修饰于丝网印刷电极(SPE)表面。在pH 2的强酸性检测介质中,扑热息痛和异烟肼(isoniazid,INH)均处于质子化状态(pKa>2),可与表面负电性的BiO相互作用,检测时峰电位分离显著,二者之间无相互干扰,可实现体液及制剂中的2种具有潜在肝毒性药物分子的定量检测。在药物分析领域,复方制剂和多药联用中的定量检测均会遇到多组分同时测定的情况。通过开发新型材料、优化分析方法条件,在实现上述目标的同时,可帮助人们更好地评估用药效果,降低药物相互作用所引发的不良反应。目前有关多组分药物的同时检测也正逐渐成为药物电分析化学研究的热点[4-5,46-53],相信在未来一定会有更多的研究成果为解决上述问题提供有效方案。
1.2 分子印迹聚合物材料在药物电分析化学中的应用
除了无机纳米材料外,聚合物材料也是电化学药物传感器的另一大类修饰材料。Shrivastava等[54]与Pourbasheer等[55]在2篇综述中围绕导电聚合物(CP)及其复合材料在电分析化学中的应用进行了详细的论述。然而在众多聚合物材料中,分子印迹聚合物(MIP)在结构和检测原理等多方面均与常见的几种CP有着明显的区别,故此部分将对MIP进行单独介绍。
以MIP为基础的电化学传感器通常是在模板分子与功能化单体共存的条件下进行电化学聚合反应,在电极表面形成结构和尺寸能够恰好容纳模板分子的膜状聚合物。通过去除模板分子,即可得到具有“空腔”特征的分子印迹。检测过程中,当目标分子再次与聚合物结合时,即可产生电化学信号。MIP的制备过程与检测原理如图3所示[56-57]。这种传感器的优势在于MIP的使用成本相对较低,稳定性较高,而且具有很强的选择性和专属性,在抗干扰能力上较普通传感材料更胜一筹。有关MIP在药物电化学分析中的应用研究也在近年来逐渐增多。
Florea等[58]在金电极表面基底构筑了对吉西他滨(gemcitabine,GMT)具有极高灵敏度的MIP膜,检测限达到3.8 fmol·L-1。Yarman等[59]以间苯二胺和间苯二酚为原料在GCE表面设计了一种可用于检测他莫昔芬(tamoxifen,TAM)的MIP。当TAM再次结合时,铁氰化物指示分子的电流信号逐渐下降,通过建立电流下降幅度与TAM浓度之间的关系,可间接检测电化学活性较低的TAM。值得注意的是,尽管TAM在人体内的一种代谢产物——4-羟基他莫昔芬也可引起电流信号的下降,但TAM所引起的电流下降幅度较4-羟基他莫昔芬要大2.3倍,这说明该修饰电极对TAM分子具有优先识别作用,选择性很强。除上述材料外,β-环糊精(β-CD)是一种具有典型疏水空腔结构的分子,可对许多生物客体分子产生分子识别作用,在MIP传感器中也有大量的应用。Liu等[57]基于β-CD设计了一种能够检测米托蒽醌(mitoxantrone,MTX)的MIP。由于MTX可与β-CD的空腔发生特异性主-客体作用,MIP/GCE可灵敏、高选择性地检测MTX,且一些与MTX分子结构类似的化学分子或药物均不会对MTX的检测带来显著的干扰。

图3 分子印迹聚合物的制备过程与检测原理示意图[56-57]Figure 3 Scheme of preparation and detection principle of molecularly imprinted polymer
MIP可高度匹配目标待测分子,发生类似于酶与底物之间的相互作用,这种特异性的结合作用在一定程度上避免了氧化还原电位差异对电化学检测选择性所造成的影响,对传感器选择性的提高大有帮助,且MIP相较于酶具有更好的稳定性,能够在复杂的样品中长时间检测目标物。Adumitrachioaie等[56]在MIP应用于药物电化学检测的综述中对相关研究进行了系统的列举。通过设计与目标药物分子相“匹配”的MIP,MIP的检测对象可涵盖多种常用药物。与酶类似,MIP与碳材料、金属材料复合后也可进一步提升传感器的灵敏度,对目标物的检测限可达 nmol · L-1、pmol · L-1,乃至 fmol · L-1级别,在药物电分析化学领域具有广阔的应用前景。
2 生物功能材料在药物电分析化学中的应用
2.1 以酶生物大分子为基础构建的电化学生物传感器
在以酶生物大分子作为修饰材料的电化学传感器中,利用酶对相关药物分子的催化反应可对其进行专属性检测[60]。此外,治疗痛风、抑郁症、阿尔茨海默病、癌症等疾病的药物大多属于酶抑制剂。根据酶抑制机制所设计的电化学生物传感器可特异性地检测作为抑制剂的药物分子,其检测原理如图4所示。底物分子与酶之间类似“钥匙-锁”的相互作用,为药物电分析化学提供了另外一种高灵敏、高选择性的检测方法。同时,基于底物与酶相互作用过程中电化学信号的变化,可用于设计和筛选对相应酶靶标具有药理活性的新型药物分子。
El Harrad等[61]对2007—2017年中基于酶抑制机制所设计的药物电化学传感器研究进行了综述,介绍了与乙酰胆碱酯酶(AChE)[62-63]、单胺氧化酶(MAO)[64-65]、黄嘌呤氧化酶(XO)[66]、细胞色素P450酶(CYP450)[67-73]、酪氨酸酶(TYR)[74-75]相关的研究报道。在人体内的众多生物活性酶中,CYP450是一支重要的酶系,该家族中的多数同工酶均参与了多种不同药物的体内代谢过程。以该酶系为基础所设计的电化学生物传感器可检测不同类别的多种药物,如帕罗西汀[67]、萘普生[68]、红霉素[69]、阿比特龙[71]、酮康唑[72]、右美沙芬[73]等。还有部分酶作为一大类药物的主要作用靶点,可利用其这一特点检测多种具有类似药理作用的药物分子。例如谷胱甘肽-S-转移酶(GST)为多数抗肿瘤药物的作用靶点,Materon等[76]通过抗肿瘤药物与1-氯-2,4-二硝基苯(CDNB)竞争GST的活性位点可导致电化学信号下降的方法,对顺铂、吉西他滨、多柔比星、卡铂进行了定量检测。再如以环氧合酶(COX)-1、COX-2为基础的传感器可对NSAIDs——萘普生、双氯芬酸、IBF和托美丁进行专属性检测[77];以α-糖苷酶(AG)为基础的传感器可对抗糖尿病药物(AG抑制剂)——格列美脲和阿卡波糖进行检测[78],并能够在药用植物的提取物中寻找潜在的抑制剂成分[79]。
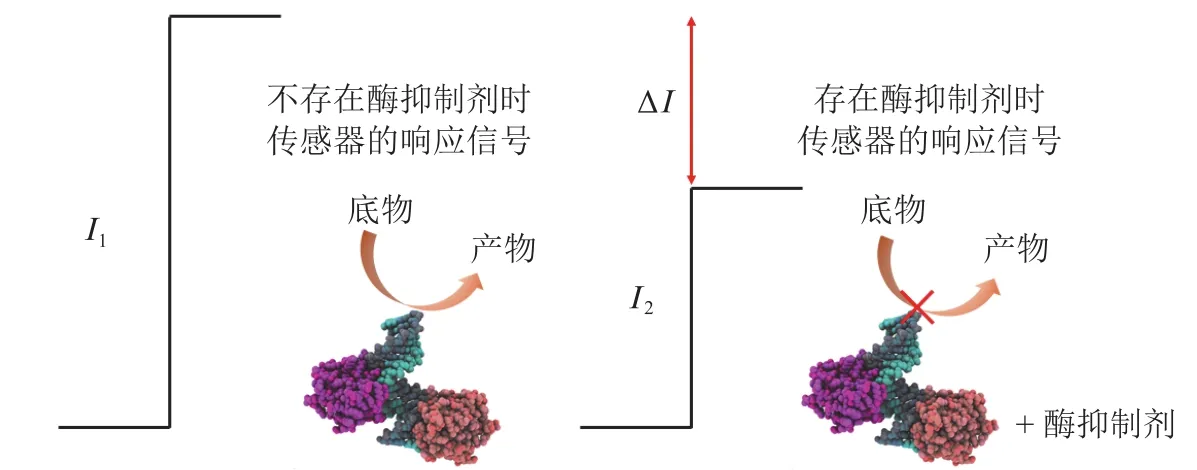
图 4 根据药物分子对酶活性抑制程度所设计的酶电化学生物传感器[61]Figure 4 Enzyme electrochemical biosensor based on the inhibition degree of enzyme activity by drug molecules
通过酶生物大分子对药物进行电化学检测,在一定程度上拓宽了电化学检测在药物分析领域内的适用范围,人们可从药物的药理作用出发,寻找其专属性的作用酶来设计合适的电化学传感器。此外,在酶生物传感器的基础上修饰金属材料、碳材料等,可进一步提高传感器的灵敏度,改善电极的导电性,增加电极表面的有效活性面积以负载更多的酶分子,并降低酶分子的失活可能性,这将有助于传感器的长期多次重复使用,也是此类传感器改进发展的趋势之一。
2.2 以DNA为基础构建的电化学生物传感器
DNA与酶在材料类别上均可划归于生物大分子。此类电化学生物传感器通常是将核酸分子所形成的膜固定于电极表面,目标物与DNA相互作用所引起的DNA结构改变可产生可测量的信号。Karadurmus等[80]从检测原理、测试方法、电极分类这3个角度介绍了DNA生物传感器在药物分析中的应用情况,并系统列举了此类传感器在各类型药物分子电化学检测中的研究进展。由于目标物与DNA的相互作用既是传感器产生响应的原理基础,也是提高传感器灵敏度的改进出发点,二者相互作用的研究被人们集中关注。Diculescu等[81]在检测抗癌药物达鲁舍替过程中发现,药物与DNA的双螺旋结构相互作用可引起鸟嘌呤与腺嘌呤氧化峰电流信号的增强。在此基础上,作者对达鲁舍替进行原位氧化后,其产生的含氮自由基氧化产物可与鸟嘌呤C8位的电活性中心作用形成加合物,造成鸟嘌呤电流信号的下降,由此提出了该药物引起DNA损伤的可能机制(见图5)。DNA作为多数抗肿瘤药物的作用靶点,人们依据上述原理设计了许多DNA电化学生物传感器用于抗肿瘤药物的检测,如甲氨蝶呤[82]、亮丙瑞林[83]、氟维司群[84]、紫杉醇[85]、巯嘌呤[86]、蒽环类药物[87]等。Lozano等[88]还通过修饰双链DNA对具有抗肿瘤活性的化合物7ESTAC01进行了检测,并借助紫外光谱法和密度泛函理论研究了药物与DNA的作用机制。这些研究将帮助人们更深入地理解DNA与抗癌药物之间的相互作用,并为抗肿瘤活性化合物的发现提供指导帮助。

图 5 达鲁舍替氧化还原代谢物-鸟嘌呤加合物形成的可能电化学机制[81]Figure 5 Proposed electrochemical mechanism of danusertib redox metabolite-guanine adduct formation
3 结语与展望
上文简述了无机纳米材料、MIP、酶、DNA在药物电分析化学中的应用研究进展。随着越来越多性能出众材料的涌现,电化学传感器种类愈为丰富,性能更加优异;电化学检测法因响应迅速、灵敏度高、检测限低、选择性好等优势得到了更好的发挥,这大大推动了电化学检测法在药物分析学科中的应用与发展。除常规制剂中的药物检测外,基于碳材料、过渡金属化合物、聚合物、生物分子的电化学生物传感器对兴奋剂、毒品、农药、生物毒素等具有特殊生理毒理活性分子的检测也正逐渐成为研究领域内的热点[89-92]。但药物电分析化学在实际应用过程中依然存在一些挑战,为满足更高的检测要求,仍有许多难题需要攻克。根据目前的研究现状和分析检测中可能遇到的困难,药物电分析技术的未来发展将主要集中在以下几个方面。
第一,药物分析中常会遇到不同混合物组成的复杂样本,其中不仅可能包含多种待测的分析组分,基质中还会存在大量干扰物质。干扰物质的存在会造成电极表面污染,引起信号基线漂移等问题,影响检测结果的准确性,其自身较大的含量也对样品中的目标物进行了“稀释”,降低了传感器对目标物的灵敏度。为解决这一问题,可在电极表面修饰功能性材料,或从原理层面设计新的检测方法,以进一步提高传感器的选择性[1]。另外,为保证传感器对目标物具有足够的灵敏度,可采用微流控技术加快目标物到传感器界面的传质过程,帮助分析物在电极表面进行预富集,增强信号的强度,进而提高传感器的灵敏度[93-94]。此外,开发多路电极的联用系统,构建电极阵列以同时检测多种目标物分子,也可实现多组分同时测定的目标[95]。
第二,目前多数具有电化学活性的药物分子均可通过合适的修饰电极平台,实现快速、灵敏的直接分析。从结构上看,具有电活性的药物分子一般含有碳碳共轭双键、羰基、硝基、亚硝基、羟基、巯基等电活性基团[1]。这些基团可在一定的电位下在电极表面发生电子转移,引起电化学信号的变化。Ozkan等[96]系统列举了这些基团对应的氧化还原电位,由此通过循环伏安法可更快地确定含有相关基团药物分子的电化学响应电位,进而实现对药物分子的准确灵敏检测。但值得注意的是,有些药物分子电化学活性较差,甚至属于非电活性分子,直接检测的效果往往并不理想,通常需要采用间接检测方法进行替代。以非电活性药物金刚烷胺为例,晏根平[97]设计了一种β-CD聚合物与rGO的复合物(β-CDP/rGO),并在β-CD的空腔中嵌入具有电活性的亚甲蓝分子。由于金刚烷胺与β-CD的结合力较亚甲蓝更强,金刚烷胺分子将空腔中的亚甲蓝置换后,亚甲蓝的电化学信号将随之下降,由此可对金刚烷胺进行间接检测。但当前有关非电化学活性药物分子的检测研究仍然较少,在药物电分析的研究领域中相对空白,未来值得在该方面开展更多的研究工作。
第三,目前多数修饰电极均可实现体外检测血液、尿液样本中的药物含量,但在细胞水平上的体内原位活体分析、对汗液等其他生物体液中药物浓度的连续动态监测的应用依然不够成熟。设计开发微电极、柔性电极并将其应用于生物体的原位分析检测,可很好地弥补传统电极尺寸较大、结构刚性、生物相容性较差等问题。例如Tai等[98]在聚对苯二甲酸乙二醇酯(PET)柔性基底表面修饰CNT/na fion复合物,该柔性电极可连续监测人体汗液中咖啡因的浓度变化(见图6)。

图 6 可穿戴汗液传感器用于连续监测人体汗液中咖啡因的浓度[98]Figure 6 Wearable sweat sensor for continuous monitoring of caffeine concentration in human sweat
由于体内原位活体分析可提供更多微观水平上的生理生化信息,而从汗液等生物体液中检测药物分子的浓度,不仅能够帮助人们间接监控血药浓度变化并理解药物的代谢动力学过程,还可有效避免血液、尿液样本在采集上的繁琐流程,实现连续动态的实时监测。作为未来分析检测技术发展的热门方向之一,相关研究也将促进生理学、病理学、神经学、药学等生命科学的进步。
药物电分析作为药物分析的重要分支学科,目前在分析领域和技术上都已得到了巨大的拓展。新型功能性材料的出现也为药物电化学传感器性能的提升与优化提供了更多的选择。随着原理的创新、材料的发展、方法的完善、技术的进步,药物电分析将不断从简单走向复杂,从粗糙走向精准,从体内走向体外,从静态走向动态,为药品质量控制、药物代谢分析、新药筛选发现等研究提供更为全面的帮助与指导。相信在多学科交融的大背景下,药物电分析化学将与生命科学、材料科学、纳米技术等前沿学科在未来相互促进,取得更大的发展。

