脂肪源基质血管组分细胞及其临床应用进展
赵贤省,金亮,胡文军
(中国药科大学生命科学与技术学院,江苏 南京 211198)
在组织工程和再生医学中,脂肪组织逐渐成为更具潜力的干细胞来源。人体中脂肪组织来源丰富,可以通过吸脂术轻松获得。脂肪组织经过处理,除去成熟脂肪细胞、结缔组织和来自脂肪抽吸物的血液等杂质后,得到的异质细胞群被称为基质血管组分(stromal vascular fraction,SVF)[1]。SVF中包含多种细胞类型,例如造血干细胞、间充质细胞、内皮祖细胞、内皮细胞、周细胞和巨噬细胞等[2](见表1)。最初研究较多的是Zuk等[3]鉴定的脂肪来源干细胞/基质细胞(adipose-derived stem/stromal cells,ASCs),因其具有多能分化潜力、旁分泌特性以及对再生医学有重大影响而被广泛关注。ASCs是由新鲜分离的SVF经过贴壁传代培养后得到的一种同质干细胞群。然而相较于ASCs,SVF不需要任何细胞培养过程,分离获得后可直接使用,因此相对更加安全,能够满足较低的监管标准,从而受到众多临床研究者的青睐[4]。
1 脂肪来源SVF细胞
1.1 SVF的分离
人体中脂肪组织一般分为皮下脂肪和内脏脂肪,可通过吸脂术或手术切除的方式获取,常见的取材部位包括腹部、臀部、前臂和腹股沟处等。Sinno等[5]研究发现,脂肪的不同取材部位对其活性无显著性影响。总的来说,SVF的分离方法一般可以分为两大类:使用蛋白水解酶消化脂肪的酶法和不使用蛋白水解酶的物理机械方法。
酶法常采用Ⅰ型胶原蛋白酶来消化脂肪组织,大致过程概述如下:脂肪组织与酶按适当比例混合后置于37℃环境中震荡消化1 h左右,加入等量完全培养基终止消化,随后离心弃去上清,再加入磷酸缓冲盐溶液(phosphate bu ff er saline,PBS)重悬洗涤,最后用特定孔径滤网过滤即得SVF悬液。各个实验室在消化过程中所采用的酶浓度、离心速率、消化时间以及滤网孔径等条件可能并不完全相同,导致最后分离得到的SVF的活性、产率和表型均有一定的差异[6]。酶消化法可以从脂肪组织中获得较多的有核细胞,并且易于分离得到基质/干细胞,然而造血来源细胞则产量不佳[7]。同时需要注意的是酶消化法过程中可能会在终产物中引入残余的胶原酶外源蛋白,因此美国FDA对SVF的临床应用制订了严格监管标准。
不使用酶的机械消化方法,采用了包括诸如血清消化、机械振荡或推注剪切等方式来处理脂肪组织。Zeng等[8]将脂肪组织直接置于胎牛血清中进行消化,但是整个消化过程耗时较长,需要3 d才能消化完全。Markarian等[7]利用机械振荡的方式处理脂肪组织,相较于酶消化法所得SVF中干细胞活性有所提升,但其细胞总量不高。Tonnard等[9]通过在2个连接的注射器之间反复推注脂肪来乳化脂肪组织,经离心去除上层油滴后可得到一种被称为纳米脂肪的胶状物质,此法操作相对简单,但所得细胞活性有待提高。相对于酶消化法,机械消化法均不涉及使用异种蛋白酶,所以安全性较高,但是脂肪组织经过这种长时间或剧烈的机械方式处理后,细胞得率和活性都不够理想。
除了以上2种人工分离方法之外,还有一类自动装置系统可以分离SVF。使用这种装置可从脂肪组织中快速自动分离出可注射使用的SVF。虽然自动化处理系统已经发展了很长时间,但是大多数仍处于实验阶段,美国Cytori公司的Celution®系统是第一个自动分离SVF的商用系统[10]。目前,大约有30种不同的自动化和半自动化系统正在开发中[11]。虽然所使用的技术不尽相同,但大多选择的是成熟的酶促反应方案,例如SundarRaj等[12]报道的Stempeutics®系统,该系统使用了更高效安全的酶消化方式,能在相对密闭的环境中自动分离成熟脂肪层,最后通过高效过滤实现SVF的分离和浓缩。
1.2 SVF的表型
细胞的表面分子,例如分化抗原(cluster of di ff erentiation,CD),对于细胞之间或细胞与环境之间的相互作用至关重要,同时也可用于鉴定细胞群中的不同细胞类型。脂肪组织分离得到的SVF是含有多种细胞的异质细胞群,可通过不同细胞表面的CD分子差异进行鉴别[13]。尽管国际细胞治疗协会曾发表声明对SVF进行了定义,但目前学术界对SVF细胞的表型鉴定还未达成共识[14]。本文整理了先前的研究,按照SVF中细胞的大小及其表面分子抗体类别进行了总结(见表2)。

表 2 SVF中细胞的大小及表面标记Table 2 Size and surface markers of cells in SVF
CD45是一种经典的细胞标志物,可用于鉴定除红细胞以外的造血系细胞。CD235可用于检验细胞群中是否含有红细胞。CD31是内皮细胞及其祖细胞的经典标志物,同时也存在于血小板和白细胞表面。使用CD45和CD31这2种标志物的对应抗体对SVF进行表面标记,通过流式分析仪即可鉴定出内皮细胞组分(CD45-CD31+)[26-28]。CD34最初被作为间充质细胞的主要阴性标记[29],随后众多研究发现该标志物在新鲜分离的SVF中可以被检测到,但是会随着不断的传代培养而逐渐消失。因此,CD34被视为前脂肪细胞和祖细胞的标志物[30]。
Bourin等[2]研究表明,SVF中所含的基质组分细胞的表面标志组合为CD45-CD235-CD31-CD34+,同时CD13、CD29、CD73和CD90等脂肪干细胞经典标志物在CD45-CD31-CD34+这一细胞群中高表达,因此它们也可以作为辅助标志物用于鉴定ASCs组分[17,31]。
SVF中含有较多血管周围细胞,占总细胞量的50%以上,其中可以分为内皮祖细胞、前脂肪细胞和周细胞等[17]。研究发现无论是人工还是自动分离系统消化所得的SVF中,CD146阳性标记的细胞中约90%都表现为CD34阳性[12]。因此,内皮祖细胞表型为CD45-CD31+CD34+CD146+;与脂肪组织的血管壁密切相关的周细胞表型为CD45-CD31-CD146+;前脂肪细胞中含有较多的干细胞样组分,其表型为CD31-CD45-CD146-CD34+。
巨噬细胞是SVF中重要的免疫细胞。在最初的研究中,Astori等[32]发现在SVF细胞中,单核细胞标志物CD14阳性标记的细胞约占10.9%±9.6%。同时研究表明,SVF中的这些CD14+单核细胞具有促进组织血管新生的强大功能[33]。Eto等[34]在SVF中发现的M2表型巨噬细胞呈CD34+,且具有和间充质细胞类似的特征,例如细胞形态、贴壁吸附性和多能性等,因此该类型巨噬细胞的表型被定义为CD45+CD14+CD206+。
2 SVF临床治疗应用
2.1 脂肪移植
整容手术越来越多地采用转移人体自体脂肪的方式来进行丰胸或改善面部皮肤及轮廓[35-36],但临床报告显示,大部分脂肪组织在注射到受体部位后会被机体吸收而无法存活[37],其主要归因于移植物的缺血和缺氧[38]。Matsumoto等[39]发现,将新鲜分离的SVF混合到脂肪中进行移植可有助于组织血管重建并能显著提升移植物的保留率,他们将这种改善脂肪移植物存活率的方法定义为细胞辅助脂肪移植 术(cell-assisted lipotransfer,CAL)。Yoshimura等[40]将CAL应用到临床美容丰胸中,当植入270 mL脂肪组织后乳房体积可增加100 ~ 200 mL,且能保持乳房的自然纹理和轮廓。在CAL被证明有足够的安全性后,Li等[41]在临床上将其应用到面部轮廓重建中,最后也取得了满意的临床效果,进一步证明了CAL方案可明显提高脂肪移植物的存活率。Tanikawa等[42]使用混有SVF的脂肪移植物,成功使颅面微小症患者的软组织明显增加。Charles-De-Sá等[43]将CAL用于面部皮肤改善的治疗,发现CAL可促进衰老皮肤的血管增多、胶原重塑和新弹性纤维的形成。同时研究也表明使用SVF或ASCs均能达到组织学上相同的治疗效果。但是也有一些研究发现,在切除乳腺肿瘤后使用CAL进行乳房重建时,ASCs可以促进乳腺癌细胞的增殖、迁移和转移[44-46],因此,在某些癌症患者的脂肪移植中可能不适合采用CAL手术。
2.2 糖尿病
SVF在糖尿病所引起的多种并发症中也有着广泛的应用,例如用于改善糖尿病足溃疡(diabetic foot ulcer,DFU)和糖尿病视网膜病变等[47-48]。作为糖尿病最常见的并发症,DFU是一种根植于缺血和神经病变的疾病,随着病程的延长,溃疡处极易引发感染而加重病情[49]。成纤维细胞是参与DFU伤口愈合的主要细胞,Chae等[50]在体外研究发现,使用SVF对DFU进行治疗后,成纤维细胞的数量不仅显著增加,由成纤维细胞合成的胶原物质也明显增多。随后进行的临床试验结果显示,SVF治疗的患者伤口愈合率为100%时,对照组的愈合率仅为62%,说明SVF可以加速伤口愈合。随后在动物实验中发现,将含有SVF的Pluronic水凝胶注射到伤口周围时,可增加成纤维细胞数量及加快再上皮化过程,从而明显加速伤口愈合过程。Didangelos等[51]将自体血浆来源的SVF应用到1型糖尿病患者的DFU时同样取得了很好的治疗效果。Tan等[52]进行的基础研究显示,SVF可通过上调伤口周围的细胞因子,提升高血糖环境中的成纤维细胞活力及迁移水平,使得伤口愈合加快。Eto等[34]发现SVF中的巨噬细胞超过90%都是具有抗炎特性的M2表型,这类细胞也对DFU的愈合起到积极的抗炎作用。
糖尿病视网膜病变的特征在于视网膜血管网络的功能障碍和退化[48]。Rajashekhar等[53]将SVF传代培养得到ASCs后注射到糖尿病大鼠中,随后发现血管渗漏以及细胞凋亡的情况都得到减少。研究者认为,ASCs与视网膜内皮细胞间的相互作用可以促进血管形成并能阻碍神经退行性病变的发生。Park等[54]在糖尿病视网膜病变动物模型中注射SVF后,发现内皮祖细胞和脂肪基质细胞整合到了受损的视网膜血管壁中,同时ASCs也可以通过旁分泌作用起到积极的影响。
2.3 克罗恩病
克罗恩病是一种存在于胃肠道中的以炎症性肠紊乱为特征的异常炎症,其病症包括腹痛、血性腹泻及肠梗阻等,病理变化会从炎症逐渐引发溃疡并最终形成瘘管[55]。虽然克罗恩病的确切病因还不确定,但有研究表明,环境改变和遗传异常等因素可导致机体的免疫调节、黏膜屏障和细菌清除等功能障碍[56]。随着SVF在糖尿病足溃疡中的广泛应用,越来越多的研究者也选择使用SVF来尝试治疗克罗恩病[57]。体外研究发现,SVF中的ASCs组分可以抑制T细胞的异源性反应,这可能是由于ASCs和M2表型的巨噬细胞对细胞微环境进行了免疫调控[58]。Dryden等[59]采用生物支架承载SVF的方式治疗模型动物,相比于直接使用SVF的方式,实验组动物的瘘管中血管新生更快且溃疡愈合时间更短。在临床试验中,Philandrianos等[60]将患者的自体SVF细胞局部注射到病灶周围后,所有的外部创面完全再上皮化。经过核磁共振成像也未检测到瘘管,患者也没有出现任何严重的不良反应,进一步肯定了该临床细胞疗法的安全性。此外,Molendijk等[61]提出了一种使用ASCs细胞来治疗肛周克罗恩病的标准化方法,使用这种标准化方案能更加有效地评估这种细胞局部治疗的疗效。
2.4 骨再生及骨关节炎
最初的基础研究发现,ASCs在动物模型中可以诱导骨再生以及帮助骨骼快速愈合[62]。随后的临床研究也发现,使用ASCs结合β-磷酸三钙支架来辅助治疗颅骨再生,可取得良好的治疗效果且没有任何临床相关的并发症[63]。此外,脂肪源干细胞除了能够诱导骨形成外,还能将其施用到动物模型的骨缺损处,相关的实验已经证明了其具有加速骨骼愈合的潜力[64]。鉴于ASCs治疗的成功案例,研究者开始关注SVF在骨科方面的应用前景。Mehrkens等[65]使用诱导试剂成功将SVF细胞诱导分化为成骨细胞并产生了新的骨组织,证明了SVF的成骨潜能。Jurgens等[66]分别将SVF和其传代培养的ASCs接种到胶原支架上来治疗山羊膝盖软骨缺损,结果显示这2种支架中都发现了骨骼再生且两者无明显差异。但是最新的研究表明,SVF在成骨细胞分化和刺激成骨细胞分泌可溶性因子方面,具有比ASCs更好的骨诱导能力[67]。
在骨科中另一类广泛应用SVF治疗的疾病是骨关节炎。2011年,Pak[68]首次在临床上向膝关节内注射患者自体SVF,成功治疗了骨关节炎。随后的大量研究都显示出类似的治疗结果[69]。Nguyen等[70]通过设置空白对照实验,进一步验证了脂肪SVF关节注射的安全性和有效性。在临床中也有将SVF与细胞外基质及透明质酸等进行联合使用,一起注射到髋关节中,最后成功在患者的骨关节中发现了再生的软骨样组织[71]。Bansal等[72]将SVF与富含血小板的血浆进行混合,随后注射到患者膝关节内。临床评估报告显示该方案可明显降低患者疼痛水平,同时也显示出了良好的安全性。
2.5 在其他疾病中的应用
硬皮病又称为系统性硬化症,是一种临床表现多样、多器官损伤的自身免疫性疾病,病理性特点为皮肤和内脏的纤维化并伴有血管病变[73]。Granel等[74]在2014年开展临床试验,将硬皮症患者自体SVF注射到手指中,初步验证了SVF细胞治疗的安全性和有效性。12个月的随访报告显示,患者手部的皮肤硬化、水肿以及手部力量都有了明显的改善[75]。由于SVF在糖尿病足等溃疡中具有较好的治疗效果,所以其逐渐也被应用于皮肤烧伤等与创面愈合相关的适应证。例如在烧伤治疗中,SVF的使用可以减弱皮肤移植物所引起的感染和免疫排斥等问题,使得皮肤移植物的存活率增加[76]。Atalay等[77]发现,皮下注射SVF可以增加成纤维细胞活性和血管形成,同时也可以减少炎症进而改善烧伤创面的愈合情况。SVF出色的血管再生能力还在心肌梗死及严重肢体缺血等病症的治疗中得到了验证。研究者向心肌梗死模型动物中静脉注射SVF后,可以明显观察到梗死面积减小,且无任何明显不良反应发生[78];Darinskas等[79]在临床上向严重肢体缺血患者多次肌肉注射自体SVF,最后发现患处动脉中形成了大量血管侧支网络,由此说明SVF对于此类缺血性疾病具有良好的通用治疗效果。
3 SVF临床试验的现状
目前,SVF研究处于临床前研究阶段或正朝着人体试验的方向发展。自SVF首次应用到临床以来,有关SVF治疗相关疾病的基础研究不断增多,运用其治疗多种疾病的临床试验也在不断开展。使用“血管基质组分”或“脂肪干细胞”等关键词在临床研究数据库(www.ClinicalTrials.gov)中进行搜索,除去已被撤回的研究之外,总共可找到47项涉及人体的注册临床研究,其中大多数都处于Ⅰ期和Ⅱ期临床研究阶段,也有少部分还处于临床前的招募受试者状态。SVF在不同疾病中开展的一些主要临床试验如表3所示。
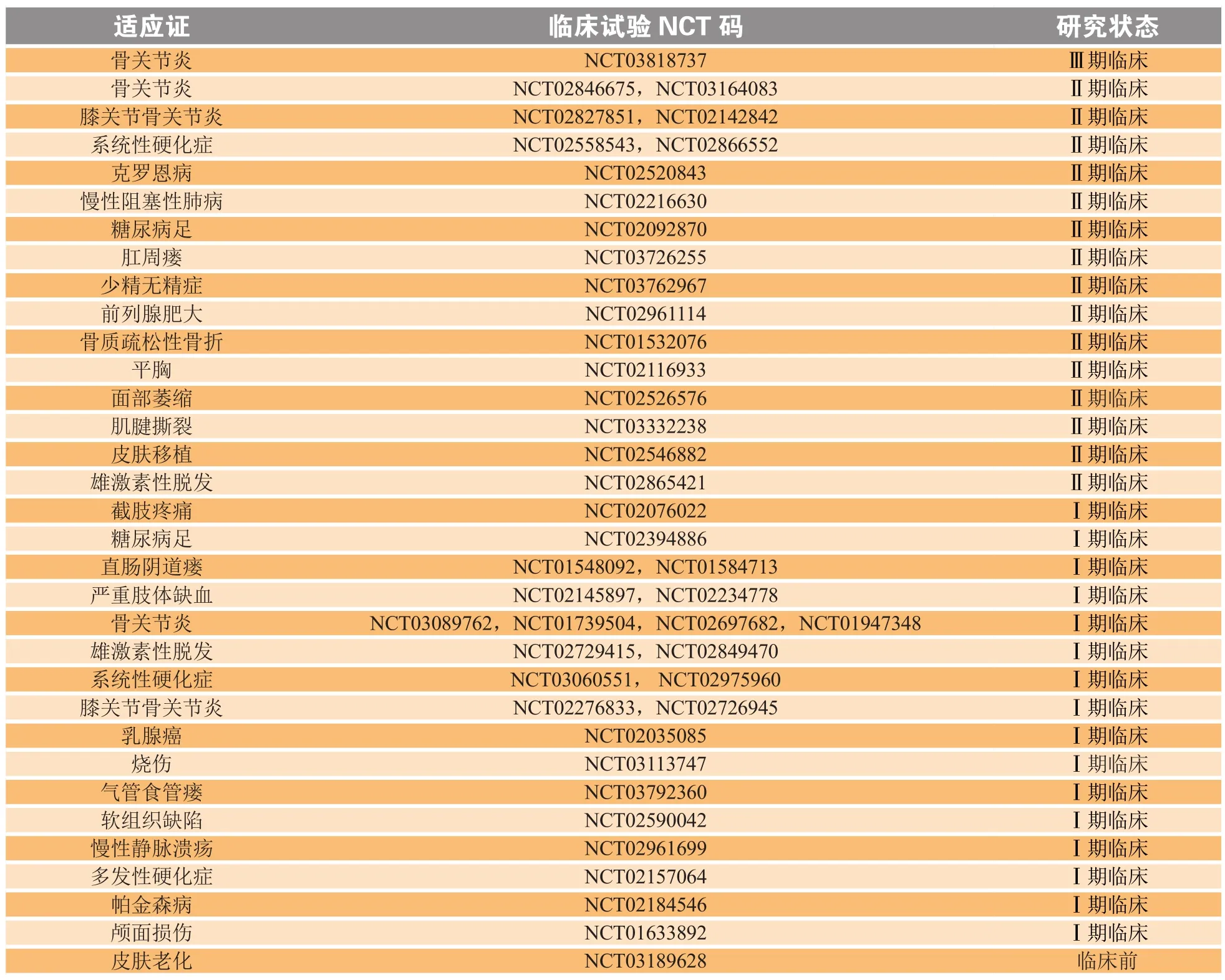
表 3 SVF临床试验概述Table 3 Overview of SVF clinical trials

续表3
4 结语
脂肪来源SVF细胞的治疗潜力及安全性已经在脂肪转移和各种疾病模型中得到验证,相关的临床试验也在顺利进行。虽然SVF在再生医学中的应用潜力巨大,多数疾病治疗的研究报道也显示出良好的治疗效果,但是也存在由于脂肪干细胞的滥用,最后使患者出现视力下降、肿瘤发生甚至死亡的情况[80-81]。因此,美国FDA对用于临床治疗的干细胞制品制订了严格的监管标准。目前采用酶消化法提取SVF的方式,在FDA文件中被明确指出“超过最小操作”,所以此法分离的细胞制品只能作为生物制剂使用,且需要经过FDA的严格监管[82]。因此在后续的实验开展中研究者仍需要探索其他提取SVF的新型方法。
虽然SVF具有的多细胞组分可以实现血管再生、组织重建和抗炎等多种功能,但是这种异质细胞群完成以上复杂生物学过程的具体基质还不够清楚。现有的研究表明,SVF细胞可通过胞外分泌和细胞分化等机制在受损组织或器官中发挥再生潜力;此外也能通过免疫调节作用减少炎症的发生,从而增强机体免疫耐受性[83]。这些生物功能可能是由特定种类的细胞群产生,亦或是需要多种细胞组分协同参与才能实现,但是其中各种细胞群的具体参与机制和贡献情况有待进一步的阐明。另外,由于使用细胞表面分子鉴定SVF细胞表型仍存在不确定性,所以有关SVF细胞表型及其具体变化情况也需要更加系统深入的研究。总的来说,以干细胞疗法为主的SVF细胞治疗还处于早期研究阶段,但其临床应用潜力巨大。相信随着基础研究的不断深入,脂肪来源SVF细胞会在临床中展示其独有的细胞优势和治疗价值。

[专家介绍] 金亮:博士,教授,江苏省特聘教授,博士生导师。江苏省杰出青年基金获得者,江苏省“333高层次人才培养工程”第二层次培养对象,江苏省青蓝工程科技创新团队带头人,江苏省科技创新团队核心人才,江苏省“六大人才高峰”优秀人才。2006年6月于中国药科大学获博士学位,同年8月留校任讲师;2010年5月晋升为副教授,同年7月赴美国国家医学中心(City of Hope)从事博士后研究,2014年5月返回中国药科大学,同年聘为教授。主要研究方向为人脂肪源干细胞在组织损伤中的应用与开发;组织干细胞的正常发育、变异及肿瘤干细胞的形成机制;糖尿病治疗的多肽类药物研究与开发。近5年主持及参与国家863计划项目、国家“重大新药创制”科技重大专项及国家自然科学基金项目多项。目前发表SCI收录研究论文30余篇,授权专利5项。

