抑制PI3K/AKt信号通路对帕金森病相关基因Nurr1表达的影响
庞霖霖 欧阳强 韦宁 钟才 刘亚媛 周少旦 吕庚珉 何荣新 闫灵婉
(广西壮族自治区民族医院 广西医科大学附属民族医院神经内科,广西 南宁 530001)
帕金森病(PD)是除阿尔茨海默病外的第二大中枢神经系统退行性疾病,发病呈年轻化趋势〔1〕。目前,PD仍无明确的发病机制,研究显示小胶质细胞参与的神经炎症贯穿PD的发病及其进程中〔2〕,小胶质细胞作为中枢神经系统内固有的神经免疫细胞,根据功能状态的不同可以分为经典激活M1型和选择激活M2型〔3〕,M1型主要促进炎症因子和氧化应激分子的释放,造成组织损伤;M2型主要具有抑制炎症、促进组织修复及发挥神经保护作用。在大脑损伤、病理状态或其他刺激下,小胶质细胞大量激活通过释放肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6、干扰素(IFN)-γ等,这些因子又可以造成多巴胺能神经元的死亡〔4〕。中脑黑质是小胶质细胞较为密集的区域,对神经炎症的过程比较敏感。孤核受体家族成员Nurr1基因不仅可以在体内外发挥抑炎作用,而且对多巴胺酪氨酸羟化酶(TH)形成及多巴胺能神经元的表型分化也发挥关键作用〔5〕。
近年研究发现,磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKt)信号通路与PD联系较紧密,牡荆素可以激活PI3K/AKt信号通路对PD模型的多巴胺能神经元发挥保护作用〔6〕;PI3K/AKt信号与PD的炎症机制存在密切关联,Shh信号通路激活抑制小胶质细胞介导的中枢神经系统炎症与PI3K/AKt信号通路的激活有关〔7〕,目前尚无单独研究PI3K/AKt信号通路与PD相关基因Nurr1的关系。本实验拟分析抑制PI3K/AKt信号通路对Nurr1及抗炎因子表达的影响。
1 材料和方法
1.1 材料与试剂 BV2细胞株(广州吉妮欧生物科技有限公司);胎牛血清(FBS)、DMEM 高糖培养基、含乙二胺四乙酸(EDTA)胰蛋白酶、青链霉素、磷酸盐缓冲液(PBS)等(GIBCO公司,美国);脂多糖(LPS,Sigma公司,美国);LY294002(LY,Santa Cruz公司,美国);电化学发光(ECL)液(赛默飞公司,美国);Trizol试剂 (invitrogen 公司,美国);荧光定量(Q)-PCR试剂盒、逆转录试剂盒、RNase-free H2O(TakaRa公司,大连);CCK-8试剂(碧云天,中国)β-acting、辣根过氧化物酶(HRP)-山羊抗兔(中杉金桥生物技术有限公司,中国);引物由invitrogen 公司合成。引物序列为β-actin正义:5′-GTTACAGGAAGTCCCTCACCC-3′,反义:5′-CAGAAGCAATGCTGTCACCTT-3′;Nurr1正义:5′-AAGACCTTCTCCCAAGCACG-3′,反义:5′-GAACTGGACACTTCAACCAGC-3′;IL-4正义:5′-TCACTGACGGCACAGAGCTA-3′,反义:5′-TGTCGCATCCGTGGATATGG-3′;TGF-β1正义:5′-GGTCCTTGCCCTCTACAACC-3′,反义:5′-CCACGTAGTAGACGATGGGC-3′。
1.2 细胞培养 BV2小胶质瘤细胞系在高糖型DMEM 培养基(含10%FBS、100 U/ml 青霉素和100 pg/ml链霉素)中培养。培养箱环境为95%空气、5%CO2、37℃。
1.3 细胞处理及分组 BV2细胞悬液以1×105/ml的密度接种于6孔板中,置于培养箱中培养,第2天换液的同时处理细胞,细胞分为5组,对照组:正常培养基;LPS组:1 μg/ml LPS添加到培养基中培养;LY+LPS组:20 μmol/L LY先处理0.5 h,再用1 μg/ml LPS添加到培养基中培养;LY组:20 μmol/L LY处理。收集各组细胞上清液。
PC12细胞以1×105/ml的密度接种到96孔板中,培养箱中培养过夜后换液并处理细胞,各处理组加入BV2细胞处理后上清液,对照组加入不含细胞的培养液,每组分别设3个复孔,24 h后CCK-8检测其存活率。
1.4 Western印迹检测p-AKt蛋白含量 按上述方法培养和处理细胞后提取细胞总蛋白,聚氰基丙烯酸正丁酯(BCA)法检测蛋白浓度,调平各组细胞浓度,各组取40 μg蛋白样品于聚丙烯酰胺凝胶电泳,275 mA 电流2 h将蛋白转印至聚偏氟乙烯(PVDF)膜,用封闭液(50 g/L BSA、0.1% Tween-20 TBS)封闭后,加p-AKt抗体(1∶1 000)、AKt抗体(1∶1 000),4℃孵育过夜。次日,二抗于室温孵育2 h,化学发光显影。
1.5 Q-PCR检测IL-4、TGF-β、Nurr1 mRNA表达量 按上述方法培养和处理细胞后用Trizol 法提取各组细胞总RNA。在NanoDrop-1000分光光度计上检测RNA水平,按RT-PCR 反转录试剂盒将RNA逆转录为cDNA。采用SYBR荧光染料法,反应体系为SYBR 10 μl、ROX 0.4 μl、 cDNA 2 μl、上下游引物各0.8 μl、ddH2O 6.0 μl;ABI 7500软件检测分析,扩增条件:预变性95℃ 30 s;95℃ 5 s,60℃ 34 s,共40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s,每个样本设3 个复孔。
1.6 CCK-8检测PC12细胞的存活率 按上述PC12细胞培养和处理后,去掉旧的培养基,每孔加入新的200 μl培养液和20 μl CCK-8工作液,避免气泡产生;将96孔板放入培养箱培养1 h后,酶标仪上450 nm波长检测每组的光密度(OD)值。存活率=(用药组平均OD值-空白组平均OD值)/(对照组平均OD值-空白组平均OD值)×100%。
1.7 统计学分析 应用SPSS16.0软件进行单因素方差分析。
2 结 果
2.1 各组P-AKT、AKT蛋白表达比较 LPS组P-AKt及AKt蛋白表达明显低于对照组(P<0.01);与LPS组相比,LY+LPS组和LY组P-AKt/AKt蛋白显著下降(P<0.01)。各组AKt蛋白表达差异无统计学意义(P>0.05)。见表1,图1。
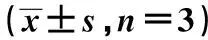
表1 各组P-AKt、AKt蛋白表达水平比较
与对照组比较:1)P<0.01;与LPS组比较:2)P<0.01;与 LY+LPS 组比较:3)P<0.01;同下表

图1 Western印迹测各组P-AKt、AKt蛋白表达
2.2 各组IL-4、TGF-β、Nurr1 mRNA比较 与对照组相比,LPS组IL-4、TGF-β、Nurr1 mRNA显著升高(均P<0.01);与LPS组相比,LY+LPS组和LY组显著升高(P<0.01);LY+LPS组IL-4、TGF-β mRNA略高于LY组,但差异无统计学意义(P>0.05),而Nurr1 mRNA显著高于LY组(P<0.01),见表2。
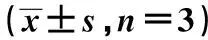
表2 各组IL-4、TGF-β、Nurr1 mRNA表达水平比较
2.3 各组PC12细胞存活率比较 与对照组(1.000±0.062)相比,LPS组PC12细胞存活率(0.816±0.052)显著下降(P<0.01);LY+LPS组(0.935±0.048)显著高于LPS组(P<0.05);LY组(0.975±0.096)与对照组差异无统计学意义(P>0.05)。
3 讨 论
PD的病因及其发病机制尚不明确,但已明确炎症参与PD发病及其进展〔8〕。研究发现,PD患者中脑内IL-1β、TNF-α、IFN-γ等炎症因子含量升高〔9〕。小胶质细胞作为中枢神经系统内固有的神经免疫细胞,约占成人大脑细胞的12%,且有与巨噬细胞相似的功能。作为大脑内的第一道防御线,小胶质细胞在炎症反应中发挥重要作用。研究发现,PD患者大脑中存在大量激活的小胶质细胞〔10〕,激活后的小胶质细胞可以加速诱导iNOS、IL-1β、TNF-α、IL-6等炎症因子的表达,而这些因子都会伴随PD患者及各种PD模型中多巴胺能神经元的退变〔11〕。中脑又是小胶质细胞密集的区域,且小胶质细胞一旦激活就会长期存在,多巴胺能神经元对小胶质细胞介导的神经炎症过程比较敏感,小胶质细胞的激活可贯穿PD发病及其进程的整个过程。
近年来发现,PI3K/AKt信号通路与神经退行性疾病有关,在氧化应激及PD模型内存在抑制作用〔12,13〕,而神经保护类药物发挥神经保护作用也是与PI3K/AKt信号通路的激活有关,如川芎嗪类似物 CXC195在6-羟基多巴诱导的PD模型内通过激活PI3K/Akt/GSK3β来保护多巴胺能神经元的凋亡〔14〕;也有研究发现PI3K/AKt信号与PD的炎症机制联系紧密,E3泛素连接酶c-Cb1抑制小胶质细胞介导的中枢神经系统炎症与PI3K/AKt信号通路有关〔15〕,金银花的提取物类黄酮也可以通过PI3K/AKt信号通路来抑制BV2细胞诱导的炎症反应〔16〕。
本实验结果发现,炎症反应中P-AKt蛋白明显下降,PI3K/AKt信号通路被抑制,这与其他文献结果相似〔13〕,而LY也可以明显抑制信号通路;炎症反应中抗炎因子IL-4、TGF-β的表达水平升高,与其他研究结果相同〔17〕,LY预处理抑制该通路后,可以明显上调LPS诱导的IL-4、TGF-β表达,而单独抑制该通路,抗炎因子也是表达升高。Nurr1作为多巴胺能神经元形成的关键基因,其表达升高在体内和体外都有一定的抑炎作用,本文发现LPS刺激后Nurr1表达升高,与前期研究结果一致〔18〕,有无LPS刺激,抑制PI3K/AKt信号通路都能够上调Nurr1表达。本文结果发现,炎症反应液能够明显抑制PC12细胞的增殖,LY+LPS则能减弱PC12细胞的抑制增殖作用,使PC12细胞存活率增加。
综上所述,PI3K/AKt信号通路在炎症反应中存在一定的抑制作用,LY进一步抑制PI3K/AKt信号通路后,可以上调PD相关基因Nurr1及抗炎因子IL-4、TGF-β的表达,且对神经元细胞也有一定的保护作用。

