双功能抑制剂SK10对Cu2+存在下Aβ聚集的抑制和解聚作用
董晓燕,董旭婷,孟 杰
(天津大学化工学院,天津 300354)
阿尔茨海默症(Alzheimer's disease,AD)是一种神经退行性疾病,主要病发于 65岁以上的老人,临床上的主要表现为:短期内出现记忆力下降、情绪波动以及意识混乱等症状,伴随时间病情愈发严重,最终会完全丧失自理能力,甚至导致死亡[1-2].目前,全球 AD患者数量正在迅速增长,因此对 AD的治疗和预防意义重大[3].
患者脑内出现淀粉样斑块(老年斑)是 AD最主要的病理学特征[4].淀粉样蛋白容易错误折叠形成富含β折叠的纤维状沉淀,其中β-淀粉样蛋白(amyloid β-protein,Aβ)是淀粉样斑块的主要组成部分.Aβ是淀粉样前体蛋白的水解产物,一般由 38~43个氨基酸组成[5].其中最丰富的是Aβ40和 Aβ42[6],神经毒性的主要来源是 Aβ寡聚体和成熟的 Aβ纤维[7-8].所以,抑制Aβ聚集是治疗AD的有效手段.
研究发现,在AD患者脑内的淀粉样斑块中还有较高浓度的金属离子(Cu2+、Fe3+、Zn2+和 Al3+等),并与 Aβ结合,加速 Aβ聚集[9],加剧聚集体的神经毒性,并产生更高的氧化压力,从而进一步加重患者的临床症状[10].另外,Cu2+在体内的平衡失调,会促进活性氧(ROS)的产生,增加氧化应激,带来更大的神经毒性[11-12].因此,有研究者开发了一些金属螯合的Aβ聚集抑制剂.如:亲脂螯合剂(DP109)已被证明能在老鼠模型中降低 Aβ聚集体并增加可溶性 Aβ[13];在Tg2576模型小鼠中,使用氯碘羟喹(CQ)口服治疗可减少淀粉样蛋白的沉积[14].近年研究发现,有些三肽对 Cu2+具有特异性的螯合作用,且不会影响体内其他维持正常生理功能的重要金属离子的作用,因此备受关注[15].研究表明,这些三肽具有以下特征:具有氨基末端的游离氮、第3位组氨酸侧链的咪唑氮和第1、第3位氨基酸残基之间的2个肽氮,这4个氮与铜在正方形平面构型中可以得到配位[16].
另外,多肽作为 Aβ聚集抑制剂,相比于其他抑制剂具有许多优势.如易于合成和修饰、具有良好的生物相容性和结合特异性等[17-18].Aβ的某些片段、例如 Aβ16-20(KLVFF)、Aβ17-21(LVFFA)、Aβ32-37(IGLMVG)和 Aβ37-42(GGVVIA)[19-22]等经常被用作 Aβ聚集抑制剂的设计起点,因为序列的同源性,这些片段能够和全长的 Aβ特异性结合.本实验室通过在 LVFFA的 C-末端增加 2个带正电荷的氨基酸残基R和K,得到七肽抑制剂LK7(LVFFARK).因为增加了静电作用,所以 LK7更好地发挥了抑制Aβ聚集的效果[23].
由于金属离子 Cu2+会对 Aβ的聚集产生影响并与 AD的发病密切相关[24],因此设计一种既可抑制Aβ聚集、又可结合金属离子 Cu2+的双功能抑制剂显得尤为重要.基于 Mlynarz等[25]研究证明金属螯合三肽(SSH)是一种有效且稳定的 Cu2+螯合剂,本研究将 SSH和 LK7连接,形成十肽(SSHLVFFARKNH2)双功能抑制剂 SK10.通过硫代黄素 T(ThT)荧光、原子力显微镜(AFM)和细胞毒性等实验,评估了SK10对 Cu2+存在下的 Aβ40聚集的抑制作用;以酪氨酸荧光和等温滴定量热法(ITC)证明了 SK10对Cu2+的亲和力和特异性,并利用香豆素-3-羧酸(3-CCA)荧光实验分析了 SK10对 ROS产生的抑制作用.最后考察了 SK10对 Cu2+-Aβ40聚集体的解聚作用及其对细胞毒性的缓解作用.
1 材料和方法
1.1 试剂与仪器
实验试剂:2-[4-(2-羟乙基)-1-哌嗪]乙磺酸(HEPES)、ThT、二甲基亚砜(DMSO)、3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物(MTT)和 3-CCA 均购自 Sigma公司(圣路易斯,密苏里州,美国);1,1,1,3,3,3-六氟-2-丙醇(HFIP)购自萨恩化学技术有限公司(上海,中国);抗坏血酸从J&K Scientific(北京,中国)获得;Aβ40(纯度>95%)购自吉尔生化有限公司(上海,中国);SK10、LK7和SSH(纯度>95%)购自紫域生物科技有限公司(中国上海);DMEM/F12培养基和胎牛血清(FBS)购自Gibco公司(加利福尼亚州,美国);人神经母细胞瘤SH-SY5Y细胞购自中国科学院细胞库(上海,中国).
实验仪器:冷冻干燥仪(Labconco FreeZone,Labconco,美国);荧光分光光度计(LS55,PerkinElmer,美国);酶标仪(Infinite M200,Tecan,瑞士);原子力显微镜(CSPM5500,本原纳米仪器有限公司,中国);等温滴定量热仪(VP-ITC,MicroCal,美国).
1.2 β-淀粉样蛋白单体溶液的制备
Aβ单体的制备参见文献[26],将保存在-70℃的Aβ以1mg/mL的浓度溶解在HFIP中,超声处理30min以破坏残留的 Aβ聚集体,之后静置 2h以便Aβ充分溶解.最后将溶液放在-70℃下冷冻干燥过夜. 然后将冷冻的样品放在真空冷冻干燥仪中去除HFIP,得到 Aβ粉末在-20℃下保存备用.取适量处理好的蛋白,溶于 20mmol/L的 NaOH溶液,超声10min,用 pH=7.4的 hepes缓冲液配成适当浓度的Aβ样品.
1.3 ThT荧光实验
称取适量Aβ溶于20mmol/L的NaOH溶液中,制成浓度为 275µmol/L的母液,将 Aβ(25µmol/L)与CuCl2(10µmol/L)和不同浓度的多肽抑制剂(即SSH、LK7和 SK10)在 37℃、150r/min的空气摇床中共培养 72h后取样检测.取适量样品,用 ThT染液(25µmol/L ThT,20mmol/L hepes)稀释 11倍后,通过荧光光谱仪测定ThT荧光强度.仪器参数为:激发波长 440nm,发射波长 480nm,激发光谱/发射光谱带宽5nm.将仅含Aβ样品的荧光强度设为100%进行归一化处理.每个实验点至少重复 3次取平均值.
1.4 动力学实验
将 200µL 含有 25µmol/LAβ40单体、25µmol/L ThT、10µmol/L CuCl2和不同浓度的多肽抑制剂的样品在96孔板中混合,并在 37℃下培养.通过多功能酶标仪 10min读数间隔记录每个孔的荧光强度,440nm 激发波长,480nm 发射波长,并在每次测量之前振荡 5s.使用 S形拟合方程[27]对聚集的动力学增长曲线进行归一化,即
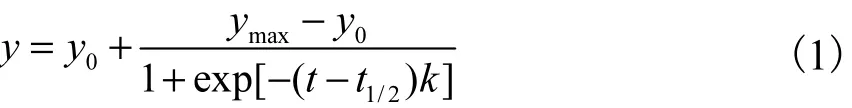
式中:y为时间t的荧光强度;y0和ymax分别为最小和最大荧光强度;t1/2为荧光强度达到最大强度的 1/2时的时间;k为聚集速率常数.根据拟合,可以计算滞后阶段时间Tlag为

通过动力学实验分析多肽抑制剂对 Cu2+存在下Aβ40聚集体的解聚作用.将含有25µmol/L Aβ40单体和10µmol/L CuCl2在37℃、150r/min间歇摇动的空气摇床中培养 72h 后,加入不同浓度的多肽抑制剂在 96孔板中混合,并在 37℃下培养.通过酶标仪记录每个孔的荧光强度.
1.5 原子力显微镜实验(AFM)
利用原子力显微镜观察 Cu2+存在下 Aβ的形貌特征.原子力显微镜检测样品同 ThT荧光实验一致.将 50µL样品滴在新鲜切割的云母底物上5min,用去离子水轻轻冲洗,空气干燥过夜,使用CSPM5500原子力显微镜在轻敲模式下扫描,共振频率为30kHz,调制强度为1.5V.每个样品至少扫描4个不同的部位.
1.6 酪氨酸荧光检测
酪氨酸荧光分析可以用来检测Cu2+与Aβ40的结合程度以及多肽抑制剂对其抑制作用.Aβ40中 Tyr10具有荧光效应,而 Cu2+与 Aβ40结合后会产生荧光猝灭,抑制剂与 Aβ40结合的 Cu2+螯合后,Aβ40中 Tyr10恢复产生荧光.实验用荧光分光光度计进行检测.激发光波长 274nm,发射光 299nm,激发和发射狭缝宽度均为 5nm.将含有 Aβ40(25µmol/L)、CuCl2(10µmol/L)和不同浓度的多肽抑制剂在37℃下培养20min后检测.
1.7 等温滴定量热实验(ITC)
等温滴定量热实验使用 VP-ITC在 37℃进行.首先将 SK10溶解于 hepes缓冲液中,终浓度为0.5mmol/L.脱气 15min后加入至 1.425mL的样品池中.然后将甘氨酸和 CuCl2溶解于 hepes缓冲液中,终浓度 10mmol/L和 2.5mmol/L,置于滴定针中,两个溶液都含有5%DMSO.每350s滴定1次,一共滴定 26次,样品池转速为 307r/min.作为对照实验,将 hepes缓冲液加入到样品池中,从而得到滴定过程中的稀释热.在结果分析时,把稀释热从实验结果中减去.每组实验重复3次取平均值.
1.8 3-CCA荧光测定实验
3-CCA荧光实验用来监测羟基自由基 HO·的生成速率,来评估 SK10螯合金属离子 Cu2+的效果.Cu2+在还原剂抗坏血酸存在下被还原成 Cu+,Cu+催化生成HO·,香豆素-3-羧酸(3-CCA)能够与HO·反应生成具有荧光效应的香豆素-7-羧酸(7-CCA),因此通过检测体系的荧光变化就可以反映 HO·的生成速率[28-29].将 10µmol/L Cu2+、25µmol/L Aβ40、不同浓度的多肽抑制剂、500µmol/3-CCA 和 500µmol/抗坏血酸混合后用荧光分光光度计进行检测,荧光激发波长 390nm,发射波长 447nm.结果是 3次独立实验的平均值.
1.9 MTT细胞实验
使用SH-SY5Y细胞进行MTT测定以评估多肽对Aβ40细胞毒性的作用.将SH-SY5Y细胞在补充有15%FBS、100U/mL青霉素和 100U/mL链霉素的DMEM/F12中于 37℃、5%CO2下培养.将 SHSY5Y 细胞(80µL)以 8×103个细胞/孔的密度加入 96孔板中,在 CO2细胞培养箱中培养 24h.然后,用20µL 预先培养的 Aβ40(25µmol/L)、Cu2+(10µmol/L)、不同浓度的多肽处理细胞,再过 24h.之后每孔加入10µL MTT溶液(5.5mg/mL),培养 4h后,用 100µL DMSO代替培养基以溶解晶体.然后,通过多功能酶标仪测量570nm处的吸光度.
通过 MTT实验测定多肽对 Cu2+-Aβ40聚集体细胞毒性的作用.将含有 25µmol/L Aβ40单体和10µmol/L CuCl2在 37℃、150r/min间歇摇动的空气摇床中培养72h 后,加入多肽抑制剂继续培养48h,之后按照相同的方法进行 MTT实验.进行 5次重复,并将数据平均.以不含细胞的样品作为空白组,以仅含有细胞的样品作为对照组(100%),对细胞活性进行归一化.计算学生t检验用于统计学比较以分析方差,并且p<0.05或更小被认为是统计学显著的.
2 结果与讨论
2.1 SK10对Cu2+存在下Aβ40聚集的抑制作用
为了考察 SK10对 Cu2+存在下 Aβ40聚集的抑制作用,在此进行了 ThT荧光测定和聚集动力学测定(见图1).可以看到,若将单独Aβ40聚集的ThT荧光强度定义为100%,那么在Cu2+存在下,不但ThT荧光强度比单独 Aβ40降低约 40%(见图 1(a)),而且Aβ40的聚集延迟期缩短到 15h左右(见图 1(b)),说明 Cu2+会促进 Aβ40聚集,且形成一种 β-sheets结构较少的聚集体[30-31].当加入 SK10后,由于其对 Cu2+具有螯合作用,因此在低浓度(低于12.5 µmol/L)时,即可减轻Cu2+对Aβ40的作用,使ThT荧光得到一定恢复;且随着 SK10浓度的提高,由于其又可发挥对聚集的抑制作用,因此表现出 ThT荧光不断降低,如:当 SK10浓度提高到 200µmol/L时,荧光强度降低了 60%左右(见图 1(a));从动力学结果(见图1(b))发现,低浓度SK10并不能改变 Cu2+对 Aβ40聚集延迟期的缩短,但当浓度大于 100µmol/L时,延迟期稍有延长.虽然LK7不具有结合Cu2+的能力(未显示结果),但低浓度仍具有抑制 Aβ40聚集的作用,所以可使荧光强度进一步降低;但当浓度大于100µmol/L时,由于其发生自聚,对 Aβ聚集的抑制作用减弱,荧光强度又有所上升[23].SSH虽然可以螯合Cu2+,但没有抑制Aβ40聚集的作用(未显示结果),所以加入 SSH后,只是使 ThT荧光恢复到与单独Aβ40相当的程度(见图 1(a)).SK10连接 SSH后改善了 LK7的自聚性质,即使在高浓度下也能抑制Aβ40聚集(见图 1(a)),而仅仅通过单纯的 SSH 和LK7的物理混合并不能改变 LK7的自聚,提高抑制作用,所以这是SK10作为Aβ抑制剂的优势.
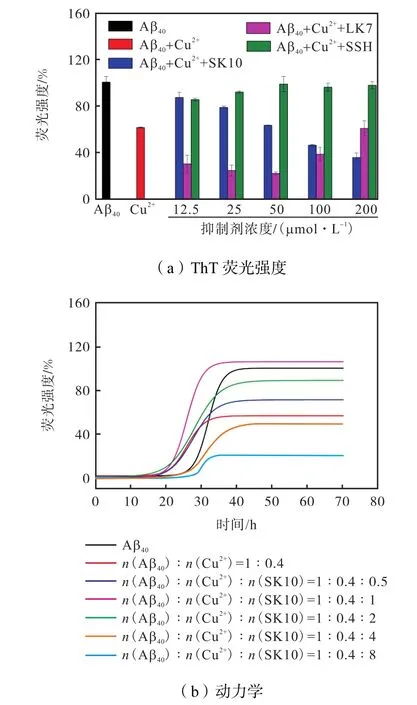
图1 多肽抑制剂对Cu2+存在下Aβ40聚集的影响Fig.1 Effect of peptide inhibitors on Aβ40 aggregation in the presence of Cu2+
图 2为不同实验条件下,SK10对 Cu2+存在下Aβ40形态的影响.可以看到,单独的 Aβ40形成大量的纤维结构(见图 2(a));当 Aβ40与 Cu2+共同培养时,观察到球形颗粒和少量的短纤维(见图 2(b));但当加入低浓度的 SK10(12.5µmol/L和 25µmol/L)后,球形颗粒消失,纤维逐渐增加(见图 2(e)和(f));随着 SK10浓度进一步增加,纤维不断减少,添加200µmol/L 时,纤维完全消失(见图 2(h)和(i)).这些结果与 ThT荧光结果相一致(见图 1),说明添加200µmol/L的 SK10即可完全抑制 Cu2+存在下 Aβ40聚集.但对于 SSH而言,由于 SSH只能螯合 Cu2+,不能影响 Aβ40聚集,所以加入 SSH 后,重新出现大量纤维(见图2(c)和(d)).常数(Kd)分别为 0.03µmol/L和 0.09µmol/L,表明两者对 Cu2+的结合亲和力相近.但值得注意的是,对Cu2+的结合能力而言,SK10的 Kd值比 Aβ40(2.79µmol/L[33])低了近百倍,说明SK10远高于Aβ40对 Cu2+的亲和力,因此 SK10可以和 Aβ40竞争螯合Cu2+,从而抑制Cu2+-Aβ40聚集体的形成.同时由表1可知,反应的吉布斯自由能ΔG小于0,说明SK10和SSH与Cu2+的结合可以自发进行;ΔH和TΔS都小于0,且ΔH的绝对值大于TΔS,说明是一个焓驱动的反应,因此在结合过程中,静电和氢键为主要作用力.
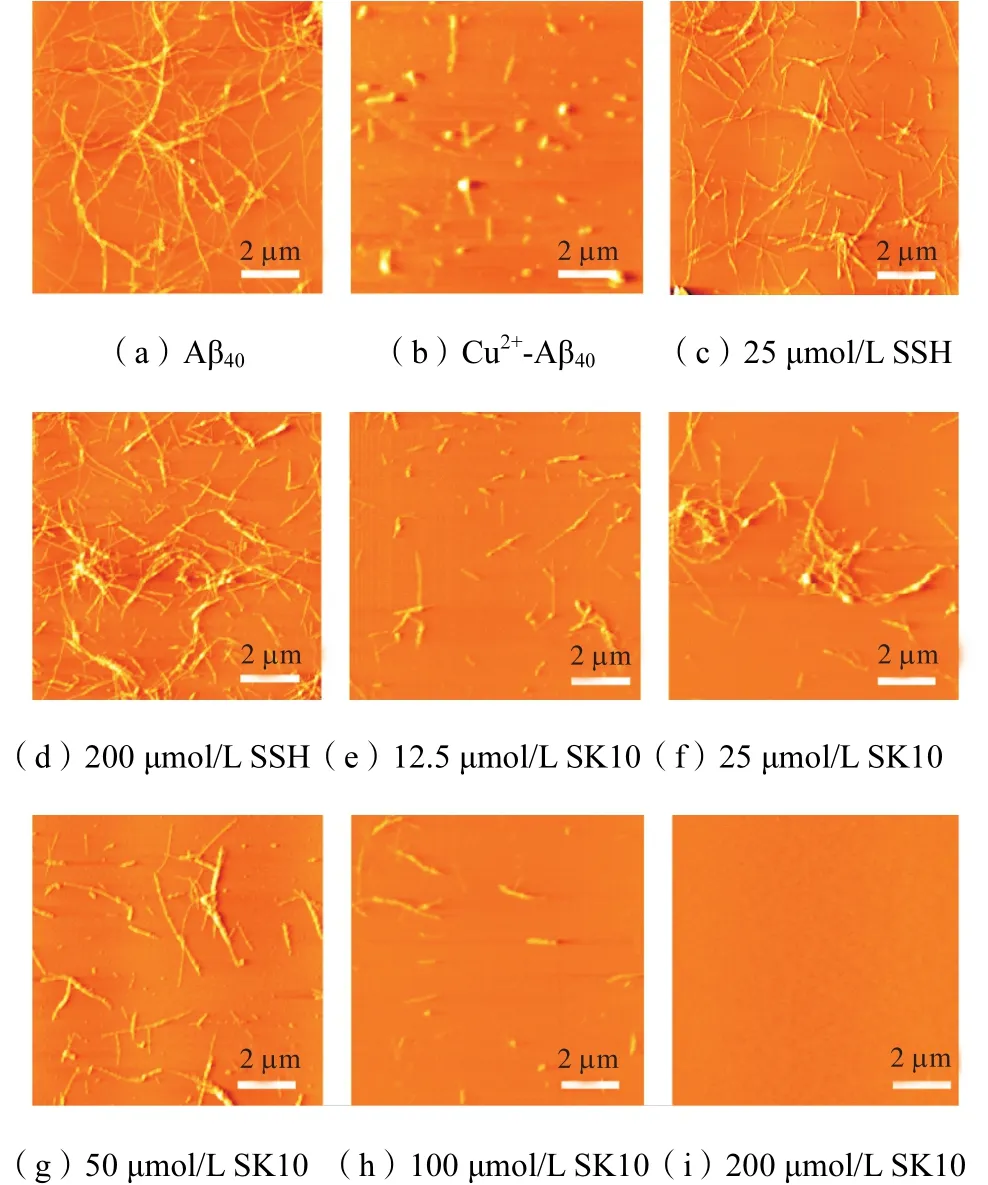
图2 多肽抑制剂和Cu2+存在下Aβ40聚集体的AFM图像Fig.2 AFM images of Aβ40 aggregation with peptide inhibitors and Cu2+
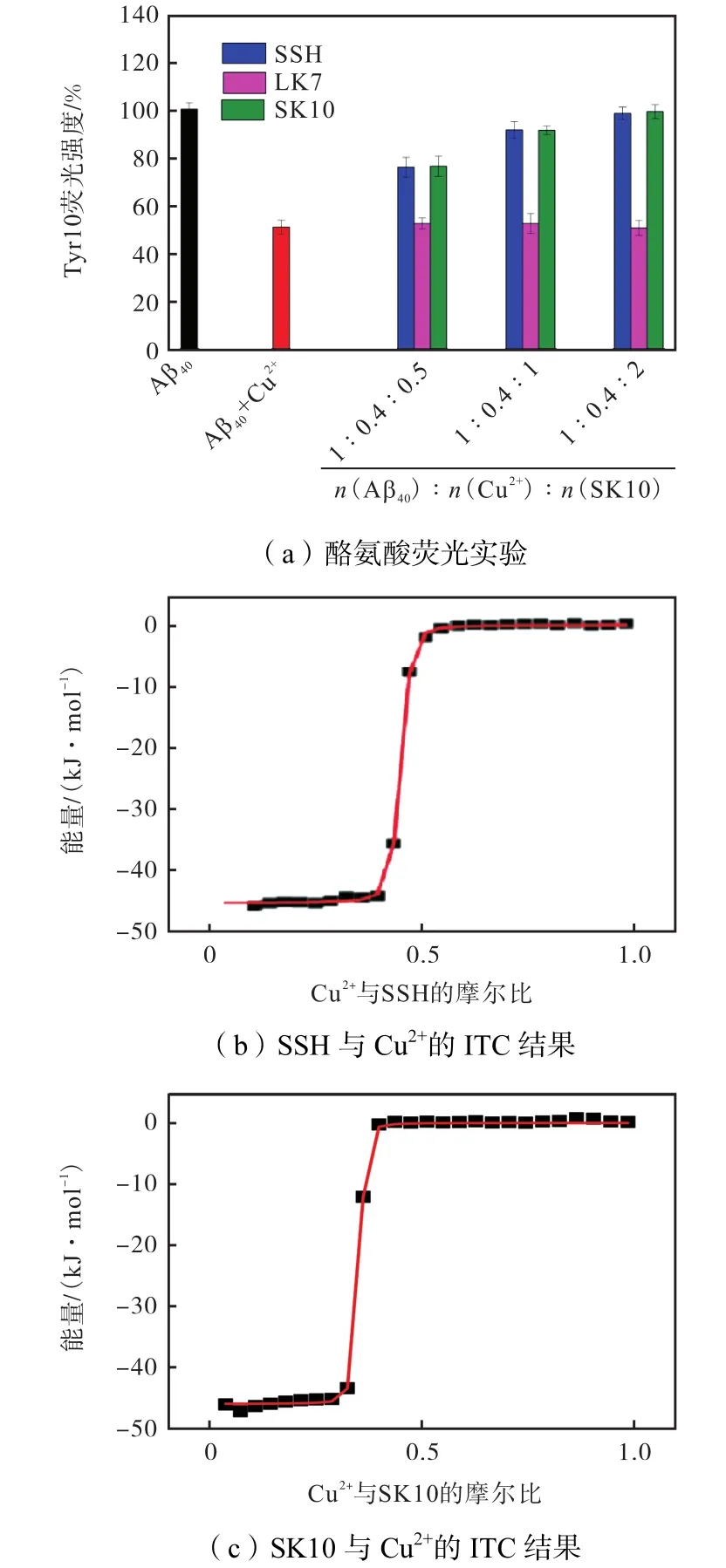
图3 多肽抑制剂对Cu2+的螯合作用Fig.3 Chelation of peptide inhibitors on Cu2+
2.2 SK10对Cu2+的螯合作用
由于 Cu2+可以淬灭 Aβ40中 Tyr10处的内源荧光[32],加入 Cu2+螯合剂,其可以结合 Cu2+,使 Aβ40的荧光恢复.因此测定 Aβ40的酪氨酸荧光变化即可研究 SK10螯合 Cu2+的能力(见图 3(a)).由图可以看到,SK10和 SSH都可以使荧光恢复,且具有浓度依赖性,当 Aβ40、Cu2+和 SSH/SK10 的摩尔比为 1∶0.4∶0.5时即可有效抑制荧光猝灭,使荧光恢复到75%,当 Aβ40、Cu2+和 SSH/SK10的摩尔比增加至1∶0.4∶4时,酪氨酸荧光即可恢复到与对照Aβ40相当.而LK7对荧光几乎没有影响.
为了进一步考察SSH和SK10螯合Cu2+的热力学行为,在此利用 ITC进行了多肽和 Cu2+之间的结合亲和力测定(见图 3(b)和图 3(c)),并计算它们的热力学常数(见表1),得到SK10和SSH的解离平衡

表1 Cu2+结合多肽抑制剂的热力学参数Tab.1 Thermodynamic parameters for Cu2+binding to peptide inhibitors
另外,在对 SK10与其他常见金属离子(Ca2+、K+、Mg2+和 Zn2+)的结合亲和力考察中发现,Ca2+、K+、Mg2+和 Zn2+的滴定曲线几乎没有波动(未显示结果),这意味着这些金属离子与 SK10之间几乎没有相互作用.说明 SK10可以选择性地螯合 Cu2+,是一种具有特异性的金属螯合Aβ聚集抑制剂.也进一步证明SSH是对Cu2+有特异性结合的三肽螯合剂.
2.3 SK10对ROS生成的抑制作用
由于 Cu2+会引发 ROS的形成,从而导致严重的氧化损伤.在此通过 3-香豆素三羧酸荧光定,考察了SK10对Cu2+或Aβ40存在下Cu2+诱导ROS产生的影响(见图4).图4(a)显示了SK10可以抑制Cu2+诱导的 ROS的生成,且存在浓度依赖性.可以看到,随着SK10与 Cu2+的摩尔比增加,荧光增长速率减慢并且最终荧光强度逐渐下降,当SK10与Cu2+的摩尔比提高到2∶1时,可以完全抑制ROS的生成.另外从图4(b)可知,由于 Aβ40也可结合 Cu2+[34],使其催化ROS生成减少,导致荧光值降低,但是 25µmol/L Aβ40却仍然不能完全抑制 ROS的生成.而 SK10对Aβ40存在下Cu2+引发的ROS生成速率就有明显的抑制作用.当 SK10与 Cu2+的摩尔比提高到 1.25∶1时,可以完全抑制 ROS 的生成,表明 SK10能有效螯合Cu2+以防止ROS产生.
由于 Cu2+催化的 ROS不仅可以产生氧化损伤,而且可以进一步增强细胞毒性[30,35-36],在此进行了MTT实验,评估了在 Cu2+与 Aβ40存在下 SK10对细胞的保护作用(见图5).SK10本身对SH-SY5Y没有细胞毒性(未显示结果),说明 SK10具有良好的生物相容性.由于 Aβ40的神经毒性小于 Aβ42,加入 Aβ40的细胞活力降低到 78%(与文献[36]中一致),加入Cu2+后,细胞活力进一步降低到 70%;但随着加入SK10的浓度不断提高,细胞活力逐渐增加,当Aβ40、Cu2+和 SK10的摩尔比为 1∶0.4∶4时,细胞活力增加至 92%.说明 SK10可以有效缓解 Aβ40聚集和Cu2+产生的ROS对细胞的毒性.而 LK7由于不能鳌合 Cu2+且其本身由于自聚也会产生细胞毒性[23],所以完全没有缓解细胞毒性.这是 SK10相比 LK7的明显优势.
2.4 SK10对形成的 Cu2+-Aβ40聚集体的解聚作用及其解毒作用
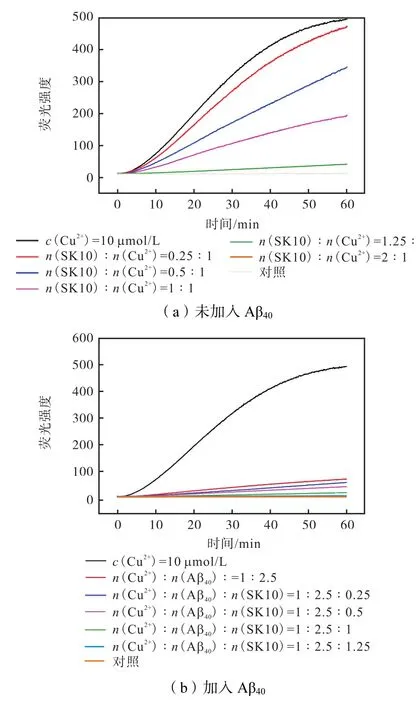
图4 通过 CCA荧光检测 SK10和 Aβ40对 Cu2+生成ROS的影响Fig.4 Effects of SK10 and Aβ40 on the ROS production through Cu2+ by measuring CCA fluorescence
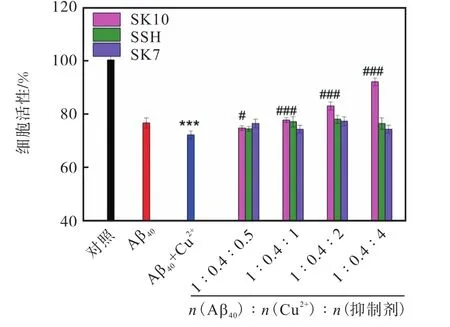
图5 多肽抑制剂对 Cu2+存在下的 Aβ40诱导的细胞毒性的抑制作用Fig.5 Inhibitory effect of peptide inhibitors on the cytotoxicity of Cu2+-Aβ40
如上所述,由于 SK10远高于 Aβ40对 Cu2+的亲和力,因此可以较强地竞争鳌合 Cu2+.为了考察SK10对已形成的 Cu2+-Aβ40聚集体的解聚作用,向培养 3d的 Cu2+-Aβ40聚集体中加入 SSH 或 SK10,以检测其解聚动力学(见图 6).由图 6(a)可以看出,与对照相比,加入SK10后,荧光迅速下降,并很快达到平台期,且具有浓度依赖性.虽然加入 SSH后也得到了类似的结果(见图 6(b)),但是荧光值下降没有SK10明显.这是因为SSH只能螯合Cu2+,却不能进一步作用于解聚后的Aβ40.
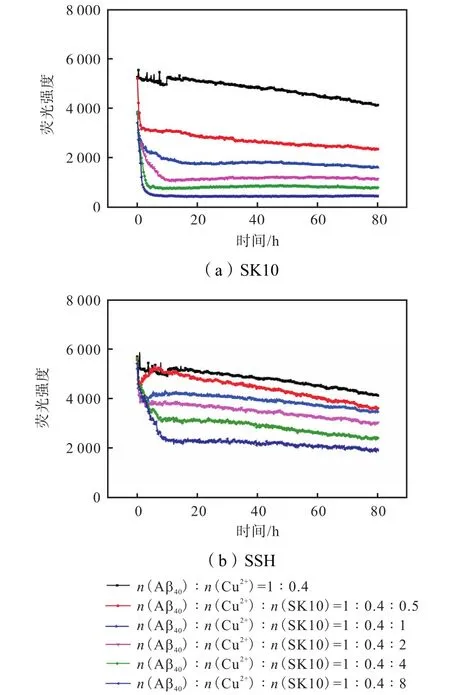
图6 多肽抑制剂对Cu2+-Aβ40聚集体的解聚作用Fig.6 Effect of peptide inhibitors on Cu2+-Aβ40 deploymerization
进一步通过 AFM 观察 SK10对 Cu2+-Aβ40聚集体形态的影响(见图7).当 Aβ40与 Cu2+共同培养时,观察到球形颗粒和少量的短纤维(见图 2(b)).当向Cu2+-Aβ40聚集体中加入 SSH 后(见图 7(a)和(b)),球形颗粒完全转变为短纤维;加入低浓度SK10后(见图 7(c)),同样出现大量短纤维,但是随着 SK10浓度的提高,纤维逐渐减少,当浓度提高到 200µmol/L时,纤维完全消失(见图 7(e)和(f)).此进一步证明了SK10对Cu2+-Aβ40聚集体具有解聚作用.
图8展示了通过MTT细胞实验检测的SK10解聚产物的细胞毒性.可以看到,加入 Cu2+-Aβ40聚集体的细胞活性为 70%左右,随着 Aβ40、Cu2+和SK10的增加,细胞活性可恢复到 90%左右(n(Aβ40)∶n(Cu2+)∶n(SK10)=1∶0.4∶8),说明 SK10 能够通过解聚 Cu2+-Aβ40聚集体,减小其细胞毒性.这意味着,SK10不仅可以抑制 Cu2+诱导的 Aβ40的聚集,也可以作用已有的聚集体,以减轻其对细胞的毒害作用,表现出更高的实用价值.

图7 加入抑制剂后Cu2+-Aβ40聚集体的AFM图像Fig.7 AFM images of Cu2+-Aβ40 aggregates with peptide inhibitors
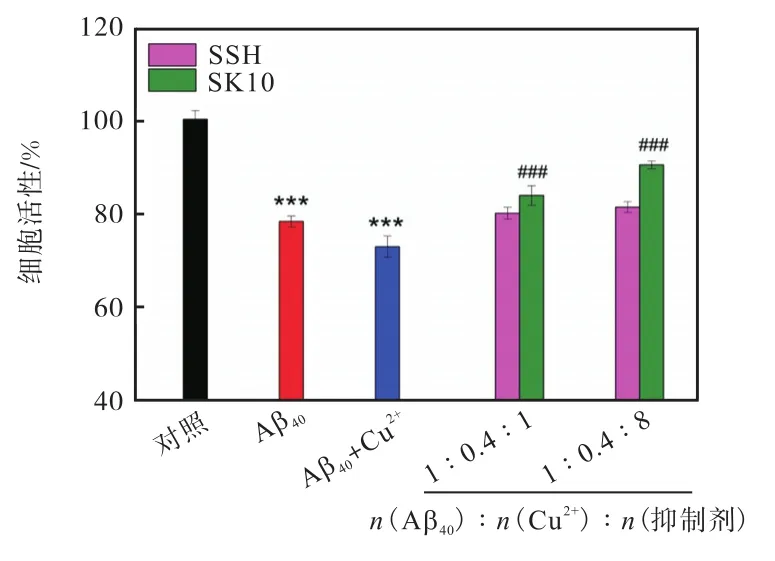
图8 多肽抑制剂对 Cu2+-Aβ40聚集体细胞毒性的抑制作用Fig.8 Inhibitiory effect of peptide inhibitors on the cytotoxicity of Cu2+-Aβ40 aggregates
2.5 SK10对Cu2+存在下Aβ42聚集的抑制作用
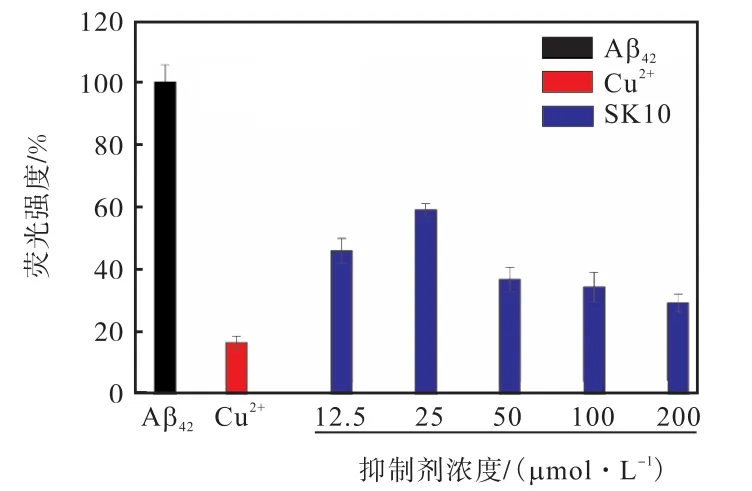
图9 SK10对Cu2+存在下Aβ42聚集的影响Fig.9 Effect of SK10 on Aβ42 aggregation in the presence of Cu2+
由于 Aβ42聚集速度更快且细胞毒性更大[37],所以进一步探究了SK10对 Cu2+存在下 Aβ42聚集的抑制作用见图 9.与图 1相似,SK10对 Cu2+存在下Aβ42的聚集抑制也十分明显,且由图 10可以看到,Cu2+和Aβ42形成球形聚集体(见图10(b)),当加入低浓度 SK10后,球形聚集体减少,纤维增加(见图10(c)),随着 SK10浓度提高,纤维逐渐减少至消失(见图 10(d)~(f)).这些结果说明,SK10不仅对Cu2+存在下 Aβ40的聚集有抑制作用,而且对 Cu2+存在下Aβ42的聚集也有抑制作用.
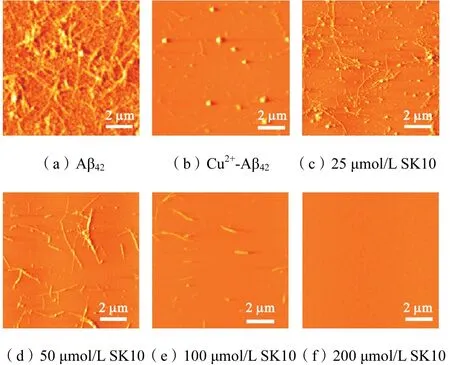
图10 SK10和Cu2+存在下Aβ42聚集体的AFM图像Fig.10 AFM images of Aβ42 aggregation with SK10 and Cu2+
3 结 语
本文设计了一种双功能十肽 Aβ聚集和解聚抑制剂SK10.证明了SK10能够抑制Cu2+存在下的Aβ的聚集,缓解聚集体引起的细胞毒性,抑制 ROS的产生;值得提出的是,SK10还具有解聚已形成的Cu2+-Aβ40聚集体的作用,减轻已形成的 Cu2+-Aβ40聚集体的细胞毒性.另外,SK10可选择性地螯合金属离子Cu2+,对Cu2+具有强亲和力和特异性.上述结果说明,本研究设计合成的双功能 Aβ聚集和解聚抑制剂(SK10)不仅在 AD治疗和预防药物的开发上有很大的潜力,而且可为进一步研发多功能 Aβ聚集抑制剂提供新的思路.

