精子DNA碎片指数对精子冷冻复苏率的影响*
胡 烨 范宇平 黄文强 王 羽 潘家坪 杨 昊 滕晓明
同济大学附属第一妇婴保健院生殖医学中心(上海 200040)
精子DNA碎片指数 (DNA fragmentation index,DFI)近年在全国范围已逐渐成为常规项目,多数研究和文献提示DFI对男性生殖,包括辅助生殖技术存在影响,即使是特发性的男性生育力低下[1-2]。然而也有争议,至少目前尚未形成DFI具体影响辅助生殖过程机制的定论。精子冷冻的过程对精子本身的染色质和顶体完整性存在影响[3],但是在辅助生殖技术当中,精子冷冻保存至今仍是不可缺少的重要内容之一。本研究拟探索精子冷冻前精子DFI水平是否对精子冷冻复苏存在影响。
材料与方法
一、一般资料
2017年在上海市第一妇婴保健院生殖中心行体外受精-胚胎移植(IVF-ET)的所有患者在术前行自精精子冷冻保存的共55例,排除因严重少弱精子症和隐匿精子症冻精的患者,实际入组患者36例,按DFI≥27%和DFI<27%分为两组。
二、精液标本的采集和处理
所有研究对象在留取精液前均禁欲2~7d,于本院取精室按标准步骤留取精液标本。受检者取精流程如下:排尿;用肥皂清洗双手和阴茎,减少来自皮肤共栖微生物所致的标本污染的风险;冲洗掉肥皂沫;使用一次性新的毛巾擦干手和阴茎;精液射入无菌容器。精液标本取出后立即放置于37℃温箱内,待精液充分液化后进行镜下分析。
三、精子DFI检测
精子DNA完整性检测采用浙江星博生物科技有限公司精子核完整性染色试剂盒(浙江星博生物科技有限公司,产品标准编号:YZB/浙(甬)0159-2-12)。 严格按照说明书的步骤进行标本制备操作。用流式细胞仪检测样本,检测时需在平衡样品线后,将已染好色的样本加入样品室,立即启动样品流,检测精子的流动速度(流动速度应在100~300个/s,若速度过大,应重新稀释样本);2 min后开始收集数据,至少有5 000个细胞的测定值加以记录和统计,每个样本至少连续检测2次。精子核经酸处理液处理后,经吖啶橙染色,异常精子核染色质成单链与染料吖啶橙结合发橙黄色或红色荧光;正常精子核染色质为双链,与吖啶橙结合发绿色荧光,若红光比值增高,说明精子核完整性程度降低。
四、精子冷冻
精液取出后,37℃温箱内液化。将冷冻保护剂取出,平衡至室温。精液液化后进行常规检查,包括精液量、颜色、气味、pH、液化情况、精子浓度、活力及细胞等情况。准备精液冷冻管,将患者姓名、病历号和冷冻日期等做好记录。根据精液的量,按照1:1的比例缓慢加入冷冻保护剂,边加入边摇晃混匀。充分混匀精液与冷冻保护剂,室温放置15min。将精液冷冻保存管固定在铝架上,悬于液氮平面上方15cm处,进行熏蒸,液氮盒加盖放置15min后,将冷冻管投入液氮,保存在液氮罐相应位置。
五、统计学方法
检测结果用SPSS16.0进行统计分析。数据以均数±标准差(±s)表示。计量资料采用两均数t检验,计数资料采用卡方检验,组间比较P<0.05提示差异具有统计学意义。
结 果
入组精子冷冻患者共36例,年龄 39.50±7.29(28~59)岁,不育年限 2.92±1.30(1~8)年。 分为 DFI≥27%组11例,DFI<27%组25例。比较两组患者年龄、不育年限及术前精子正常形态率,结果显示差异无统计学意义(P=0.29,P=0.77,P=0.28),见表 1。
表1 基本情况比较(±s)
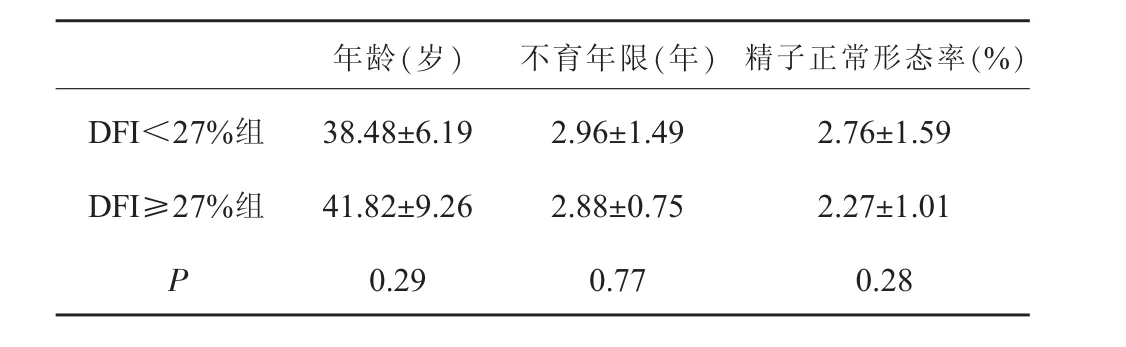
表1 基本情况比较(±s)
年龄(岁) 不育年限(年) 精子正常形态率(%)DFI<27%组 38.48±6.19 2.96±1.49 2.76±1.59 DFI≥27%组 41.82±9.26 2.88±0.75 2.27±1.01 P 0.29 0.77 0.28
DFI≥27%和DFI<27%的精子冷冻前后的浓度变化、活力变化及前向运动(PR)精子总数变化的差异均无统计学意义(P=0.07;P=0.76;P=0.58),见表 2。
以冷冻复苏率60%为分组标准,DFI≥27%组冷冻复苏率≥60%的患者4例;DFI<27%组冷冻复苏率≥60%的患者12例,比较两组冷冻复苏率差异无统计学意义(P=0.52),见表 3。
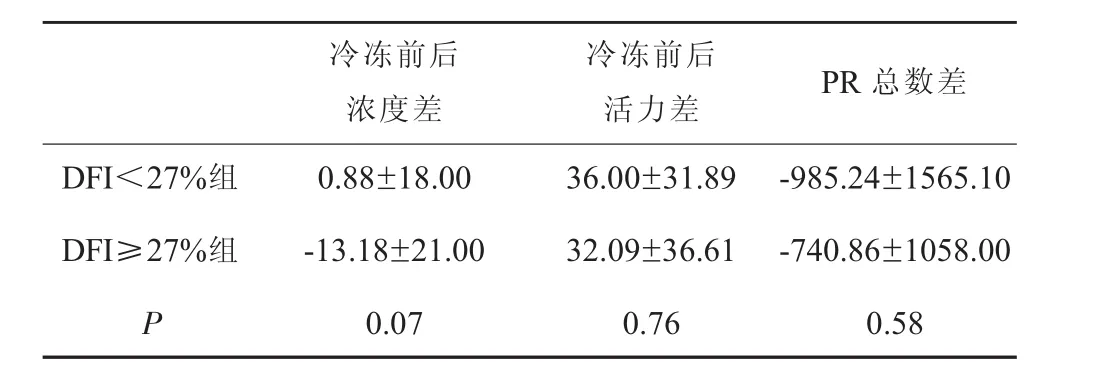
表2 两组冷冻前后浓度、活力和PR精子总数比较
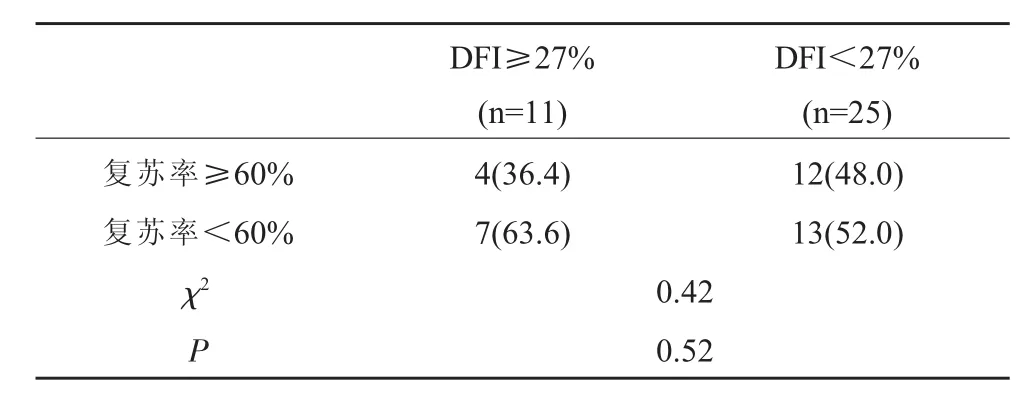
表3 不同DFI水平精子冷冻后复苏率分析n(%)
讨 论
精子DNA完整性的检测早在1993年就已被提出,由于费用、检测方法的可行性和标准不一致等问题,直到近年,DFI才作为男性精子功能的重要参数在临床广泛开展[4]。但是DFI的检测手段、治疗方法以及临床指导意义都存在不少争议。
DFI的参考值根据检测方法的不同而各有不同,本研究中DFI的检测均通过流式细胞术精子染色质检测(sperm chromatin structure assay,SCSA),按临床报告标准:DFI≤15%表示DNA完整性好;DF I15%~30%表示DNA完整性一般;DFI≥30%表示DNA完整性差。本研究以27%作为分组标准主要是参考了DFI检测方法相同的近期文献[3]。然而DFI结果是27%还是30%并不是直接表示剩余的精子是正常的,有文献指出剩余部分的精子已可能存在染色质完整性异常,只是检测方法未能发现[5]。基于精子细胞的独特结构,要研究其DNA损伤的机制比体细胞DNA损伤复杂,精子DNA在精子发生的生理过程中经历多次变化。而DFI的检测目前能提供的是一些DNA损伤在生殖过程中产生影响的前因后果的重要信息[6],故DFI参考值的界定在不同中心可能会有所不同,需要结合临床信息作判断。
在细胞冷冻过程中,冷冻损伤的发生是不可避免的,引起细胞冷冻损伤的主要因素为细胞渗透压改变以及温差骤变导致细胞内冰晶形成,从而造成细胞和细胞膜结构损伤,而在复苏过程中,复温速率也可能对细胞存活率形成影响[7]。既往认为DNA损伤的精子对低温的耐受能力下降,可能的机制是:精子DNA损伤严重的精液中活性氧(reactiveoxygenspecies,ROS)水平也增高,从而降低了精子对冷冻过程的耐受能力[8],另外DNA损伤可能随精子凋亡过程出现,精子DFI高相对精子凋亡率也增加[9],而凋亡精子可能对低温的耐受性差。
本研究结果显示DFI≥27%和DFI<27%的精子冷冻前后的浓度变化、活力变化及前向运动精子总数变化的差异均无统计学意义(P=0.07;P=0.76;P=0.58),比较两组冷冻复苏率也无统计学差异 (P=0.52)。该结果提示,精子冷冻前DFI水平对于精子冷冻过程没有明确影响;或者说,精子DFI水平高于正常并不是冷冻保存精子的禁忌证,并不是建议不处理DFI高的患者。DFI的影响较少在受精和受精卵过程表现出来,通常更多在胚胎3~5d或移植窗口期之后表现[10-12]。DFI对精子冷冻前后精液常规参数及冷冻复苏率不存在影响也与这一结论相符。
本研究结果发现精子冷冻前DFI水平对于精子冷冻后参数变化和复苏率没有影响,也明确高DFI并不能作为精子冷冻的禁忌证。当然结合ROS等氧化应激指标、采用不同的DNA完整性检测方式以及多中心、更大样本的临床数据分析可能是进一步研究的方向。

